粗盐提纯实验的再探究
2022-05-30赵雯
赵雯

摘要: 借助离子传感器和导电率传感器等数字仪器对粗盐提纯实验进行了探索与实践。实验过程发现,学生通过肉眼直接观察溶液不出现浑浊来判断离子沉淀完全的方法有局限性;通过对除杂过程中粗盐溶液导电率变化的测量,能帮助学生更加直观、准确地理解与判断沉淀是否完全、除杂试剂是否过量。此外,实验还证明了选用Ba(OH)2溶液代替BaCl2和NaOH溶液同时除去粗盐中的Mg2+和SO2-4并不合理,解决了学生对此问题的存疑。
关键词: 粗盐提纯; 实验探究; 教育装备与教学融合
文章编号: 1005 6629(2022)08 0077 04
中图分类号: G633.8
文献标识码: B
随着新课程、新教材(“双新”)的推进,越来越多的数字化实验仪器开始走进中学化学课堂。如何借助数字化实验仪器解决教与学中遇到的问题,更好地服务于化学实验教学的开展?如何有效促进现代教育装备与中学化学实验教学的有机融合,改变教与学的方式,创新和改进化学实验教学?本文以粗盐提纯实验的再探究为例,对现代教育装备与中学化学实验教学的创新融合进行初步探索,以期为中学化学教师和教育装备工作者提供参考。
1 问题的提出
用化学沉淀法去除粗盐中的可溶性杂质离子是高中化学“常见的无机物及其应用”主题下的一个重要实验,也是《普通高中化學课程标准(2017年版2020年修订)》中规定的必修课程学生必做实验之一[1]。该实验不仅能培养学生构建利用离子反应除去杂质的一般思路和方法,也能够让学生认识到化学方法在物质分离和提纯中的重要作用。苏教版[2]、沪教版[3]和鲁科版[4]化学新教材对粗盐提纯实验虽编排位置有所不同, 但都一致采用了留白的设计来安排探究活动,对于除杂试剂的选择、用量、添加顺序和如何检验杂质是否已经除尽等内容均是以问题的形式留给学生思考。人教版教材[5]则同样以问题驱动的形式要求学生思考和讨论试剂添加顺序和略微过量的原因,并提供了详细的实验方案,在实验步骤中明确给出了除杂试剂的添加顺序和用量以及判断可溶性杂质离子沉淀完全的方法——向静置后的上层清液中继续滴加某种除杂试剂,若不出现浑浊,则认为粗盐中该可溶性杂质离子已沉淀完全。在实际操作中,学生确实是通过肉眼观察溶液中是否不再出现浑浊来判断沉淀完全与否。但是通过肉眼判断的结果是否准确?又会存在怎样的误差?此外,常有学生提出选用 Ba(OH)2溶液代替BaCl2 和NaOH溶液同时除去粗盐中的可溶性杂质Mg2+和SO2-4,这样的试剂选择又是否合理?能否通过直观的实验数据与图像来支撑说明?带着这些问题,笔者查阅了粗盐提纯实验的相关文献, 未见有通过实验得出具体数据以探究上述问题的研究报道。基于此,笔者借助钙离子传感器、导电率传感器和滴数传感器等仪器,对中学粗盐提纯的教学实验进行了再探究。
2 实验设计与探究
2.1 实验仪器
实验采用Vernier GD系列无线钙离子传感器(量程1~40000mg/L)、无线导电率传感器(量程0~20000μS/cm)对溶液中钙离子浓度、溶液导电率进行测定, 并结合Vernier无线滴数传感器和恒温磁力搅拌站使用。实验中将无线钙离子传感器、无线导电率传感器通过无线滴数传感器上的孔径固定放置,从而尽可能避免因手持而造成测量数据的误差。 另外,考虑到传感器工作时测量点对溶液液面高度有一定的要求,实验中采用定制的100mL玻璃高型烧杯(全高 84mm,身外径47mm)、50mL玻璃高型烧杯(全高70.5mm,身外径36.5mm)。
2.2 实验探究及结果
2.2.1 学生肉眼观测到沉淀完全时Ca2+浓度的测定
学生参照人教版教材实验活动的步骤[6]进行了粗盐提纯实验探究活动。称取5g粗盐,放入50mL定制的玻璃高型烧杯中,加入20mL蒸馏水,放在恒温磁力搅拌器上搅拌,使粗盐全部溶解,得到粗盐水。然后依次进行如下操作: (1)向粗盐水中滴加少量0.1mol/L BaCl2溶液,静置后继续滴加直至肉眼观察到不再产生沉淀;(2)滴加少量20% NaOH溶液,静置后继续滴加直至肉眼观察到不再产生沉淀;(3)滴加少量饱和Na2CO3溶液,静置后继续滴加直至肉眼观察到不再产生沉淀;(4)静置后过滤,借助无线钙离子传感器测量滤液中Ca2+浓度。
按照上述操作,多组学生在室温10℃下测得沉淀完全时滤液中Ca2+浓度的数据却不尽相同(见表1),测得数值最低的一组其钙离子浓度仅为6.78mg·L-1,而测得数值最高的一组其钙离子浓度为100.52mg·L-1, 数值存在显著差异。考虑到碳酸钙在10℃下的溶度积以及盐效应因素的影响,溶液中的钙离子确实难以完全除尽,但各组学生测得的数据为何会存在如此大的差异?通过肉眼观察真的能够直接判断钙离子沉淀是否完全吗?笔者在学生实验的基础上又进行了如下实验探究。
2.2.2 不同浓度Ca2+滤液反滴验证沉淀是否完全的探究
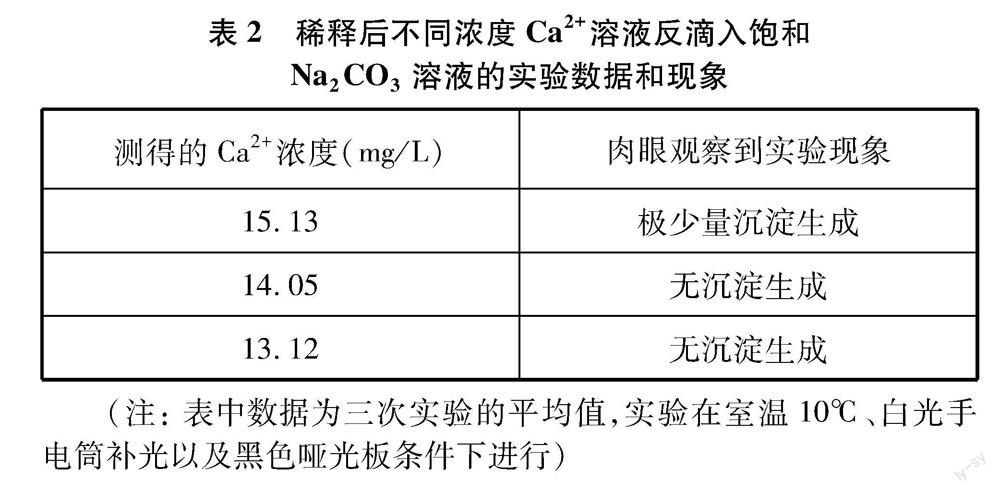
利用学生实验所得的滤液进行反滴验证,来进一步确定肉眼观察到沉淀完全时滤液中Ca2+的浓度。笔者取表1九组学生中测得数值居中的一组学生(钙离子浓度为16.03mg·L-1)实验所得的滤液2滴,滴入饱和Na2CO3溶液中,静置5分钟后,确实未观察到产生明显沉淀。那么这真的是肉眼可观测到沉淀的极限吗?
为了更清晰地观察是否产生沉淀,笔者继续取测得钙离子浓度数值为16.03mg·L-1一组同学实验所得的滤液2滴,滴入预先滴有2滴饱和Na2CO3溶液的黑色哑光板上,静置5分钟后,在白光手电筒进行补光的条件下再次观察是否产生沉淀。同时为保证实验准确度,避免偶然性,笔者在室温10℃下进行了三次平行实验。静置5分钟后,在白光手电筒进行补光以及黑色哑光板条件下均可以通过肉眼观察到有极少量沉淀生成。那么在此条件下肉眼观察到无沉淀产生时,滤液中的钙离子浓度最高会是多少?
在上述实验结果的基础上,配合无线钙离子传感器,笔者取少量钙离子浓度为16.03mg·L-1的滤液,向滤液中逐滴加入蒸馏水,将滤液分别稀释成钙离子浓度间隔约1mg·L-1不同浓度溶液,并各取2滴滴入预先滴有饱和Na2CO3溶液的黑色亚光板上,静置5分钟后,在白光手电筒进行补光的条件下通过肉眼观察是否产生沉淀,实验结果如表2所示。实验发现,当静置后在白光手电筒进行补光以及黑色哑光板条件下肉眼观察到无沉淀产生时,溶液中Ca2+浓度可能介于14mg·L-1和15mg·L-1左右,数值甚至高于表1中部分组学生实验后滤液中测得的Ca2+浓度数值,可见即使肉眼观察到无沉淀产生,也并不意味溶液中Ca2+已真正沉淀完全。学生通过肉眼直接观察溶液不出现浑浊来判断离子沉淀完全并不一定准确。当然,平时学生实验时一般很少 会采用白光手电筒进行补光以及黑色哑光板进行辅助观察沉淀,所以学生实验中观察到沉淀完全时所测得滤液中Ca2+浓度数值的差异更是在所难免。主要影响因素除了个体视觉感受不同,还可能受实验时光线强弱、温度、盐效应等因素的影 响。
2.2.3 除杂过程中溶液导电率的测定
如何帮助学生在实验中更好地判断沉淀完全,更加直观、准确地呈现除杂试剂是否过量?针对此问题,笔者借助导电率传感器进行了如下尝试。
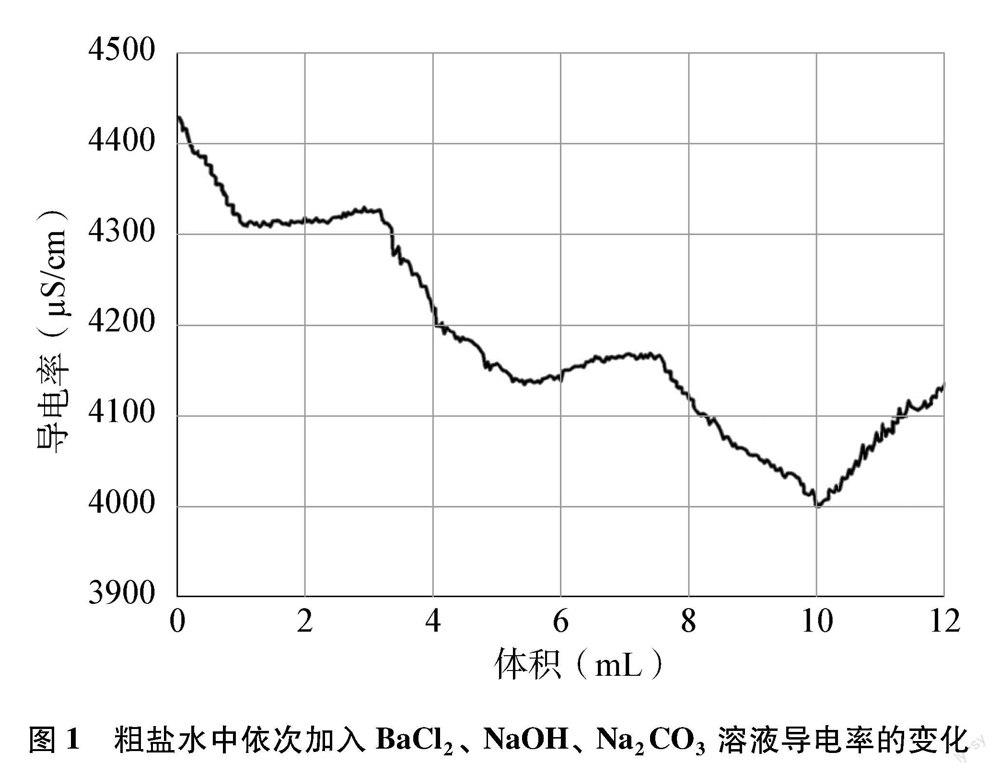
在粗盐提纯实验的除杂过程中,随着除杂试剂的加入,溶液中离子的浓度会出现变化, 通过测量除杂过程中溶液的导电率变化,在一定程度上能反映出溶液中离子浓度的变化。为了更清晰地呈现溶液导电率变化趋势,并结合导电率传感器的量程限制,先将前述实验中学生配制的粗盐水稀释80倍,测得导电率为 4420μS/cm。然后结合导电率传感器将BaCl2溶液、NaOH溶液和Na2CO3溶液导电率均调至约4420μS/cm。实验时将滴数传感器固定于磁力搅拌器上,导电率传感器放置于滴数传感器的孔径中。打开恒温磁力搅拌器,先通过无线滴数传感器向粗鹽水中逐滴加入BaCl2溶液,Ba2+与SO2-4反应生成沉淀,溶液导电率下降(见图1)。当BaCl2过量时,溶液导电率开始上升,图中出现拐点,过程中溶液导电率呈现先下降后上升的变化趋势,而图中出现的从下降到上升的拐点即表示恰好完全反应。 随后依次向粗盐水中逐滴加入NaOH溶液、Na2CO3溶液,均可明显观察到溶液导电率也呈现先下降后上升的变化趋势,而当图中出现从下降到上升的拐点即表示该除杂试剂恰好完全反应。借助于溶液的导电率变化,学生能更加直观、 准确地判断除杂试剂是否过量,这既能培养学生定性与定量相结合的思维,又能培养其“微观探析”“证据推理”“科学探究”等素养。
此外,考虑到碳酸钙的溶度积和盐效应等影响因素,粗盐水中的Ca2+确实很难通过CO2-3完全除尽(大学化学教材[7]中对溶液中某种离子已沉淀完全界定为在溶液中的离子浓度应≤1.00×10-5mol·L-1,即Ca2+ 沉淀完全的理论值为0.4mg·L-1),那是否还有其他办法可以尽可能除尽粗盐水中的Ca2+呢?在教学过程中,可以拓展介绍当前工业制盐过程中采用的磷酸结合碳酸钠除杂法[8]。根据相同温度下磷酸钙的溶度积远小于碳酸钙,易生成沉淀,尝试使用磷酸结合碳酸钠去除粗盐水中的Ca2+。当然,除了Ca2+,由于磷酸镁、磷酸钡的溶度积也远小于氢氧化镁、碳酸钡,PO3-4也能较好地除去粗盐水中的Mg2+和因除杂而引入的Ba2+。
2.2.4 Ba(OH)2溶液能否同时除去粗盐中Mg2+和SO2-4的实验探究
能否用Ba(OH)2溶液代替BaCl2和NaOH溶液同时除去粗盐中的Mg2+和SO2-4,这是学生在学习过程中常有的一个疑问。教学中教师一般会从理论计算的角度加以解释,并告诉学生粗盐中Mg2+的量一般高于SO2-4的量,使用Ba(OH)2溶液虽然能同时除去这两种离子,但是会出现除杂试剂使用过量等问题。那能否通过实验得出具体数据来加以佐证。笔者再次借助导电率传感器,测定了Ba(OH)2溶液代替BaCl2、 NaOH溶液加入粗盐水中溶液导电率的变化情况。
先将滴数传感器固定于磁力搅拌器上,导电率传感器放置于滴数传感器的孔径中。为了更清晰地呈现溶液导电率的变化趋势,并结合导电率传感器的量程限制,使用前述实验中已稀释80倍的粗盐水(导电率为 4420μS/cm),然后结合导电率传感器将Ba(OH)2 溶液导电率也调至约4420μS/cm。打开恒温磁力搅拌站,通过无线滴数传感器向粗盐水中逐滴滴加 Ba(OH)2溶液,Ba2+和SO2-4、OH-和Mg2+反应生成沉淀,溶液导电率逐渐下降(见图2)。当加入Ba(OH)2溶液体积约1.5mL时,导电率出现拐点,下降幅度趋于平缓,说明此时溶液中SO2-4已沉淀完全,Ba2+过量,但仍有Mg2+在继续和OH-反应。当Ba(OH)2溶液加至约2.4mL时,导电率再次出现拐点,开始逐渐上升,说明此时Mg2+已沉淀完全,溶液中Ba2+和OH-均已过量。直观的实验图像很好地说明了粗盐中Mg2+和SO2-4的物质的量并非1∶1的关系,故不宜选用Ba(OH)2同时除去粗盐中的Mg2+和SO2-4。该实验也可作为学生的实验探究活动应用于教学中,增强学生的“证据推理”“微观探析”等素养。
3 实验结论与思考
本研究借助数字化实验仪器,对粗盐提纯实验进行了再探究,得出了以下结论:
(1) 在室温10℃、白光手电筒补光以及黑色哑光板条件下肉眼观察到无沉淀产生时,通过对溶液中Ca2+浓度的测量,发现溶液中还存在低浓度的Ca2+,得出了学生通过肉眼直接观察溶液中是否出现浑浊来判断离子沉淀完全与否的方法并不一定准确。
(2) 借助对除杂过程中粗盐溶液导电率变化的测量,能帮助学生更加直观、准确地判断沉淀是否完全、除杂试剂是否过量。此外,通过溶液导电率变化的实验数据与图像还能更直观地证明选用Ba(OH)2溶液代替BaCl2和NaOH溶液同时除去粗盐中的可溶性杂质Mg2+和SO2-4并不合理,有效地解决了学生对此问题的存疑,也有益于学生“微观探析”“证据推理”“科学探究”等素养的形成与发展。
本研究除了充分挖掘粗盐提纯实验所蕴含的学科思维和素养价值外,也对现代教育装备与中学化学实验教学的融合进行了探索与实践。笔者期望有更多的中学化学教师和学生能借助现代教育装备解决实际教与学中遇到的真实问题,积极改变教与学的方式,让化学实验不流于形式。同时希望有更多的教育装备工作者能积极探索与研究现代教育装备与中学化学实验教学融合的创新模式,让教育装备能更好地服务于中学化学教学的开展。
参考文献:
[ 1 ] 中华人民共和国教育部制定.普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 5.
[ 2 ] 王祖浩主编. 普通高中教科书·化学·必修第一册[M]. 南京: 江苏凤凰教育出版社, 2020: 78~79.
[ 3 ] 麻生明, 陈寅主编. 普通高中教科书·化学·必修第一册[M]. 上海: 上海科学技术出版社, 2021: 43~44.
[ 4 ] 王磊主编. 普通高中教科书·化学·必修第一册[M]. 济南: 山东科学技术出版社, 2019: 58~59.
[ 5 ][ 6 ] 王晶, 毕华林主编. 普通高中教科书·化学·必修第二册[M]. 北京: 人民教育出版社, 2019: 29.
[ 7 ] 樊行雪, 方国女. 大学化学原理及应用(上册)[M]. 北京: 化学工业出版社, 2004: 177.
[ 8 ] 宋伟, 李永全, 宫正, 戚瑞松. 磷酸结合碳酸钠用作盐水精制剂[J]. 氯碱工业, 2016, 52(3): 5~7.
