烟曲霉Afssn3缺失菌株对伊曲康唑耐药的转录组学分析
2022-05-30王凯杰姜茹予陈家俊袁涵林
王 莎,王凯杰,姜茹予,陈家俊,袁涵林
(湖州师范学院 医学院,浙江 湖州 313000)
病原菌的耐药性一直是世界关注的热点.近年来,由于器官移植和外科介入性治疗的不断开展,以及广谱抗生素、抗肿瘤药物、肾上腺皮质激素、免疫抑制剂等的广泛应用甚至滥用,导致菌群失调,以致机体对真菌的抵抗力降低,在世界范围内侵袭性曲霉病(invasive aspergillosis,IA)感染的发生呈现出上升趋势,且病死率较高[1-2].目前,人们对人类病原真菌烟曲霉(Aspergillusfumigatus)的致病性和耐药机制等的研究还不够深入.当前,治疗深部曲霉感染临床应用的一线药物是三唑类抗真菌药物(trizoles),如伊曲康唑(itraconazole)、伏立康唑(Voriconazole)和泊沙康唑(posaconazole)[3-4].唑类药物通过与麦角固醇合成途径中的关键酶细胞色素P450羊毛甾醇14α-脱甲基酶(erg11A/cyp51A基因编码)结合,抑制麦角固醇的合成,并造成毒性固醇中间体的积累,从而抑制真菌的生长[5].但研究发现,越来越多的临床分离菌株对唑类药物会产生耐药性,其特点是除了对某种特定药物耐药外,还有较高比例的菌株出现多重耐药性(multidrugresistance)[6-7].
在烟曲霉分离鉴定的前期研究中,笔者得到了一个与三唑类药物耐受相关的基因Afssn3.作为RNA聚合酶II的转录辅因子,Afssn3定位在细胞核中,其可通过调节胞外多糖基质、鞘脂合成的中间代谢物和药物外排活力,实现对唑类药物的耐受性[8].据报道,酿酒酵母或白色念珠菌中的ssn3参与多种途径,如影响碳源利用、生物膜形成和耐药性[9-10].因此,在真菌中ssn3可通过影响RNA聚合酶II的结构,进而影响耐药,如目前众所周知的生物膜调控.本研究通过Afssn3缺失菌株在三唑类药物刺激下的转录组学分析,进一步发掘其在调控唑类药物耐受过程中可能的机制.
1 材料与方法
1.1 实验材料
烟曲霉野生菌株A1160来自FGSC(http://www.fgsc.net/);A1160c野生型对照菌株和Afssn3敲除菌株(ΔAfssn3)来自本实验室菌库.本研究使用的培养基为丰富培养基YAG(0.5%酵母膏、2%葡萄糖、0.1% 1000×微量元素、2%琼脂).
1.2 菌株的培养与处理
取A1160c和ΔAfssn3菌株各1×107个孢子于100 mL YAG液体培养基中,220 rpm、37 ℃培养 24 h,之后分别加入终浓度为1 μg/mL的伊曲康唑继续培养1 h;收取相应菌丝,用双蒸水洗涤3次,再在液氮中研磨;按照试剂盒的程序,使用TRIzol® Reagent试剂从样品中分离总RNA.利用Nanodrop 2000检测所提RNA的浓度和纯度,采用琼脂糖凝胶电泳检测RNA的完整性,利用Agilent 2100测定RIN值.
1.3 文库构建与上机测序
提取样品的总RNA,并使用DNase消化DNA,再用带有Oligo(dT)的磁珠富集真核生物mRNA;加入试剂将mRNA进行片段化处理,并以mRNA片段为模板,用六碱基随机引物合成一链cDNA,配制合成反应体系合成二链cDNA,然后连接不同接头,再进行消化,只保留连接链不同接头的cDNA一链;纯化cDNA一链后,再进行末端修复、加A尾并连接测序接头,最后进行PCR扩增;构建好的文库用Agilent 2100 Bioanalyzer质检,合格后使用Illumina HiSeqTM 2500或其他测序仪进行测序.
1.4 生物信息学分析
采用Illumina测序平台测得的原始测序数据(raw reads)进行质控,过滤低质量的测序片段(reads),去除3’端低质量碱基,切除含氮部分序列,最终得到干净的数据(clean reads),通过tophat/bowtie2将其比对到参考序列;比对完成后统计测序片段在参考序列上的分布情况和覆盖度,并进行基因表达、基因结构优化、可变剪接、新转录本发现,以及编码能力预测、SNP检测等一系列后续分析;从基因表达结果中筛选出样品间的差异表达基因,并基于差异表达基因进行聚类分析、基因本体(Gene Ontology,GO)功能显著性富集分析和通路(pathway)显著性富集分析.
2 结 果
2.1 烟曲霉Afssn3缺失后差异表达基因数量
本次转录组测序所产生的测序序列与参考基因组烟曲霉A1163(https://www.ncbi.nlm.nih.gov/genome/18?genome_assembly_id=22577)的数据相匹配度为90%以上,说明转录组数据的利用率很高,能用于后续分析.利用htseq软件(http://www-huber.embl.de/users/anders/HTSeq/doc/overview.html)获取每个样本比对到基因上的reads数,依据DESeq软件包(http://bioconductor.org/packages/release/bioc/html/DESeq.html)中的负二项分布检验,对reads数进行差异显著性检验,并采用basemean值估算基因表达量.
本文对烟曲霉Afssn3缺失菌株和野生型对照菌株分别用伊曲康唑进行处理,并应用二代测序技术对两组样本进行转录组学测序和分析,以野生型菌株为对照,寻找差异表达的信号通路和相应基因.结果显示,差异表达基因(P≤0.05)共有482个,其中上调差异基因344个,下调差异基因138个,上调差异基因多于下调差异基因.
2.2 Gene Ontology富集分析
在得到差异表达基因后,对差异表达基因进行GO富集分析,并对其功能进行描述.基于GO富集分析(图1)发现:由伊曲康唑刺激引起上调的基因被富集到的生物过程包括固醇生物合成过程(sterol biosynthetic process)、细胞对铁离子缺乏的反应(cellular response to iron ion starvation)、非核糖体肽生物合成过程(nonribosomal peptide biosynthetic process)、次生代谢物生物合成过程(secondary metabolite biosynthetic process)、麦角固醇生物合成的过程(ergosterol biosynthetic process)等;由伊曲康唑刺激引起下调的基因被富集到的生物过程包括细胞钙离子稳态(cellular calcium ion homeostasis)、跨膜运输(transmembrane transport)、转录(transcription,DNA-templated).由此可知,在伊曲康唑刺激下,ΔAfssn3菌株中固醇合成通路的激活是最显著的.
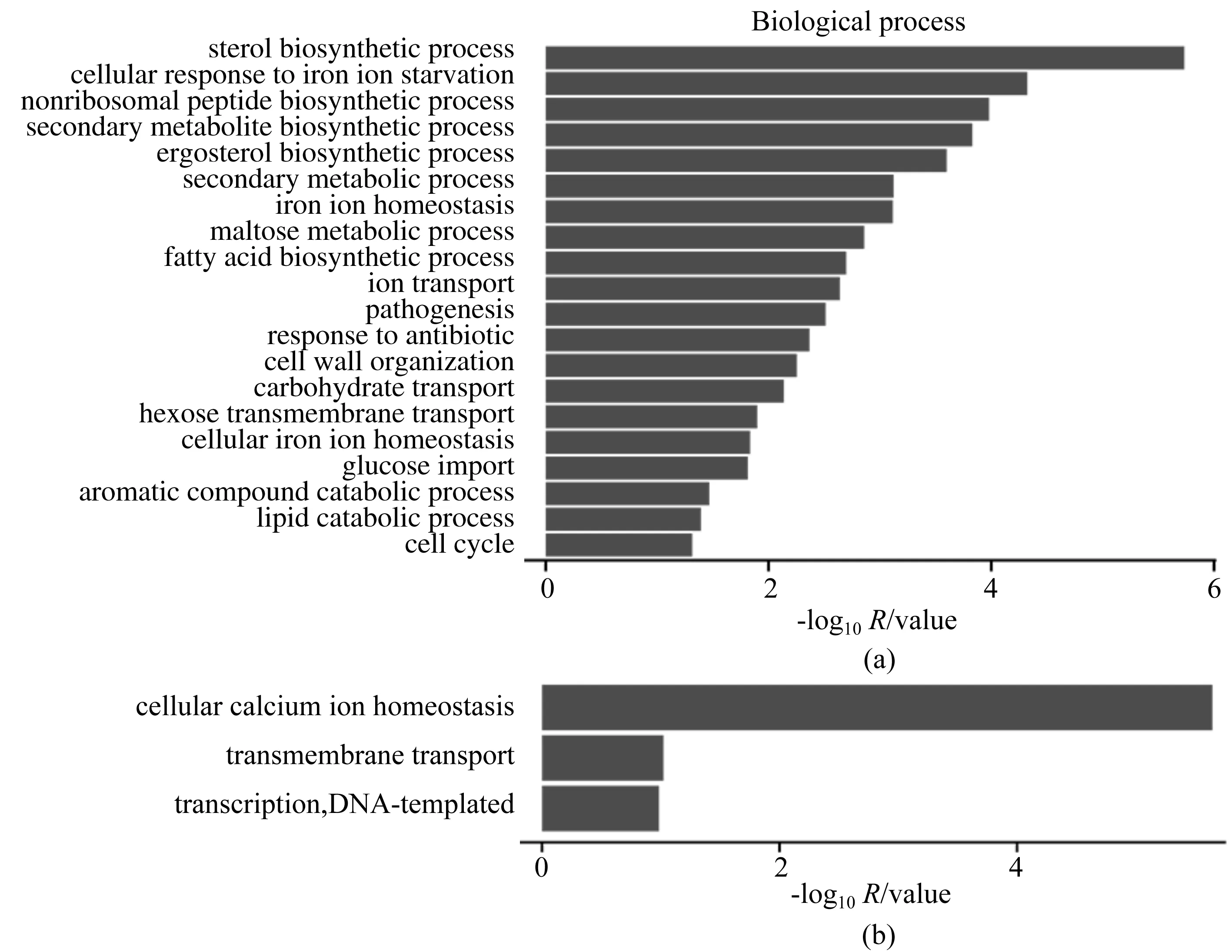
注:(a)为基因转录上调的生物过程,(b)为基因转录下调的生物过程; 横坐标为每个条目对应的-log10P value,纵坐标为GO条目名称. 图1 Gene Ontology富集分析条形图Fig.1 Bar chart of Gene Ontology enrichment analysis
2.3 KEGG富集分析
通过KEGG(Kyoto Encyclopedia of Genes and Genomes,https://www.kegg.jp/)富集分析发现(图2),类固醇生物合成(Steroid biosynthesis)、氨基苯甲酸酯降解(Aminobenzoate degradation)、氨基糖和核苷酸糖的代谢(Amino sugar and nucleotide sugar metabolism)、色氨酸代谢(Tryptophan metabolism)、精氨酸和脯氨酸代谢(Arginine and proline metabolism)、甘氨酸、丝氨酸和苏氨酸代谢(Glycine,serine and threonine metabolism)、淀粉和蔗糖代谢(Starch and sucrose metabolism)等通路中的基因表达显著上升,其中类固醇生物合成(Steroid biosynthesis)通路中的基因表达仍是上升最明显的.
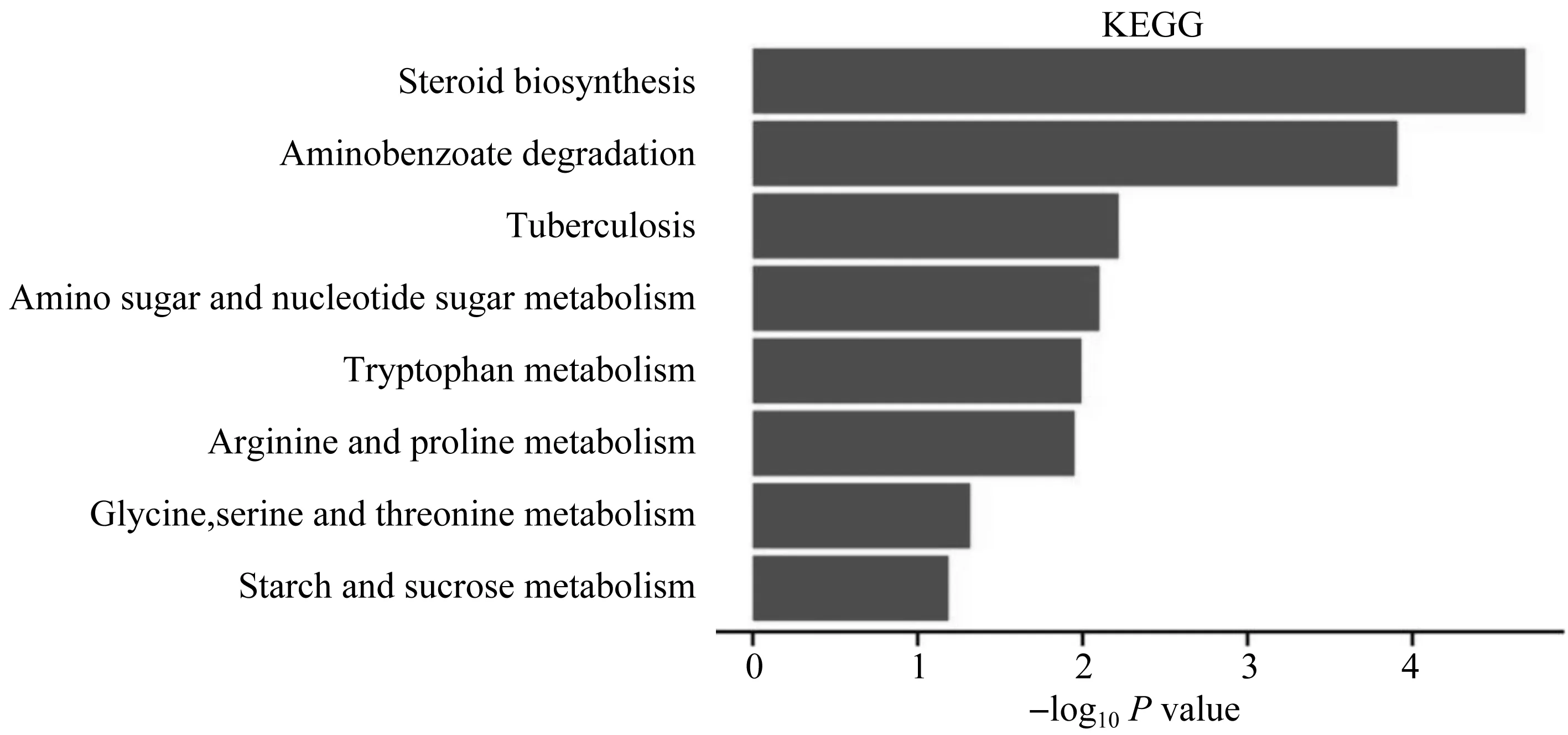
注:横坐标为每个条目对应的-log10P value,纵坐标为KEGG通路条目名称. 图2 KEGG富集分析中上调的通路Fig.2 Up-regulated pathways in KEGG enrichment analysis
2.4 类固醇生物合成通路相关基因的差异表达
根据上述KEGG富集分析中上调的通路,找到类固醇生物合成通路的相关基因,并将其富集到通路图(图3)中,其中表达上调的基因包括cyp51/erg11(1.14.13.70/Cyp51G1)、tm7sf2/erg24b(1.3.1.70/FK)、meso1/erg25(1.14.13.72)、smt1/erg6、sc5dl/erg3(1.14.19.20/STE1),其分别上调2.79倍、2.37倍、3.26倍、3.30倍、2.43倍;表达下调的基因有soat(2.3.1.26),其下调2.47倍.
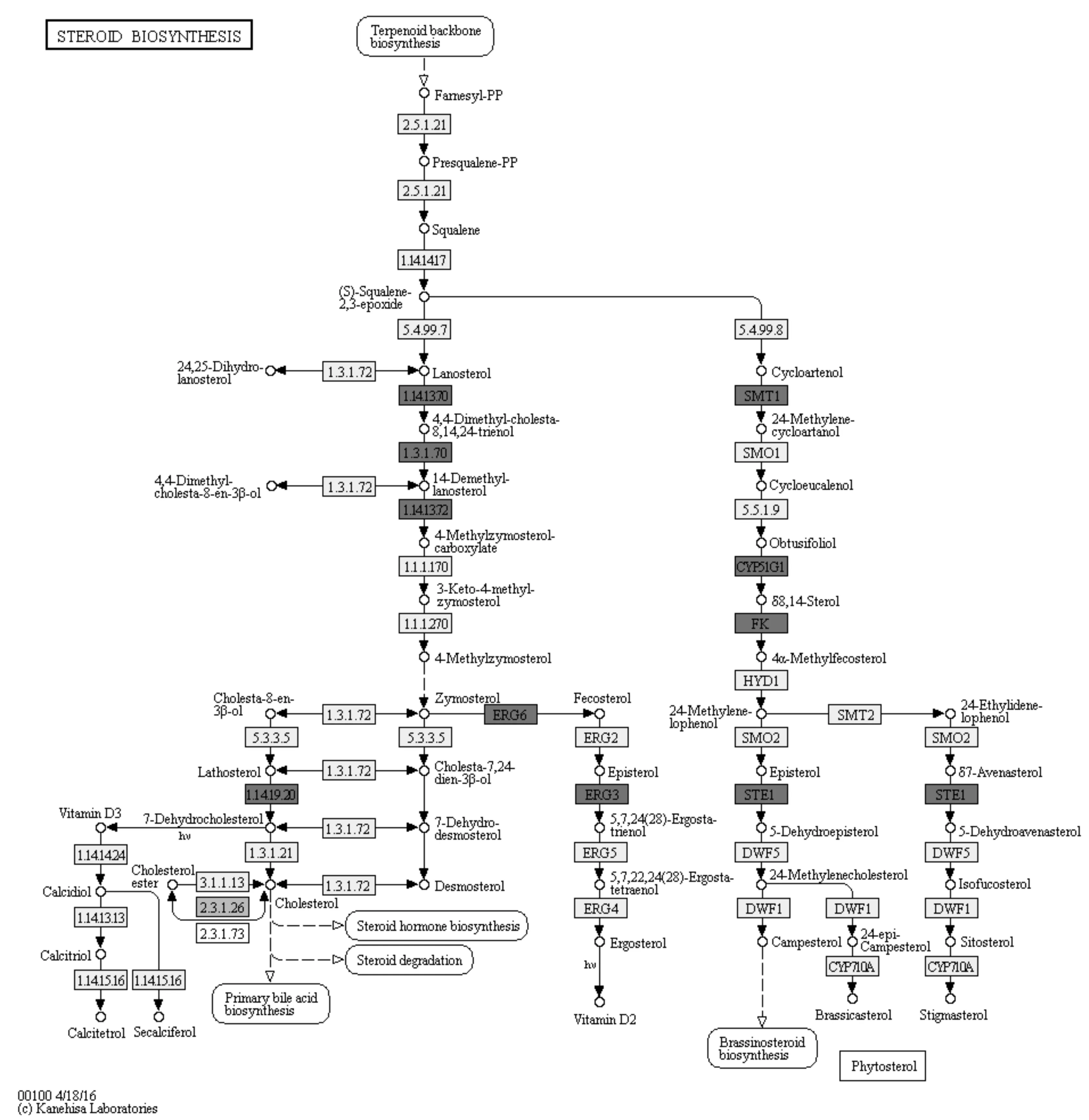
注:有深色/浅色框的基因属于差异表达基因,其中有深灰色框的基因(如ERG6)为上调基因, 有浅灰色框的基因(如2.3.1.26)为下调基因. 图3 类固醇生物合成通路中上下调基因富集分析通路图Fig.3 Diagram of enrichment analysis pathways for up and down-regulation genes in steroid biosynthesis pathway
3 讨 论
目前,烟曲霉对三唑类药物的耐药机制大部分集中在3个方面[11]:一是改变药物主要靶标,如细胞膜麦角固醇合成途径中的细胞色素P450酶系的羊毛甾醇14α-去甲基酶Erg11A/Cyp51A亚基,从而导致唑类药物的脱靶耐药,或通过Erg11/Cyp51全酶A和B两亚基基因启动子区域的各种突变,引起该基因表达量上调,导致药靶过量表达而产生耐药.二是增加真菌外排泵的表达和提高外排泵的活力.药物外排泵有ABC转运蛋白(ATP-bindingcassette transporter,ABCT)和主要易化子超家族(major facilitator superfamily,MFS)两类,目前认为属于ABC超家族的药物外排泵(drug efflux pumps)的高表达是引起真菌耐药的最主要途径.三是生物膜耐药.真菌生物膜的形成机制较复杂,同细菌生物膜一样,能够阻止抗真菌药物向细胞内渗透,从而导致药物耐受.
4 结 语
本研究主要通过分析经伊曲康唑处理后Afssn3基因缺失菌株的差异表达基因和相关通路的改变,探究烟曲霉Afsnn3基因缺失后的耐药机制.转录组测序结果显示,Afssn3缺失菌株主要有两大类基因的改变:膜整合蛋白和细胞外蛋白基因,如葡萄糖转运体、氨基酸转运体、药物外排泵和各种细胞外蛋白;代谢相关基因,如水解酶激酶、糖酵解相关酶等各种代谢酶.通过GO和KEGG富集分析发现,ergosterol biosynthetic process(麦角甾醇生物合成过程)明显上调,其中cyp51A(erg11A)、erg24B、meso1(erg25)、smt1(erg6)、sc5dl(erg3)表现为上调,这些都是参与类固醇生物合成通路的特异性基因.本文还分析了其他诸如外排泵、热休克蛋白、钙信号通路等耐药机制的相关基因[7,12],其中只有外排泵ABC转运蛋白相关的mdr4基因上调2.61倍.由此推测,Afssn3缺失后的耐药机制可能是通过上调cyp51A药靶基因的表达量增加药靶的含量,从而产生耐药性,还可能是通过上调外排泵的活性导致耐药.本文的研究结果为烟曲霉耐药分子调控机制的研究提供了新的线索和依据.
