人参皂苷F2通过PI3K/Akt途径改善3T3-L1脂肪细胞胰岛素抵抗
2022-05-30韩胜强谢元李甫胡烨烨周静胡卫成张迹
韩胜强,谢元,李甫,胡烨烨,周静,胡卫成,张迹*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)(2.淮阴师范学院江苏省高校区域现代农业与环境保护协同创新中心,江苏淮安 223300)(3.中国科学院成都生物研究所,四川成都 610041)
Ⅱ型糖尿病(Type 2 diabetes mellitus,T2DM)是世界上最常见的慢性疾病之一,主要表现为外周组织的高血糖和胰岛素抵抗(Insulin resistance,IR),在世界范围内引起很高的患病率和死亡率[1,2]。当胰岛素敏感性组织(例如肝脏、脂肪和骨骼肌)由于胰岛素信号传导途径受损而对胰岛素的敏感性降低时,就会发生IR。最终会导致β细胞的损伤和凋亡,血糖水平持续升高[3,4]。肥胖是与胰岛素抵抗相关的糖尿病的触发因素,通过刺激IR加剧T2DM的发展[5]。肥胖是脂肪组织中脂肪细胞分化积聚大量脂肪的状态[6],会加速脂肪组织的老化,而脂肪细胞在维持全身葡萄糖稳态中占据重要地位,同时在IR和T2DM中也起重要作用[7,8]。葡萄糖转运蛋白将血液中葡萄糖转运到脂肪细胞中,促进脂肪的合成,同时抑制脂肪分解,使游离脂肪酸进入血液,通过血液循环供其他器官直接利用。当脂肪组织发生IR时,游离脂肪酸被大量释放到血液中,引起血脂异常,加剧IR和T2DM。其中,胰岛素信号通路受损是脂肪细胞产生IR的主要原因之一[9,10]。因此,建立体外胰岛素抵抗模型有助于筛选改善胰岛素抵抗的药物或天然产物。
人参(Panax ginsengC.A. Meyer)是一种多年生的草本植物,具有抗疲劳、延缓衰老以及保护心血管等功效[11]。在现代临床试验中证实了人参及提取物能够降低糖尿病患者的血糖,并改善葡萄糖耐受量[12]。人参的主要活性成分为人参皂苷,研究表明原人参二醇类的Rb1、Rg3、Rc、Rb2和原人参三醇类的Re、Rg1具有增加胰岛素敏感性和降糖作用[13],而且Rb1、Rg3、Rh1对脂肪细胞的影响均有相关研究[14,15]。
人参皂苷F2(Ginsenoside F2,GF2)在人参中含量较少,主要是通过Rb1、Rg3、Rc、Rb2等原人参二醇类皂苷经过生物转化[16]后得到的产物[17],被证明具有抗氧化[18]、抗炎[19]、抗癌[20]、降脂[21]等生物活性,但其对脂肪细胞葡萄糖摄取和降血糖的作用机制尚不明确。本研究通过3T3-L1脂肪细胞建立胰岛素抵抗模型,研究了GF2对糖吸收的影响,并进一步探讨GF2通过PI3K/Akt通路改善胰岛素抵抗的机制。
1 材料与方法
1.1 材料
1.1.1 试剂
小鼠3T3-L1前脂肪细胞,武汉大学中国典型培养物保藏中心;GF2(纯度>98%),四川成都至纯本草生物科技有限公司。
磷酸盐缓冲液片剂(PBS,pH=7.4),美国Amersco公司;DMEM培养基、胎牛血清(FBS)、青-链霉素双抗混合液,加拿大Gibco公司;罗格列酮(RGZ)、二甲亚砜(DMSO)、Trizol Reagent,美国Sigma-Aldrich公司;3-(4,5-二甲基-2-噻唑)-2,5-二苯基-2-四氮唑溴盐(MTT),德国Biofroxx公司;BCA蛋白定量试剂盒,中国上海爱必信生物科技有限公司;2-(N-(7-硝基苯-2-氧-1,3-二唑-4-基)氨基)-2-脱氧葡萄糖(2-NBDG)、RevertAid First Strand cDNA Synthesis Kit,美国Thermo Fisher Scientific公司;Phospho-Akt抗体(#4060S)、Akt抗体(#9272S)、Phospho-PI3K抗体(#4228S),美国Cell Signaling Technology公司;anti-rabbit IgG抗体(#ab6721)、anti-mouse IgG抗体(#ab6789),美国abcam公司。
1.1.2 主要仪器设备
5414R低温高速离心机,德国Eppendorf公司;HERACELL 150i CO2培养箱,美国Thermo Fisher公司;IX71倒置显微镜,日本Olympus公司;DM6B荧光显微镜,瑞士Leica公司;HH-8数显恒温水浴锅,江苏金坛市亿通电子有限公司;Infinite M200 Pro酶标仪,瑞士Tecan公司;T100 Thermal Cycle PCR仪,美国Bio-Rad公司;CPX connect实时荧光定量PCR仪,美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养与分化
3T3-L1前脂肪细胞在37 ℃、5% CO2条件下用DMEM培养基(含有10% FBS和1%青-链霉素)培养,细胞融合90%后,用含0.5 μmol/L 3-异丁基-1-甲基黄嘌呤(IBMX)、1 μmol/L地塞米松(DEX)和10 μg/mL胰岛素的DMEM培养基诱导分化。2 d后,将分化培养基更换为含有10 μg/mL胰岛素的DMEM培养基继续维持培养,每2 d更换一次培养基,持续4~6 d。
1.2.2 油红O染色
3T3-L1前脂肪细胞以2×104cells/mL的密度接种于24孔板(500 μL/孔),按照1.2.1方法诱导分化后,3T3-L1细胞用PBS洗涤,并用4%多聚甲醛室温固定30 min。去除固定液后,加入油红O染液,置于60 ℃烘箱避光染色15 min,最后水洗2次晾干,于IX71倒置显微镜下观察拍照。
1.2.3 细胞活力的测定
3T3-L1前脂肪细胞以1×104cells/mL的密度接种在96孔板中,过夜培养后吸弃培养基。以添加12.5、25、50、100 μmol/L GF2的DMEM培养基处理细胞,同时设不含GF2为正常组;在37 ℃,5% CO2条件下处理24 h,弃去上清液,每孔加入100 μL用无血清DMEM配制的0.5 mg/mL MTT溶液,孵育4 h后,结束后每孔加入100 μL MTT终止液,继续培养16~20 h,酶标仪在550 nm处测定各孔的吸光值。
1.2.4 胰岛素抵抗模型的建立
参照Meng[22]和PARK等[23]的方法,略有改进:将分化成熟的3T3-L1脂肪细胞以1×104cells/mL的密度接种于96孔透明底黑板中(100 μL/孔),在37 ℃,5% CO2条件下孵育,待细胞融合80%左右,将细胞分为对照组和模型组,对照组用DMEM处理,模型组用含有1 μmol/L DEX的DMEM处理,48 h后然后将培养基换成含有100 μmol/L 2-(N-(7-硝基苯-2-氧-1,3-二唑-4-基)氨基)-2-脱氧葡萄糖(2-NBDG)的PBS在37 ℃下处理30 min,结束后弃上清液,用预冷的PBS漂洗2次,酶标仪在485/535 nm下测定各组细胞的荧光强度。
1.2.5 胰岛素抵抗3T3-L1脂肪细胞的糖摄取
按照1.2.4方法处建立胰岛素抵抗模型后,实验分组及给药:正常组和模型组:DMEM培养基;阳性药物组:含10 μmol/L罗格列酮(RGZ)的DMEM培养基;药物组:含25 μmol/L GF2的DMEM培养基、含50 μmol/L GF2的DMEM培养基、含100 μmol/L GF2的DMEM培养基;置于37 ℃细胞培养箱共同孵育12 h后,弃掉培养基,加入含有100 μmol/L 2-NBDG的PBS在37 ℃下处理30 min,结束后弃上清液,用预冷的PBS漂洗2次,用酶标仪在485/535 nm下测定各组细胞的荧光强度。
1.2.6 RT-qPCR检测IRS-1和GLUT-4 mRNA相对表达量
3T3-L1脂肪细胞以5×104cells/mL的密度接种于6孔板中,按照1.2.5方法分组处理后,去除培养液,用预冷的PBS轻轻漂洗一遍后,每孔加入1 mL Trizol裂解液吹打细胞至溶液清亮,收集于1.5 mL离心管中。利用Trizol法提取细胞总RNA,然后反转录合成cDNA。根据NCBI数据库上的基因序列设计IRS-1和GLUT-4基因上下游引物序列,GAPDH作为内参,引物序列见表1。按照FastStart Universal SYBR Green Master(Rox)试剂盒说明进行RT-qPCR,每组实验重复3次,最后采用2-ΔΔCt法计算基因相对表达量。
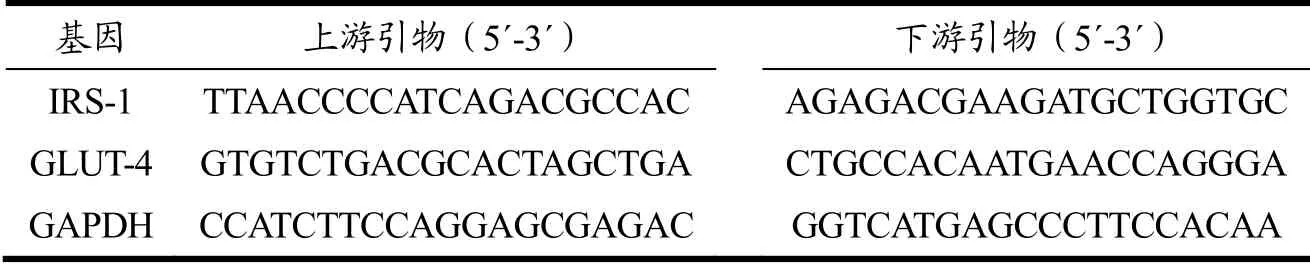
表1 RT-qPCR所用引物序列Table 1 Primers used in RT-qPCR
1.2.7 Western blot检测PI3K/Akt信号通路相关蛋白
在不同组的脂肪细胞中加入含磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液,之后将样品离心(4 ℃,12000 r/min,15 min)并收集上清液。用BCA试剂盒检测蛋白浓度。取30 μg蛋白样品进行SDS-PAGE凝胶电泳,转移到PVDF膜上后用5% BSA或5%脱脂奶粉室温封闭2 h,然后与各种一抗在4 ℃孵育过夜。TTBS洗涤3次后加入二抗,室温摇床2 h后,加入eECL发光液反应,曝光后拍照分析。
1.3 统计分析
各组数据以平均值±标准差表示,用SPSS 23.0统计软件进行分析,采用单因素方差分析比较组间差异,以p<0.05以为差异具有统计学意义。使用Sigma Plot 10.0软件作图。
2 结果与讨论
2.1 细胞分化和油红O染色
脂肪细胞在T2DM中起着重要作用,它既是脂肪组织的主要成分,也是胰岛素抵抗的主要部位。前脂肪细胞具有增殖和分化能力,建立的体外胰岛素抵抗模型常用于筛选胰岛素增敏剂药物作用的评价和研究以及相应的糖脂代谢作用[24]。3T3-L1前脂肪细胞在形态上呈典型的纺锤体型,体积小,细胞质中没有脂肪滴(图2a)。在分化的第10 d,细胞变大变圆,而且细胞内出现大量脂肪滴,分化成为成熟的脂肪细胞;细胞用油红O染色,脂滴被染为红色,形成环状(图2b)。
2.2 GF2对3T3-L1前脂肪细胞活力的影响
采用MTT法检测了GF2对3T3-L1前脂肪细胞活力的影响。由图3可知,GF2浓度从12.5到100 μmol/L时,对3T3-L1前脂肪细胞的活力无影响。结果表明在此浓度范围内GF2对3T3-L1脂肪细胞无显著毒性。
2.3 胰岛素抵抗模型的建立
胰岛素抵抗是T2DM的主要因素,其主要特征是对胰岛素信号的响应减弱,使目标组织中葡萄糖的摄取或利用降低[25]。多项研究表明,DEX是一种糖皮质激素类似物[26],能抑制IRS-1和GLUT-4的表达[27],从而抑制脂肪组织、肌肉组织和肝组织对葡萄糖的摄取,进一步导致糖尿病症状加重。用DEX诱导48 h建立胰岛素抵抗模型,并利用2-NBDG荧光探针检测细胞的糖摄取,平均荧光强度反映了细胞对葡萄糖的摄取量。由图4可知,1 μmol/L DEX处理48 h后,DEX诱导的模型组2-NBDG平均荧光强度显著低于正常组(p<0.05),降低了34.17%,表明细胞对葡萄糖的摄取能力受到抑制,胰岛素抵抗模型建立成功。谢洁等[28]的研究发现,1 μmol/L DEX作用24 h和48 h均能诱导3T3-L1脂肪细胞胰岛素抵抗,同时指出该模型在48 h内稳定。王丽静等[29]的研究表明,100 nmol/L和1 μmol/L DEX诱导48 h后不但降低了3T3-L1脂肪细胞基础状态下的糖吸收,还抑制了胰岛素刺激下葡萄糖的吸收,产生胰岛素抵抗症状。
2.4 GF2对胰岛素抵抗3T3-L1脂肪细胞糖摄取的影响
不同浓度GF2(25、50、100 μmol/L)对胰岛素抵抗3T3-L1脂肪细胞糖摄取的影响如图5所示,GF2和罗格列酮(10 μmol/L)处理12 h后,均显著增加细胞对2-NBDG摄取(p<0.05);与模型组相比,阳性对照组的平均荧光强度增加了43.82%(p<0.01);25、50和100 μmol/L GF2荧光强度分别增加了12.58%、29.07%和34.62%(p<0.05),且GF2浓度越高,2-NBDG荧光强度越强,GF2呈现出剂量依赖性促进细胞对2-NBDG的摄取。
2.5 GF2对葡萄糖转运蛋白表达的影响
不同组织细胞对葡萄糖的吸收主要依赖于GLUTs。在脂肪细胞中,葡萄糖摄取可以由GLUT-4介导[30]。由图6可知,模型组中GLUT-4 mRNA相对表达量极显著降低(p<0.01);50和100 μmol/L GF2可显著增加GLUT-4 mRNA相对表达(p<0.01),分别高于模型组1.58倍和2.94倍;而25 μmol/L GF2处理12 h对GULT-4 mRNA表达无显著差异。Meng等[22]从体内和体外说明了来自桑叶中的黄酮类化合物可以显著增加3T3-L1脂肪细胞胰岛素抵抗模型中的GLUT-4表达,并降低游离脂肪酸的表达,从而改善胰岛素抵抗模型中的代谢异常。Dwiyati等[31]研究发现姜黄通过增加GLUT-4表达和下调PPAR-γ表达改善3T3-L1脂肪细胞葡萄糖摄取,从而表现出降糖活性。
2.6 GF2对IRS-1/PI3K/Akt信号通路的影响
GF2促进了GLUT-4 mRNA相对表达量,增加了胰岛素抵抗3T3-L1脂肪细胞对葡萄糖的吸收。GLUT-4对葡萄糖的摄取可以通过PI3K和AMPK两种途径激活[32,33],同时两种途径也可以激活PI3K/Akt信号通路和非典型蛋白激酶途径。这两种途径均可促进细胞对葡萄糖吸收[34]。研究表明人参皂苷Rg1可激活AMPK和PI3K/Akt途径,并诱导Akt在丝氨酸473位点磷酸化,促进GLUT-4表达,增加3T3-L1脂肪细胞对葡萄糖的摄取[35];Rb1激活胰岛素信号通路中的Akt蛋白,上调脂肪组织中GLUT-1和GLUT-4促进葡萄糖的摄取和消耗,改善IR和糖代谢异常[13];Rg3和Re通过IRS-1/PI3K途径上调脂肪细胞中GLUT-4促进细胞对葡萄糖的摄取[14]。Rg1、Rb1、Rg3、Re等作为GF2的前体皂苷[16],通过不同的作用机制促进脂肪细胞对葡萄糖的摄取,从而改善IR,因此我们推测GF2也具有降糖作用。另外有报道称在糖尿病患者中IRS-1表达降低[36],因此,为了进一步研究GF2对葡萄糖摄取的作用机制,检测了PI3K/Akt信号通路的激活。
图7a显示的是GF2对胰岛素抵抗3T3-L1脂肪细胞IRS-1表达的影响。经DEX诱导后,模型组中IRS-1基因表达水平极显著低于正常组(p<0.01),GF2处理12 h后,增加了IRS-1基因的表达(p<0.05),随着GF2剂量的增加,IRS-1基因表达分别高于模型0.33倍、1.66倍和2.10倍。IRS-1包含酪氨酸磷酸化位点和丝氨酸/苏氨酸磷酸化位点,在未被激活的情况下,IRS-1上的丝氨酸处于磷酸化状态,而在被胰岛素激活后,酪氨酸磷酸化增强[37]。当IRS-1酪氨酸磷酸化后,PI3K和Akt被活化,胰岛素信号通路被激活,活化的Akt可促进葡萄糖转运蛋白向膜易位,从而增加对葡萄糖代谢[38]。
图7b为各组p-PI3K、PI3K、p-Akt和Akt蛋白表达水平,其中RI为各组蛋白灰度与对应β-actin的比值。模型组中,DEX抑制了p-PI3K、p-Akt和Akt的表达(p<0.05);GF2处理12 h后,增加了胰岛素抵抗细胞中PI3K和Akt的磷酸化,同时也促进了Akt的表达(p<0.05)。Akt磷酸化后可进一步诱导GLUT-4易位至质膜并促进葡萄糖吸收进入细胞[39],从而降低高血糖[40]。结果表明,GF2可增加胰岛素抵抗3T3-L1脂肪细胞中的IRS-1mRNA的表达以及增强PI3K/Akt磷酸化,激活PI3K/Akt信号通路。Jang等[41]研究表明东莨菪碱通过激活PI3K/Akt和AMPK信号通路增加胰岛素抵抗3T3-L1脂肪细胞的葡萄糖摄取。
3 结论
人参皂苷F2通过增加胰岛素抵抗3T3-L1脂肪细胞GLUT-4 mRNA的表达水平,促进细胞对葡萄糖的摄取;同时提高IRS-1 mRNA和Akt的表达水平,并增加PI3K和Akt的磷酸化,激活PI3K/Akt信号通路,改善胰岛素抵抗。本研究结果初步表明人参皂苷F2具有调节糖脂代谢作用,为开发预防糖尿病相关保健产品提供理论支撑。
