慢性镉暴露小鼠肝、肾、脑组织镉分布情况和肾毒性研究
2022-05-30陈梦妍梁译丹皮会丰
罗 燕,邓 平,陈梦妍,谢 佳,田 丽,梁译丹,皮会丰
(陆军军医大学军事预防医学系军队劳动卫生学教研室/电磁辐射医学防护教育部重点实验室,重庆 400038)
镉(cadmium,Cd)是一种广泛存在于环境中的重金属污染物,半衰期很长,在人体中的生物半衰期为10~30年[1]。镉通过食物、空气、水等途径被人体摄入后会累积于肾、肝、骨骼等组织器官中,诱导肾、肝、神经元等多种器官和组织的损伤[2]。肾是镉暴露和毒性的主要靶器官,机体摄入的镉有近50%蓄积在肾[3],尤其是肾皮质和近端小管,从而导致肾出现不可逆的病理改变[4]。临床上,慢性镉中毒患者可出现糖尿或者蛋白尿,甚至发展成慢性肾疾病[5]。
电感耦合等离子体质谱仪(inductively coupled plasma mass spectrometry,ICP-MS)可用于化学元素的分析检测,尤其对金属元素的分析较为精确。Egger等[6]利用ICP-MS测定了4名人体器官捐献者的40个不同组织中的镉浓度,发现镉除了在肾、骨骼和肝中沉积外,在肌肉和脂肪组织中亦有分布。ICP-MS被认为是在组织学水平上阐明镉毒性的有力工具。
先前的研究发现,镉致肾毒性的主要机制有:活性氧堆积、线粒体应激、钙代谢紊乱、细胞凋亡等[7-9]。然而,镉在动物或人体组织、器官中的分布情况仍不清楚,且镉的肾毒性分子机制尚不十分明确。故本研究通过构建慢性镉暴露小鼠模型,监测小鼠体质量增长情况,利用ICP-MS检测小鼠肝、肾、脑组织中的镉含量,并进一步研究小鼠肾组织氧化应激指标和凋亡相关蛋白表达水平的变化,以期对慢性镉暴露小鼠的器官毒性进行初步探究。
1 材料与方法
1.1 实验材料及主要试剂
SPF级雄性C57BL/6J小鼠,45只,7周龄,由陆军军医大学实验动物中心提供[生产许可证号:SCXK(渝)20170002,使用许可证号:SYXK(渝)20170002];所有动物实验的开展均获得陆军军医大学实验动物伦理审查委员会批准(批准号:AMUWEC20224998)。
氯化镉(CdCl2)粉末(Sigma-Aldrich,美国);丙二醛(malondialdehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒(南京建成生物工程研究所,南京);兔抗小鼠cleaved Caspase-3抗体、兔抗小鼠Bax抗体(Affinity Biosciences,美国);小鼠抗小鼠Bcl-2抗体(Invitrogen,美国);小鼠抗小鼠β-actin抗体(CST,美国);RIPA裂解液、BCA蛋白浓度测定试剂盒(碧云天生物科技研究所,上海)。ICP-MS Nexion 2000P(铂金埃尔默企业管理有限公司,上海)。
1.2 构建慢性镉暴露小鼠模型
雄性C57BL/6J小鼠45只,在SPF级屏障环境中饲养,温度为25 ℃,自由饮水及进食12个月。小鼠被随机分为对照组、低浓度组和高浓度组,每组15只。对照组正常饮水,低浓度组用低浓度镉水(0.6 mg/L CdCl2)喂养,高浓度组用高浓度镉水(3.6 mg/L CdCl2)喂养。实验过程中对照组和高浓度组各死亡1只,故最终对照组和高浓度组入组数为14只。
1.3 监测小鼠体质量增长情况
测量并记录7周龄小鼠的体质量,作为初始体质量,以后每周测量1次小鼠体质量至小鼠20周龄。
1.4 ICP-MS检测小鼠肝、肾和脑组织镉含量
小鼠慢性镉暴露12个月后,以25%乌拉坦5 mL/kg腹腔麻醉,生理盐水心脏灌注至左心耳流出澄清液体,取肝、肾和脑组织(每个组织6~8个样本),于液氮罐中临时保存。取材完毕后所有组织标本放于-80 ℃冰箱保存。干冰运送至上海铂金埃尔默企业管理有限公司,采用ICP-MS检测肝、肾、脑组织中镉含量。
1.5 试剂盒检测肾组织MDA含量、SOD活力值和GSH-Px活力值
准确称取小鼠肾组织体质量,按体质量(mg)∶体积(μL)=1∶9的比例加入9倍体积的匀浆介质(0.9%生理盐水)。冰水浴条件下机械匀浆,制备成10%的匀浆液,3 000 r/min离心10 min,取上清液为待测样品。用标准品制作标准曲线,算出待测样品蛋白浓度(mg/mL)。
1.5.1 MDA含量测定 按照表1依次向空白管、标准管、对照管和测定管中加入试剂,混匀,试管口用保鲜膜扎紧并扎1个小孔,95 ℃沸水浴40 min。流水冷却,4 000 r/min离心10 min,于波长532 nm处测吸光度(optical density,OD)值。计算公式:MDA含量(nmol/mg)=(测定管OD值-对照管OD值)/(标准管OD值-空白管OD值)×标准品浓度(10 nmol/mL)/待测样品蛋白浓度(mg/mL)。

表1 MDA试剂盒操作表(mL)
1.5.2 SOD活力值测定 按照表2依次向对照管和测定管中加入试剂一、二、三、四,待测样品,蒸馏水,混匀,37 ℃恒温水浴40 min。随后加入显色剂,静置10 min后进行显色反应,于波长550 nm处测OD值。计算公式:SOD活力值(U·mg-1)=(对照管OD值-测定管OD值)/对照管OD值/50%×反应液总体积(3.31 mL)/取样量(0.01 mL)/待测样品蛋白浓度(mg/mL)。每1 mg肾组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U·mg-1)。

表2 SOD试剂盒操作表(mL)
1.5.3 GSH-Px活力值测定 按照表3向对照管和测定管中加入GSH标准液和待测样品,混匀,37 ℃水浴预温5 min。随后加入试剂一,混匀,37 ℃水浴酶促反应5 min。再加入试剂二和待测样品,4 000 r/min离心10 min。对照管和测定管各取上清液1 mL进行显色反应。按照表4向空白管、标准管、对照管和测定管中加入试剂进行显色反应,混匀,室温静置15 min,于波长412 nm处测OD值。计算公式:GSH-Px活力值(U·mg-1)=(对照管OD值-测定管OD值)/(标准管OD值-空白管OD值)×标准管浓度(20 μmol/L)×稀释倍数(5)/反应时间(5 min)/(取样量×待测样品蛋白浓度)。每1 mg蛋白每分钟扣除非酶促反应的作用使反应体系中GSH浓度降低1 μmol/L为1个酶活力单位(U·mg-1)。

表3 GSH-Px试剂盒酶促反应操作表(mL)
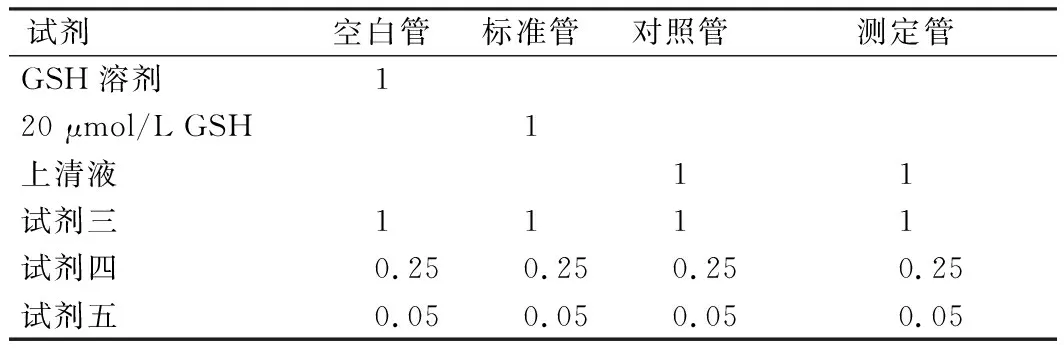
表4 GSH-Px试剂盒显色反应操作表(mL)
1.6 Western blot检测肾组织cleaved Caspase-3、Bcl-2/Bax蛋白相对表达量
准确称取小鼠肾组织质量,每100 mg肾组织中加入RIPA裂解液(含有蛋白酶抑制剂和磷酸酶抑制剂)0.1 mL,最大程度研磨后于冰上裂解25 min。随后20 000×g,4 ℃离心25 min,取上清液,标准蛋白法测定蛋白浓度。蛋白样品煮沸变性(99 ℃,15 min)后,-80 ℃分装保存。
12%预制胶,每孔20 μg上样。恒压80 V SDS电泳2 h。将胶上的蛋白转移至聚偏二氟乙烯(polyviny-lidene fluoride,PVDF)膜上,恒流250 mA电转1 h。加入快速封闭液室温封闭20 min。加入小鼠抗小鼠β-actin抗体(1∶1 000)、小鼠抗小鼠Bcl-2抗体(1∶500)、兔抗小鼠Bax抗体(1∶1 000)、兔抗小鼠cleaved Caspase-3抗体(1∶1 000),4 ℃摇床孵育过夜。TBST洗脱3次,每次10 min,加入相应的辣根过氧化物酶结合的山羊抗兔IgG或兔抗小鼠IgG(1∶5 000),室温摇床孵育1 h,TBST洗脱3次,每次10 min,加入ECL化学发光底物,在Image lab凝胶成像系统中曝光。采用Image lab软件分析条带灰度值,并计算目的蛋白与内参蛋白β-actin灰度比值。
1.7 统计学处理

2 结果
2.1 各组小鼠体质量情况
各组小鼠7周龄的初始体质量差异无统计学意义(P>0.05),各组小鼠7~20周龄的体质量增长情况差异无统计学意义(P>0.05),见表5。各组小鼠7~20周龄体质量增长曲线见图1。

表5 小鼠初始体质量和体质量增长情况(g)
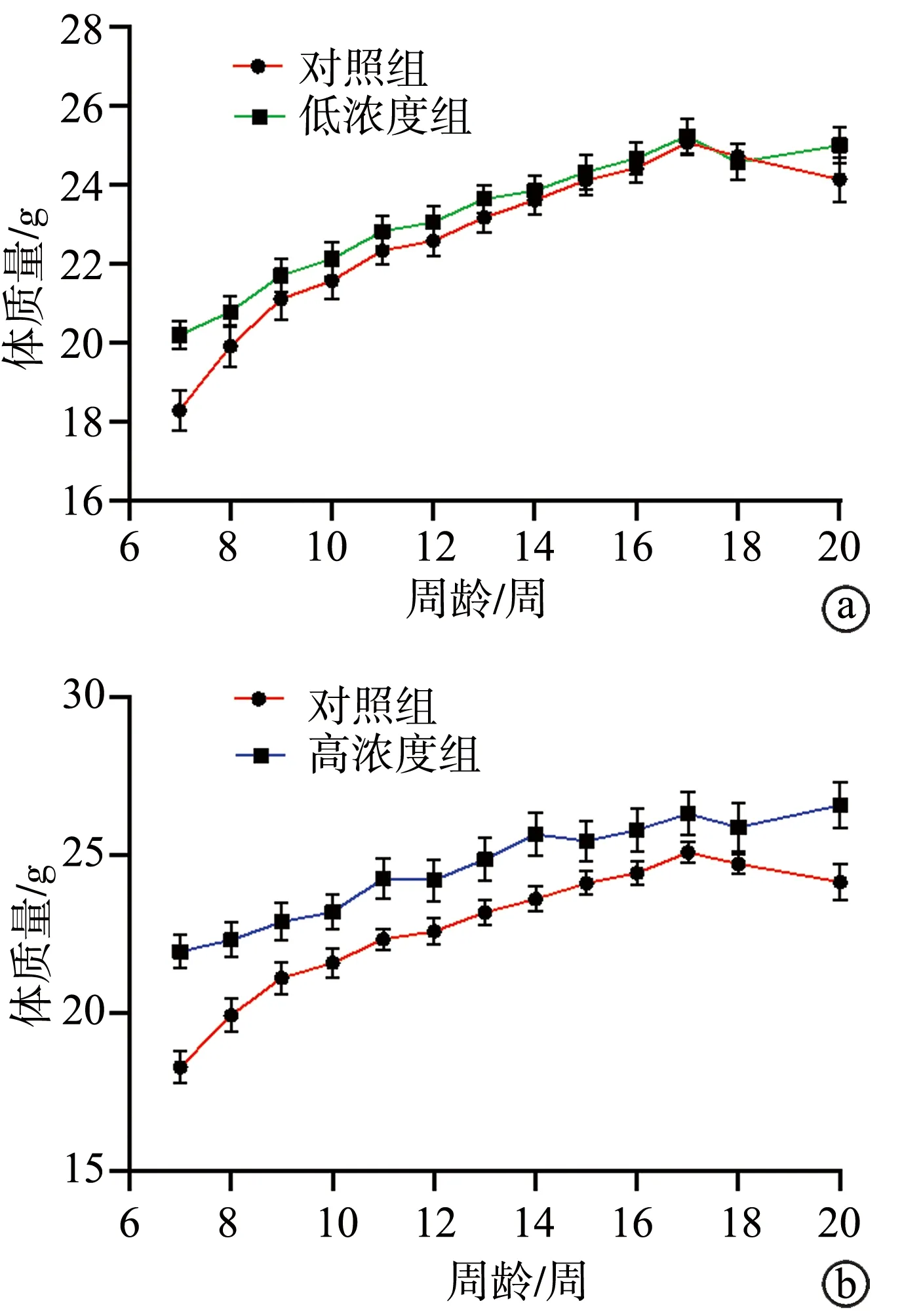
a:对照组和低浓度组小鼠体质量增长曲线;b:对照组和高浓度组小鼠体质量增长曲线
2.2 低浓度组和高浓度组小鼠肝、肾、脑组织镉含量及镉分布
慢性镉暴露12个月后,低浓度组和高浓度组小鼠肝、肾、脑组织中均检测到镉分布,且肾组织中镉含量最高,见表6、图2。

表6 低浓度组和高浓度组小鼠肝、肾、脑组织镉含量(μg/kg)

图2 低浓度组和高浓度组小鼠肝、肾、脑组织镉分布情况
2.3 各组小鼠肾组织MDA含量、SOD活力值和GSH-Px活力值
低浓度组MDA含量、SOD活力值、GSH-Px活力值与对照组比较,差异均具有统计学意义(P<0.05);高浓度组MDA含量与对照组比较,差异具有统计学意义(P<0.05),高浓度组SOD活力值、GSH-Px活力值与对照组比较,差异无统计学意义(P>0.05),见图3。

a:小鼠肾组织MDA含量;b:小鼠肾组织SOD活力值;c:小鼠肾组织GSH-Px活力值 *:与对照组比较,P<0.05
2.4 各组小鼠肾组织cleaved Caspase-3、Bcl-2/Bax蛋白表达水平
Western blot检测显示,低浓度组和对照组比较,高浓度组和对照组比较,小鼠肾组织cleaved Caspase-3/β-actin、Bcl-2/Bax蛋白相对表达量(灰度值比值)差异均无统计学意义(P>0.05),见图4。
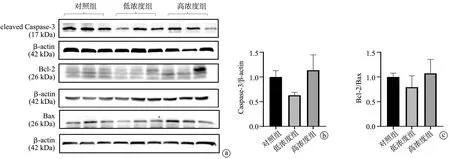
a:各组小鼠肾组织目的蛋白(cleaved Caspase-3、Bcl-2、Bax)和内参蛋白(β-actin)条带;b、c:各组小鼠肾组织cleaved Caspase-3/β-actin、Bcl-2/Bax蛋白相对表达量(灰度值比值)
3 讨论
镉是一种具有致癌、致畸、致突变作用的重金属污染物。根据之前的研究,摄入过量的镉会导致生物体肾、肝、骨骼、神经、呼吸以及生殖等多个器官和系统损伤[10]。其中,肾是慢性镉中毒的主要靶器官之一,大量流行病学研究发现,镉暴露与慢性肾疾病之间存在强烈关联[11]。
然而,镉暴露的剂量不同,产生的效应也不完全相同[12]。为探索合适的镉暴露剂量,本研究进行了预实验,得出半数致死剂量(median lethal dose,LD50)为105.6 mg/kg,因此采用1/720×LD50为低浓度组暴露剂量,即镉水浓度为0.6 mg/L,采用1/120×LD50为高浓度组暴露剂量,即镉水浓度为3.6 mg/L,与Zhang等[13]的研究结果一致。本研究中小鼠暴露时间为12个月,仅监测小鼠7~20周龄体质量增长情况是因为镉暴露3个月后,小鼠体质量趋于稳定,故没有继续监测。
镉通过饮食饮水或者皮肤接触进入生物体后,与金属硫蛋白(metallothionein,MT)结合,形成镉—金属硫蛋白复合物(Cd-MT)。Cd-MT通过血液到达肾,并在肾中沉积,主要损害肾小管和肾皮质[14-15]。本研究结果显示,镉进入小鼠体内后,主要蓄积在肾,与文献报道结果一致[14-15]。值得注意的是,镉在各器官的分布还取决于暴露时间,急性暴露后,镉主要富集于肝[16-17],与本实验的慢性暴露有所不同。
氧化应激是镉致肾毒性的主要机制之一。在正常生理情况下,机体有一套完整的抗氧化酶系统以抵御氧自由基损伤。SOD是其中一种重要的抗氧化酶,能够将氧自由基歧化为过氧化氢,并进一步在GSH-Px的作用下转化为水,从而达到清除过量氧自由基的目的。研究表明,在慢性镉暴露造成肾损伤的过程中,氧自由基大量生成,而SOD和GSH-Px等酶活性受抑制,未被清除的氧自由基持续攻击细胞膜脂质,出现脂质过氧化反应,造成终产物MDA的堆积,因此,MDA含量可间接反映机体受氧自由基攻击的程度[18]。Renugadevi等[19]研究发现,经CdCl25 mg/kg处理4周后,大鼠血清尿素、尿酸和肌酐水平明显升高,肌酐清除率显著降低,尿中尿素、尿酸和肌酐的含量明显降低,提示肾功能损伤;进一步研究发现大鼠肾组织脂质过氧化指标MDA升高,抗氧化酶SOD、GSH-Px及过氧化氢酶CAT显著降低,大鼠肾小管坏死变性,基底膜增厚、管腔铸型形成,提示氧化应激参与了肾损伤过程。本研究结果亦显示,低浓度组和高浓度组小鼠肾组织MDA均升高,提示存在脂质过氧化损伤;然而,低浓度组小鼠肾组织抗氧化酶SOD和GSH-Px亦被激活,推测可能是由于低浓度镉暴露后小鼠肾组织尚有一定的代偿能力,而高浓度组小鼠由于镉暴露剂量大,持续时间长,已无法检测到抗氧化酶系统的激活。
镉引起的肾毒性还与镉诱导的凋亡通路激活有关。Caspase-3是白细胞介素1β转化酶家族成员之一,在细胞凋亡过程中占据重要地位。正常情况下,胞质中的Caspase-3以无活性的酶原(pro-Caspase-3)形式存在,当凋亡信号通路被激活时,在多种蛋白水解酶作用下,pro-Caspase-3发生裂解而活化。活化的Caspase-3(cleaved Caspase-3)蛋白表达水平与Caspase-3的活性呈正相关。Bcl-2是第一个被确认的能对抗细胞凋亡的基因,其中Bcl-2α是抑制凋亡的主要蛋白。促凋亡基因编码的Bax与Bcl-2对抗,可阻止Bcl-2α抗凋亡作用的发挥,通常Bcl-2/Bax比值下降反映凋亡通路的激活。Mao等[20]发现HEK-293细胞在30~60 μmol/L CdCl2作用下Bax表达增加,Bcl-2表达下降,Caspase-3活性增强,预处理转染pcDNA3/Bcl-2质粒后,这些现象均得到缓解。Prozialeck等[21]研究发现,SD大鼠给予镉处理6周后,其肾小管细胞出现明显凋亡现象,尿液中肾损伤分子-1、GSH-Px、乳酸脱氢酶显著增高。Li等[22]认为镉通过电压依赖性钙通道进入细胞,诱导内质网钙释放,进而诱导DNA碎片化和细胞凋亡;另一方面,镉可能激活Caspase-8,进而激活Caspase-3诱导细胞凋亡,但是这种情况往往发生于急性镉暴露的情形。另有研究表明,镉暴露的细胞中只有一小部分死于凋亡,其余的细胞则可能成为抗凋亡细胞,而镉转化或镉适应细胞反而增加了对凋亡的抵抗,更容易发生肿瘤转化[23]。事实上,凋亡的破坏被认为是肿瘤形成和恶性进展的关键[24]。本研究未检测到低浓度组和高浓度组慢性镉暴露小鼠中cleaved Caspase-3蛋白的激活,Bcl-2/Bax相对表达量和对照组比较亦没有显著差异。推测可能是由于暴露时间较长,慢性镉暴露小鼠肾组织出现了代偿,或者小鼠肾组织已出现坏死或肿瘤转化,导致无法检测到凋亡蛋白的激活。本研究的局限性在于未能及时对小鼠肾组织进行病理切片观察,故缺少肾损伤的病理学证据支持,并且没有进一步在动物或者细胞水平上进行氧化应激或者凋亡的机制研究。
综上,本研究发现,对于慢性镉暴露的小鼠,镉主要蓄积在肾,并诱导肾组织氧化应激改变,造成组织损伤。研究表明,减轻氧化应激可缓解镉的肾毒性[25-26],若能将防治镉致肾毒性的药物运用到临床治疗上,对于保护人类健康具有重要的现实意义。
