跑台运动对腹主动脉缩窄诱导的心衰大鼠骨骼肌凋亡和VEGFB及其受体表达的影响
2022-05-30李灵杰陈雪飞李世田张玉寒
李灵杰 ,张 靓 ,陈雪飞 ,李世田 ,张玉寒 ,任 静 ,余 玥
心力衰竭是指由心脏结构和功能异常导致心室收缩或舒张能力受损而引起的一系列病理生理变化的临床综合征(Braunwald et al.,2015)。临床上以左心室射血分数(left ventricular ejection fractions,LVEF)降低 50% 为临界点,将心衰分为射血分数降低的心衰(heart failure with re‑duced ejection fraction,HFrEF)和射血分数保留的心衰(heart failure with preserved ejection fraction,HFpEF)(LVEF≥50%)(Sharma et al.,2014)。其中,HFpEF的患病率约占全部心衰的50%,主要发病人群是老年、女性,与HFrEF相比,其病因更加复杂、治疗效果不明显、预后差、死亡率高,正受到越来越多专家学者的关注(Sharma et al.,2014)。根据HFpEF的病因,有学者提出,在HFpEF的治疗中,要从关注“中心机制”转向“外周机制”(Maurer et al.,2012;Upadlhya et al.,2015;Wolfel,2016),骨骼肌正成为HFpEF治疗的主要靶器官之一。HFpEF时,骨骼肌质量减轻、横截面积减小、显著萎缩是骨骼肌改变的主要特征。炎症、氧化应激、自噬等多种机制诱导的骨骼肌细胞凋亡是导致骨骼肌萎缩的重要机制(Chang et al.,2017;Cunha et al.,2012;Fujita et al.,2015;Martins et al.,2014)。
对肌肉萎缩和恶病质的治疗手段主要包括营养补充、药物治疗和运动干预(李灵杰等,2017),运动干预对提升心衰患者生理功能、减少发病率和死亡率的有利作用在早期研究中就被证实(Willius et al.,1961),至今,运动被认为是有临床意义的抗骨骼肌萎缩的治疗方法(Okoshi et al.,2017;Von et al.,2015)。有实验研究证实,适度的运动显著改善HFpEF患者的肌肉萎缩(Souza et al.,2014;Tzanis et al.,2017)。运动通过抗氧化应激、抗炎、改善氧气利用等多个途径改善心衰时肌肉萎缩,此外,运动调节肌肉因子的转录和表达已成为重要的作用靶点。研究发现,骨骼肌肌肉生长抑制素(myosatin,MSTN)、白介素-6、脂联素等在运动改善心衰中有着重要意义(Cai et al.,2018;Lenk et al.,2012;Ribeiro‑Samora et al.,2017)。
血管内皮生长因子B(vascular endothelial growth fac‑tor‑B,VEGFB)是血管内皮生长因子家族新成员(Olofs‑son et al.,1996),在骨骼肌中大量表达,除促进血管内皮细胞脂肪酸转运、促进心脏血管生成、管径增加外,还具有强大的抑制凋亡、促进细胞生存的作用(Zafar et al.,2017)。在血管内皮和平滑肌细胞、心肌细胞及大脑皮层神经元、视网膜神经元等多种细胞,VEGFB均能显著促进存活,抑制凋亡的发生(Falk et al.,2011;Zhang et al.,2014)。心衰时,骨骼肌VEGFB的表达如何改变,能否通过运动调节其表达,增强其抗凋亡的效应进而改善骨骼肌萎缩,目前鲜见报道。
本研究以腹主动脉缩窄(abdominal aortic constriction,AAC)的大鼠为HFpEF模型,观察运动对骨骼肌萎缩和凋亡的作用及骨骼肌VEGFB及其受体血管内皮生长因子受体 1(vascular endothelial growth factor receptor 1,VEG‑FR1)和其辅受体神经纤毛蛋白 1(neuropilin‑1,NRP1)表达的改变,探讨VEGFB在运动改善心衰大鼠骨骼肌凋亡中的作用。
1 材料与方法
1.1 实验动物与材料
实验动物选用清洁级雄性SD大鼠,购于北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016‑0006。动物分笼饲养,室内温度为22℃±5℃,湿度为50%±10%,明暗交替周期为12 h,自由进食和饮水。所有饲料均由华阜康动物实验饲料厂提供。VEGFB、NRP1、VEGFR1抗体购自 Abcam 公司(Cam‑bridge,UK),脱氧核糖核苷酸末端转移酶介导的dUTP缺口末端标记法(terminal deoxyribouncleotidyl transferase‑mediated dUTP nick‑end labeling,TUNEL)试 剂 盒 购 自Roche公司(Basel,Switzerland)。实验中所用其他试剂均为市售分析纯试剂。
1.2 动物分组与运动方案
选取210 g健康雄性SD大鼠32只,适应性饲养1周后,随机分成对照组(CON,n=8)和腹主动脉缩窄手术组(n=24),分别进行假手术和腹主动脉缩窄手术组,4周后,腹主动脉缩窄手术大鼠随机分为腹主动脉缩窄手术安静组(AAC,n=12)和腹主动脉缩窄手术运动组(AAC+E,n=12)。AAC+E组采用跑台运动,第1周进行适应性训练,从5 m/min、10 min/天、5天/周逐渐递增至第1周末的12 m/min、40 min/天,5天/周,以后的负荷同第1周末负荷,训练干预4周。运动方案参考Souza等(2014)。每次训练在16:00—18:00进行,不使用声、光、电等刺激手段。
1.3 腹主动脉缩窄术
腹主动脉缩窄术是模拟压力后负荷诱导的心力衰竭模型。210 g雄性SD大鼠,适应性饲养1周。术前禁食24 h,1%戊巴比妥钠麻醉,肋骨下缘0.5 cm处腹左侧备皮,腹正中线旁0.5 cm处行2 cm左右切口,逐层分离皮下组织,进入腹腔。分离肠管,直到显露后腹膜和左侧肾脏,找到腹主动脉和肾动脉,于肾动脉上方分离腹主动脉,使用0.7 mm银夹缩窄大鼠腹主动脉,恢复肠管和脏器的位置,滴入青霉素适量,逐层缝合切口;假手术组只打开腹腔,分离腹主动脉,不使用银夹(Lu et al.,2015)。大鼠术后4周,出现心脏的代偿性改变,在术后8周,出现失代偿,发展为心力衰竭(奚晓青等,2016)。术后8周进行超声心动测定,测定指标包括左心室质量(LV mass)、左室舒张末期前壁厚度(left ventricular diastolic anterior wall thickness,LVAW d)、左室舒张末期内径(left ventricular in‑terval diameter at end‑diastole,LVID d)、左室收缩末期内径(left ventricular interval diameter at end‑systole,LVID s)增厚 ,左室缩短分数(left ventricular fraction shortening,LVFS)降低,左室射血分数(left ventricular ejection frac‑tion,LVEF)降低但是仍大于50%,作为HFpEF成功模型。
1.4 取材
大鼠末次运动结束24 h后,禁食过夜,自由饮水。称重后麻醉,腹主动脉取血,分离心脏、比目鱼肌和腓肠肌的白肌部分进行实验。
1.5 超声心动测定
测定前,腹腔注射1%戊巴比妥钠(Sigma‑Aldrich,St.Louis,MO,USA)麻醉,胸部备皮,仰卧位将其头部及四肢固定在小动物超声实时影像系统VEVO 2100(VisualSon‑ics Inc,Toronto,Canada)测试板上,将探头置于左前胸,与前正中线呈30°左右的夹角,显示胸骨旁左室长轴切面;探头顺时针旋转90°可显示左室短轴切面图像,取M型曲线,进行心功能测量。超声心动图测量指标包括:LVID d与 LVID s;LVAW d与后壁厚度(left ventricular diastolic posterior wall thickness,LVPW d);LVEF和LVFS。所有测量值均测量3个心动周期取平均值。
1.6 TUNEL染色
比目鱼肌与腓肠肌均置于10%的多聚甲醛溶液中浸泡过夜,转至20%蔗糖溶液中浸泡过夜,进行石蜡包埋,用于石蜡切片,切片厚度为5 μm。按照试剂盒流程进行:4%多聚甲醛室温固定15 min,0.5%Triton X‑100室温孵育5 min,PBS洗涤3次,每次5 min。按1:9的比例避光混合TdT酶和荧光标记液,配置TUNEL检测液。充分弃去各孔PBS,每孔加入TUNEL检测液50 μL,37℃孵育60 min后加入DAPI复染5 min。PBS洗涤3次。荧光显微镜观察和拍摄图片。
1.7 Real‑time PCR测定腓肠肌和比目鱼肌中VEGFB及其受体、凋亡相关基因的mRNA水平
采用天根动物组织总RNA提取试剂盒(TianGen Bio‑tech,Beijing)提取骨骼肌总RNA,天根逆转录系统(Tian‑Gen Biotech,Beijing)进行逆转录。Real‑time PCR反应体积共 20 μL:Super Real Pre Mix Plus(SYBR Green)体系(TransGene Biotech,Beijing)15 μL,10 μmol/L 的上下游引物各0.5 μL,cDNA模板5 μL。所有引物均由生工生物工程(上海)股份有限公司(Shanghai,China)合成。进行94 ℃ 30 s,94 ℃ 5 s,60 ℃ 30 s,热循环 40次。Real‑time PCR于ABI Q6实时荧光定量PCR仪(Applied Biosystems,USA)上进行,以GAPDH作为内参(表1)。

表1 Real-time PCR测定的基因表达引物序列Table1 The Primer Sequence of Genes Detected by Real-Time PCR
1.8 免疫组化
腓肠肌均置于10%的多聚甲醛溶液中浸泡过夜,转至20%蔗糖溶液中浸泡过夜,进行石蜡包埋和切片,切片厚度为5 μm。染色流程:磷酸盐缓冲液(phosphate buffer sa‑line,PBS)洗3次后,过氧化氢孵育5~10 min,消除内源性过氧化物酶的活性。蒸馏水冲洗后,PBS浸泡5 min。经10%山羊血清封闭后冲洗,分别滴加1:100 VEGFB、1:200VEGFR1和1:100NRP1一抗、1:500生物素标记二抗、适量辣根酶工作液37℃孵育10~30 min后,PBS冲洗,显色剂显色。VEGFB、VEGFR1和NRP1特异性染色为褐色。自来水冲洗,复染,脱水,透明,封片,观察结果。随机抽取各组动物比目鱼肌和腓肠肌切片(n=3),在400倍视野下随机观察5个视野,确定VEGFB、VEGFR1和NRP1的表达变化。
1.9 统计方法
实验结果以平均值±标准差(M±SD)表示。数据采用Prism 5.0软件进行单因素方差分析处理,P<0.05为有显著性差异。
2 结果
2.1 跑台运动对心衰大鼠心脏结构和功能的影响
腹主动脉缩窄手术8周后,AAC大鼠心脏左心室质量显著高于CON组(P<0.05),心肌细胞横截面积增大;与AAC组相比,4周跑台运动显著降低心衰大鼠心脏左心室质量和心肌细胞横截面积(P<0.05;图1A~1C)。ANP和BNP是检测心脏病理性重塑的重要分子指标,与对照组相比,AAC 大鼠 ANP(P<0.001;图 1D)和 BNP(P<0.001;图1E)的mRNA表达显著升高,达10倍左右;与AAC组相比,跑台运动显著降低了ANP(P<0.01)和BNP(P<0.01)的mRNA相对表达(图1D,图1E)。
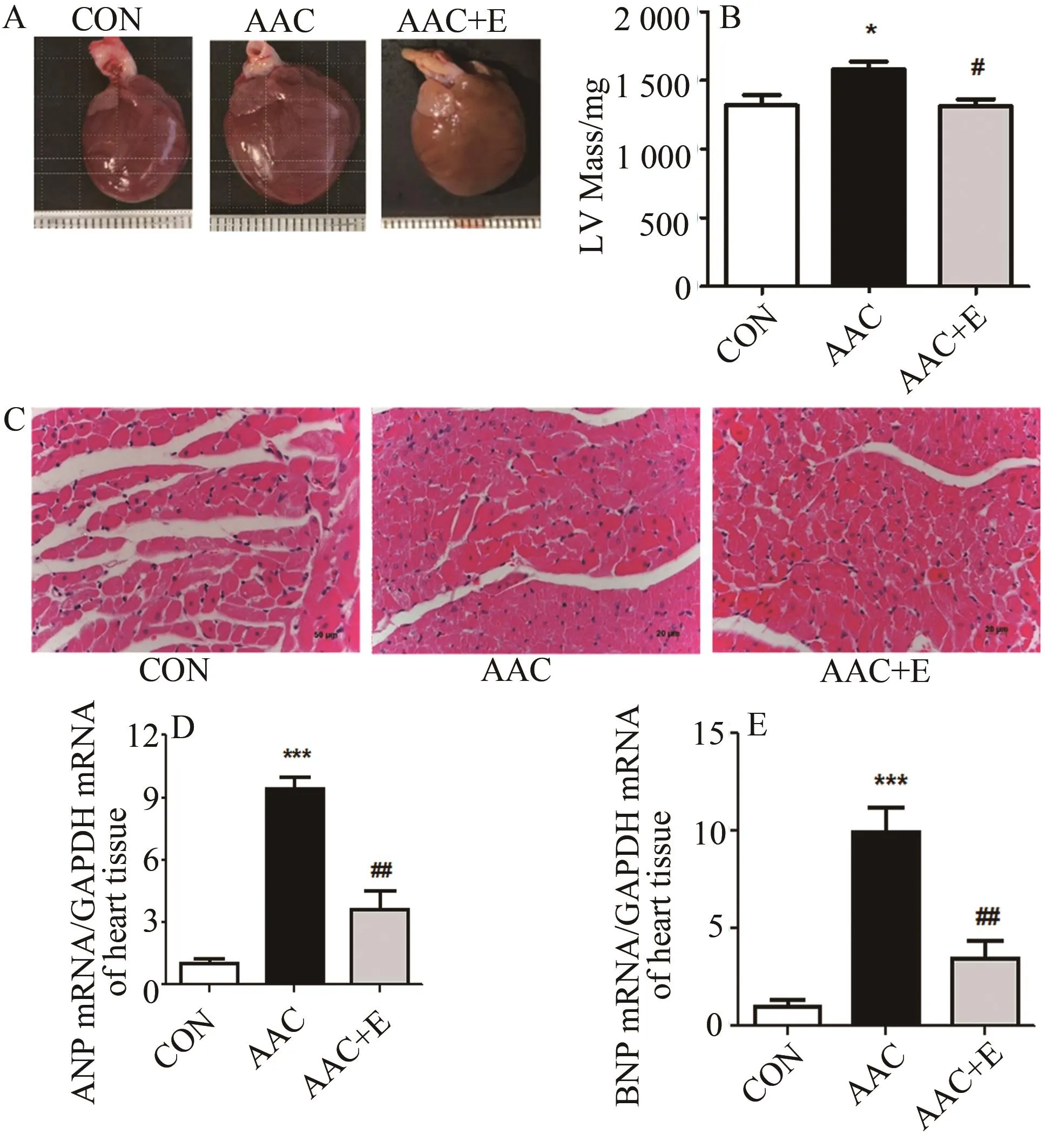
图1 各组大鼠心脏质量形态和心肌ANP和BNP表达的比较Figure 1. Heart Weight,Heart Morphology and the Comparison of Myocardium ANP,BNP mRNA Expression in Three Groups
腹主动脉缩窄手术8周后,与CON组相比,AAC大鼠LVAW d显著增加(P<0.05;图2B),LVPW d有增大的趋势,差异不具有显著性(图2C),LVID d显著增加(P<0.01;图2E),LVID s显著增加(P<0.001;图2F),LVEF显著降低(P<0.001;图2D),但保留50%以上,LVFS显著降低(P<0.01;图2G),提示,腹主动脉缩窄手术诱导射血分数保留型心衰大鼠模型确立。4周跑台运动干预后,与AAC组相比,AAC+E组LVAW d显著降低(P<0.05),LVPW d显著降低(P<0.05),LVID d显著降低(P<0.05),LVID s显著降低(P<0.05)。4周运动干预后,与AAC组相比,AAC+E组大鼠LVEF和LVFS有上升趋势,差异不具有显著性。
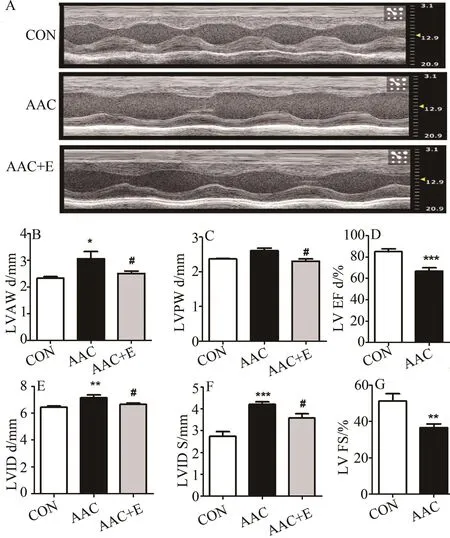
图2 各组大鼠心脏超声心动结果比较Figure 2. Comparison of Heart Echocardiography of Three Groups
2.2 跑台运动抑制心衰诱导的大鼠骨骼肌萎缩
腹主动脉缩窄手术8周后,与CON组相比,AAC大鼠腓肠肌和比目鱼肌质量显著降低(P<0.05和P<0.05);与AAC组相比,4周有氧运动显著增加AAC大鼠腓肠肌和比目鱼肌质量(P<0.05和P<0.05;图3A、图3B)。H.E.染色结果显示,与CON组相比,AAC大鼠腓肠肌肌细胞核增多,肌纤维的规则排列被破坏,细胞形态趋于圆形化和边缘多边形态,肌细胞间隙有胶原沉积和纤维化物质,细胞直径差异增大(图3C);与AAC组相比,4周有氧运动恢复了肌纤维的规则排布和减少了细胞核数量。与CON组相比,AAC大鼠比目鱼肌肌纤维的规则排列被破坏,肌纤维筋膜间隙增大(图3D);与AAC组相比,4周有氧运动显著增加了比目鱼肌质量(P<0.05;图3B),恢复了肌纤维的规则排布和肌纤维筋膜结构(图3D)。
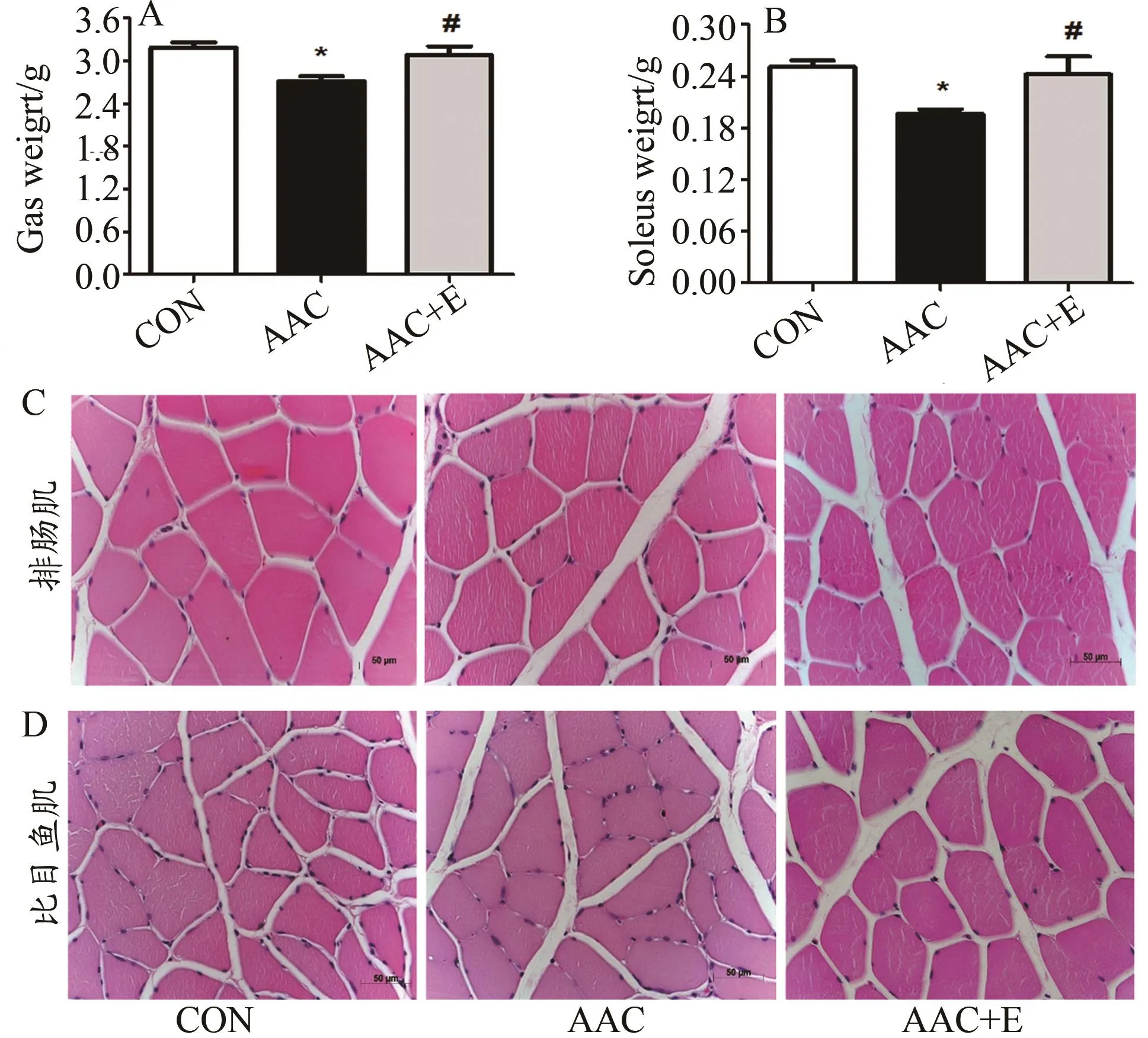
图3 各组大鼠腓肠肌和比目鱼肌质量和肌纤维结构的比较Figure 3. The Gastrocnemius and Soleus Muscle Weight and Muscle Fiber Morphology Comparison of Three Groups
肌肉环指蛋白 1(muscle ring finger 1,MuRF1)和肌肉萎缩盒F蛋白(muscle atrophy F‑box,MAFbx)/Atrogin‑1是在骨骼肌中特异性表达的E3泛素连接酶。MSTN是肌肉质量的负调控因子。本研究将它们作为骨骼肌萎缩的分子标志。实验结果显示,与对照组相比,AAC大鼠腓肠肌和比目鱼肌MuRF1 mRNA相对表达显著升高(P<0.001,P<0.001),升高倍数为3~5倍(图4A、图4D),腓肠肌MAFbx mRNA表达有增高的趋势,无显著性差异(图4B),比目鱼肌MAFbxmRNA相对表达显著升高(P<0.05;图4E),腓肠肌和比目鱼肌MSTN mRNA相对表达量显著升高(P<0.01和P<0.001;图4C、图4F);与AAC组相比,4周有氧运动显著降低了腓肠肌和比目鱼肌MuRF1的表达(P<0.01和P<0.001),腓肠肌MAFbx表达有下调趋势,比目鱼肌MAFbx显著降低(P<0.05),腓肠肌和比目鱼肌MSTN的相对表达量显著降低(P<0.05,P<0.001)。

图4 各组大鼠腓肠肌和比目鱼肌萎缩分子指标的比较。Figure 4. The Comparison of Gastrocnemius and Soleus Muscle Atrophy Molecular Markers of Three Groups
2.3 跑台运动抑制心衰诱导的大鼠腓肠肌凋亡
与CON组相比,AAC大鼠腓肠肌Bax(P<0.001;图5A)、caspase3(P<0.01;图5D)mRNA表达显著升高,Bax/Bcl2比值显著增大(P<0.001;图5C);与AAC组相比,4周有氧运动可以显著抑制Bax(P<0.05)、caspase3(P<0.01)mRNA的表达和Bax/Bcl2比值(P<0.01)。
与CON组相比,AAC组比目鱼肌Bax、Bcl2、caspase3 mRNA的表达和Bax/Bcl的比值差异均不具有显著性,与AAC组相比,AAC+E组Bax、Bcl2和caspase3 mRNA的表达和Bax/Bcl的比值差异不具有显著性(图5E~图5H)。
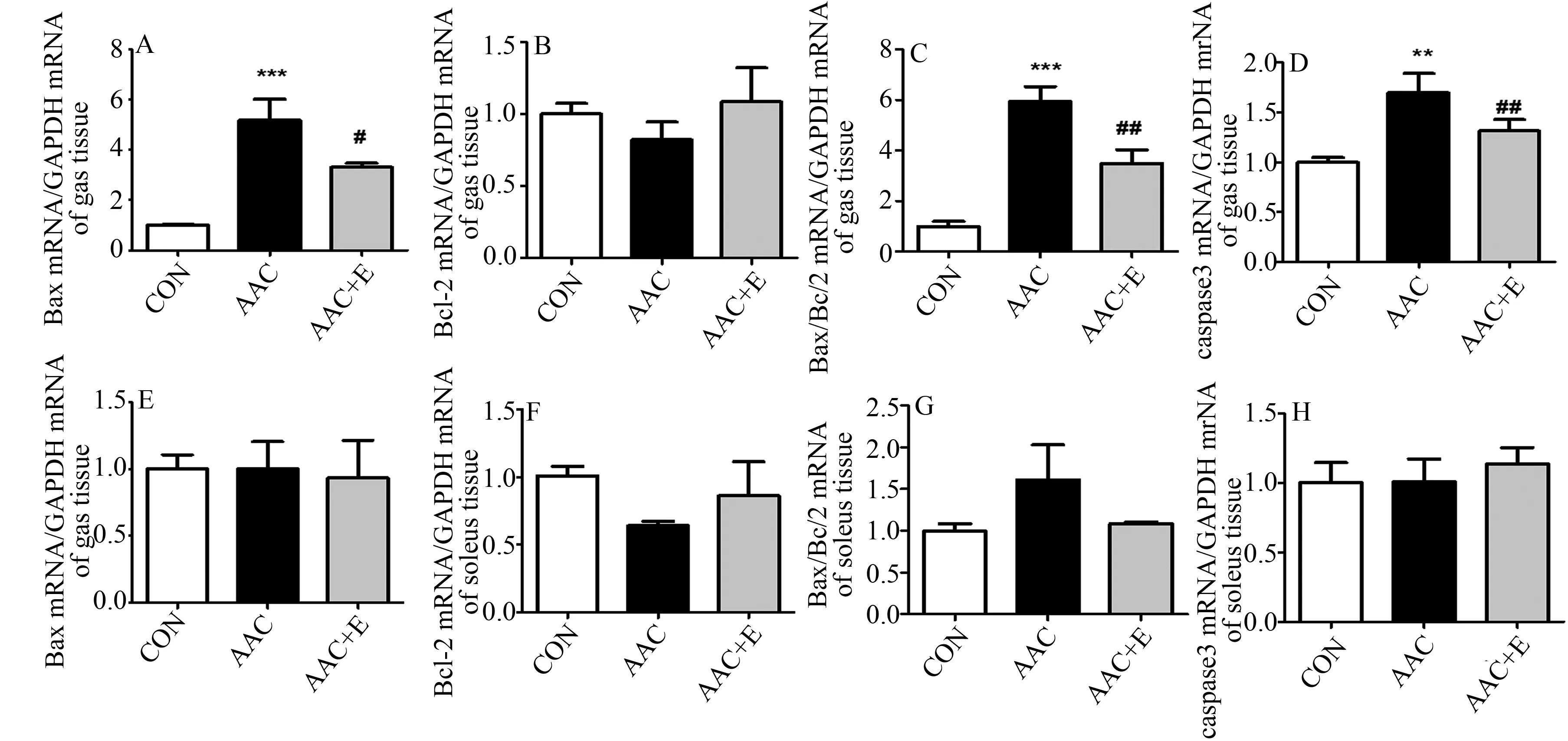
图5 有氧运动对腓肠肌和比目鱼肌凋亡分子标记Bax、Bcl2、Bax/Bcl2和caspase3 mRNA表达的影响Figure 5. The Effects of Aerobic Exercise on Gastrocnemius and Soleus Muscle Apoptosis Molecular Markers of Bax,Bcl2,Bax/Bcl2,and Caspase 3 mRNA Expression
本研究采用TUNEL检测骨骼肌细胞凋亡的情况。TUNEL染色阳性凋亡细胞核为绿色,细胞核为蓝色DAPI染色,从图6可以看出AAC大鼠腓肠肌细胞凋亡显著增加,绿色荧光较强;AAC+E组腓肠肌绿色荧光显著减弱(图6),提示,4周跑台运动能显著抑制腓肠肌肌细胞凋亡。

图6 各组大鼠腓肠肌TUNEL染色的比较(400×)Figure 6. Three Groups Gastrocnemius Muscle TUNEL Staining Comparison(400×)
2.4 跑台运动促进心衰大鼠比目鱼肌和腓肠肌VEGFB及其受体VEGFR1和NRP1的表达
与CON组相比,AAC大鼠腓肠肌和比目鱼肌VEG‑FB mRNA相对表达量显著降低(P<0.01,P<0.01);4周的跑台运动显著增加了心衰大鼠腓肠肌和比目鱼肌VEGFB mRNA相对表达(P<0.001和P<0.001;图7A、图7D)。与CON组相比,AAC大鼠腓肠肌和比目鱼肌VEG‑FR1 mRNA表达无显著变化;与AAC组相比,AAC+E组腓肠肌和比目鱼肌VEGFR1(图7B、图7E)mRNA的表达水平显著上调(P<0.01)。无论是腓肠肌还是比目鱼肌,3组间NRP1表达均无显著性差异(图7C、图7F)。免疫组化结果提示,跑台运动显著上调腓肠肌VEGFB和VEG‑FR1蛋白表达水平(图8A、图8B)。

图7 运动促进AAC大鼠腓肠肌和比目鱼肌VEGFB及其受体VEGFR1,NRP1 mRNA的表达Figure 7. Exercise Promoted AAC Rats Gastrocnemius and Soleus Muscle VEGFB and Its Receptor VEGFR1,NRP1 Expression

图8 运动促进腓肠肌VEGFB及其受体VEGFR1蛋白的表达,免疫组化结果Figure8.Exercise Promoted Gastrocnemius Muscle VEGFB andIts Receptor VEGFR1 Protein Expression of ImmunohistochemicalStaining
3 讨论
3.1 心衰时骨骼肌萎缩
临床研究发现,心力衰竭患者骨骼肌出现明显萎缩,大约2/3的心力衰竭患者腓肠肌质量显著降低(Kennel et al.,2015),骨骼肌萎缩是心力衰竭病人死亡的独立风险因素(Fearon et al.,2013)。本研究利用腹主动脉缩窄8周诱导的HFpEF模型,大鼠心质量增加,左室壁厚度增加,左室舒张和收缩功能均降低,射血分数保留50%以上,模型指标符合HFpEF表现。发现AAC大鼠比目鱼肌和腓肠肌质量均出现显著下降,肌细胞圆形化和小角化,骨骼肌萎缩的多个分子标志基因,MuRF1、MAFbx和MSTN的表达在骨骼肌均显著上调,与Mangner等(2015)和Cunha等(2012)结果一致,提示,AAC诱导的心衰大鼠出现了显著的骨骼肌萎缩。
心力衰竭时,多种机制诱导了骨骼肌萎缩的发生。心衰时骨骼肌毛细血管密度下降,血管内皮功能下降,导致骨骼肌血液灌注量下降(Okita et al.,2013);机体的炎症水平升高,多种炎症因子如IL‑1、IL‑6和TNF‑α水平显著升高(Suthahar et al.,2018);氧化应激系统过度激活,活性氧大量生成(Dey et al.,2018),这些因素共同作用、彼此叠加,诱导骨骼肌凋亡发生,进一步加重肌肉萎缩,促进心源性恶病质的发展。在心力衰竭患者和心衰动物模型中均发现骨骼肌细胞的程序性死亡,线粒体色素C氧化酶的释放、半胱氨酸天冬氨酸蛋白酶3和9的激活(Fu‑jita et al.,2015;Vescovo et al.,2006)。骨骼肌细胞凋亡是心力衰竭时肌肉萎缩的重要机制。本研究也发现,心衰大鼠腓肠肌Bax/Bcl2比值显著升高,TUNEL染色显著增强,提示,腓肠肌细胞凋亡显著增强。但在慢肌纤维为主的比目鱼肌却未发现显著的凋亡增加,提示,心衰时快肌纤维更易于发生凋亡。
3.2 运动改善心衰骨骼肌萎缩
运动是改善心衰时骨骼肌萎缩有效的防治手段之一,Lenk等(2012)对12名心衰患者的运动干预发现,骨骼肌MSTN分泌显著降低,心衰诱导的骨骼肌萎缩得到显著改善。Souza等(2014)在升主动脉缩窄18周的Wi‑star大鼠,进行10周有氧运动干预发现,比目鱼肌肌肉萎缩明显改善,萎缩标志分子MuRF‑1和MAFbX表达显著降低。本研究结果同样证实中小强度的跑台运动后,大鼠比目鱼肌和腓肠肌质量恢复,萎缩减轻,萎缩的分子标志基因表达均显著降低,提示,运动有效抑制了AAC诱导的骨骼肌萎缩。同时,虽然运动显著地改善AAC诱导的心脏重塑,但未对心功能有显著的改善作用,运动后心脏的射血分数并没有显著升高,该结果与多篇报道一致(Bhella et al.,2011;Haykowsky et al.,2012;Tucker et al.,2018;Upadhya et al.,2015),提示,运动改善HEpEF的骨骼肌萎缩并不是通过“中心机制”,即不是通过改善心功能实现的。运动可能是通过“外周机制”,即直接作用于骨骼肌本身,发挥其抗萎缩效应。
运动对细胞凋亡的效应是明确的,有氧运动可以抑制神经细胞caspase3、Bax的表达,表现出强大的抗凋亡作用(Jang et al.,2018;Terashi et al.,2019);运动可以改善肿瘤化疗引起的肌肉萎缩,抑制肌细胞凋亡(Park et al.,2019),抑制衰老引起的骨骼肌细胞凋亡(Dethlefsen et al.,2018;Marzetti et al.,2008)。目前,关于运动抗心衰时骨骼肌凋亡的研究尚未见报道。本研究证实,中小强度跑台运动显著下调了腓肠肌Bax/Bcl2的比值,TUNEL染色阳性显著减少,提示,骨骼肌凋亡显著减轻。
运动抑制骨骼肌凋亡的机制,有研究报道运动可通过调节骨骼肌中 MSTN(Lenk et al.,2012)、ghrelin(Tsub‑ouchi et al.,2014)、白介素-6(Nunes et al.,2013)和脂联素(Krause et al.,2008)等肌肉因子的表达、合成和分泌,减轻骨骼肌的萎缩。
3.3 肌肉因子VEGFB的抗凋亡作用
VEGFB是VEGF家族成员之一,在体内代谢性旺盛的组织和细胞大量表达,有着丰富的生物学功能,主要表现在促进内皮细胞脂质摄入、促进心脏血管生成、管径增加等作用(马谨等,2015)。有研究证实,VEGFB具有强大的抑制凋亡、促进细胞生存的作用。有文献报道,VEG‑FB 在 心 肌 细 胞(Huusko et al.,2012;Karpanen et al.,2008)、内皮细胞(Bry et al.,2010;Li et al.,2008)、神经细胞(Arjunan et al.,2018;Falk et al.,2011;Huang et al.,2016;Poesen et al.,2008)均可发挥抑制细胞凋亡的作用。
心梗模型和主动脉缩窄诱导的心力衰竭模型的研究结果发现,血浆 VEGF‑B 显著下降(Huusko et al.,2012;Zhao et al.,2013)。在本实验中,AAC大鼠VEGFB比目鱼肌和腓肠肌mRNA表达和蛋白水平显著降低,与骨骼肌细胞凋亡增加相关,提示,VEGFB在心衰时骨骼肌病变中有重要的病理生理意义。
3.4 运动对骨骼肌VEGFB及其受体的调节作用
VEGFB及其受体在骨骼肌中大量表达,运动对VEG‑FB表达有显著的促进作用。研究提示,单次运动后骨骼肌(Bailey et al.,2006)VEGFB的受体VEGFR1的表达水平显著上调。12周龄小鼠在进行3周自由跑轮运动后,与对照组相比,骨骼肌VEGFB和PGC1α mRNA表达水平显著升高(Boström et al.,2012)。同时,一项在糖尿病小鼠的运动干预实验的研究报道显示,腓肠肌中VEGFB在单次运动后只有上升的趋势,差异不具有显著性(P=0.08)(Kivelä et al.,2008)。目前鲜见关于运动对心力衰竭大鼠骨骼肌VEGFB表达的影响研究。本研究发现,4周的跑台运动显著上调了腓肠肌VEGFB的mRNA和蛋白的表达水平,尤其是运动对骨骼肌中VEGFR1受体的促进作用更为明显,这与前期关于跑台运动促进高脂饮食喂养的肥胖小鼠比目鱼肌VEGFR1表达的研究结果一致(张靓等,2017),但VEGFB作用的辅受体NRP1并未见显著改变,提示,VEGFB及其受体VEGFR1可能是运动抑制心衰大鼠骨骼肌凋亡的分子靶点之一。
4 总结
4周的跑台运动显著提高了心衰大鼠骨骼肌质量,改善腓肠肌和比目鱼萎缩,显著抑制腓肠肌凋亡,VEGFB及其受体VEGFR1的mRNA和蛋白表达显著上调,提示,VEGFB及其受体VEGFR1可能参与了运动抑制心衰时骨骼肌萎缩和凋亡的过程。
