植物油中叔丁基对苯二酚转化产物的识别确证与测定
2022-05-29范小龙朱正伟吴婉琴
范小龙,朱正伟,吴婉琴,胡 玮,黄 坤,江 丰
(湖北省食品质量安全监督检验研究院,湖北省食品质量安全检测工程技术研究中心,湖北武汉 430075)
TBHQ 即叔丁基对苯二酚,是一种合成的且国家允许使用于食品的酚类抗氧化剂,在植物油中最大允许限量为0.2 g/kg[1],其发挥抗氧化作用机制是可以提供活性氢与油脂氧化产生的自由基结合,使自由基转化成稳定的化合物,阻断自由基链式反应,抑制脂质过氧化反应,减缓油脂的氧化和变质:AH+R·→RH+A· ;AH+ROO· →ROOH+A· (AH 代表抗氧化剂)[2−3]。近年来TBHQ 成为了油脂和富含油脂食品中常用的抗氧化剂,但TBHQ 分子量小,易挥发,在加热条件下,挥发损耗较快,且在发挥抗氧化的过程中会通过一系列复杂的氧化还原反应生成相应的转化物[4−7]。其转化产物种类研究较少,目前已有文献报道叔丁基对苯醌(TQ)[8]是TBHQ 转化产物之一,该化合物在油脂储存过程中会伴随TBHQ 的损耗不断产生。且毒理学表明[9]TQ 的毒性远大于TBHQ,其他种类的转化产物未曾报道。
TBHQ、TQ 常用的检测方法有比色法、薄层色谱法[10]、气相色谱法(gas chromatography,GC)[11−13]、高效液相色谱法(highperformance liquid chromatography,HPLC)[14−17]、气质联用法(gas chromatographymass spectrometer,GC-MS)[18−19]、液质联用法(liquid chromatography-mass spectrometer,LC-MS)[20−21]
等。其中,薄层色谱法和比色法在定性、定量方面存在不准确问题。高效液相色谱法存在灵敏度差,定性不足等问题。液相色谱-串联质谱法因其高灵敏度、高选择性及定量定性准确等特性,已广泛应用于各种农兽药残留及添加剂的检测中[22−23]。气相色谱法和气相色谱-串联质谱法对前处理要求高,方法相对复杂但抗干扰能力较好。植物油的化学成分复杂,基质干扰严重,常用的前处理方法有液液萃取法[24−25]、固相萃取柱法[26]。并且TBHQ、TQ 沸点较低,分子量小比较适合采用气相色谱法[27−28],同时鉴于转化产物的含量较低,最后确定了采用气质联用法对TBHQ、TQ 及其他降解产物进行测定研究。因此,本文采用气质联用法对TBHQ 降解产物产生的过程及新的产物的确证进行初步的研究,并建立TBHQ 降解产物的气质联用仪测定的方法,旨在为TBHQ 在加热中的使用及其转化产物在油脂中的安全研究提供支撑。
1 材料与方法
1.1 材料与仪器
标准品:TBHQ(CAS:1948-33-0) 纯度≥98%,购 自 德 国Dr.Ehrenstorfer 公 司;TQ(CAS:3602-55-9) 纯度≥98.3%,购自美国chromadex 公司;2,5-二叔丁基-1,4-苯醌(TBK)(CAS:2460-77-7)
纯度≥99%,购自英国Alfa Aesar 公司;TBHQ 食品级添加剂 浙江一诺生物科技有限公司;乙腈、甲醇、正己烷 色谱纯,均购自德国Merck 公司;植物油:大豆油、花生油、菜籽油、玉米油、葵花籽油 购自超市。
7890B-7000D 气相色谱-质谱联用仪(配有电子轰击离子源(EI))、7697A 顶空进样器 美国Agilent Technologies 公司;XS204 型电子分析天平、ME2002E 型电子分析天平 梅特勒—托利多国际贸易(上海)有限公司;Allegra X-15R 型高速离心机 美国贝克曼库尔特有限公司;UF160 型烘箱 德国Memmert 公司;RK1031 型快速溶剂蒸发仪 英国GenVac 公司。
1.2 实验方法
1.2.1 样品前处理 普通植物油:称取样品2 g(精确至0.001 g),加入5 mL 乙腈饱和的正己烷,涡旋1 min 使样品充分混匀,再加入10 mL 正己烷饱和的乙腈,混匀1 min,4000 r/min 离心5 min,取乙腈层,转入浓缩瓶中,重复提取一次,合并乙腈层,在40 ℃水浴,100 mbar 下减压浓缩至近干,准确加入2.00 mL甲醇溶解残渣,经0.22 μm 滤膜过滤,供分析。
1.2.2 模拟植物油油炸、煎炒时样品前处理
1.2.2.1 加热温度的选择 称取不含抗氧化剂的植物油20 g(精确至0.001 g)至烧杯中,共21 组,每3 组为同一温度,各组称取食品级添加剂TBHQ 4.0 mg(使油脂中TBHQ 含量为0.2 g/kg),充分混匀,置于烘箱中,共考察了25、80、100、120、150、180、200 ℃ 7 个温度,均加热10 h 后按照 1.2.1 处理样品,稀释至合适的浓度,测定样品中TBHQ 的含量,计算TBHQ 损耗率,并计算平均值,常温组25 ℃仅常温放置10 h 不做加热处理。
1.2.2.2 加热时间的选择 称取不含抗氧化剂的植物油20 g(精确至0.001 g)至烧杯中,共30 组,每3 组为同一加热时长,各组称取食品级添加剂TBHQ 4.0 mg(使油脂中TBHQ 含量为0.2 g/kg),充分混匀,置于烘箱中,共考察了0、2、4、6、8、10、12、24、36、48 h 10 个加热时间,均在180 ℃下加热后按照 1.2.1 项下处理样品,稀释至合适的浓度,测定样品中TBHQ 的含量,计算TBHQ 损耗率,并计算平均值。
1.2.3 TBHQ、TQ、TBK 的测定前处理优化
1.2.3.1 甲醇直接提取 样品直接经过甲醇溶解,定容至合适体积,过0.22 μm 有机系滤膜,上机测定。
1.2.3.2 液-液萃取提取 样品参考了SN/T 1050-2014《出口油脂中抗氧化剂的测定》中前处理方法[29]:称取2 g(精确至0.001 g)样品经过乙腈饱和的正己烷溶解,正己烷饱和的乙腈分别提取两次,合并乙腈层后在40 ℃水浴,100 mbar 下减压浓缩至近干,用甲醇定容2.00 mL,过0.22 μm 有机系滤膜,上机测定。
1.2.3.3 固相萃取柱提取 样品参考了GB 5009.32-2016《食品中9 种抗氧化剂的测定第三法》中前处理的方法[30]:称取2 g(精确至0.001 g)样品经过乙腈饱和的正己烷溶解,正己烷饱和的乙腈分别提取两次,合并乙腈层,C18固相萃取柱(2000 mg/12 mL)中装入约2 g 的无水硫酸钠,用5 mL 甲醇活化萃取柱,再以5 mL 乙腈平衡萃取柱,弃去流出液,将乙腈层溶液倾入柱中,弃去流出液,再以5 mL 乙腈和甲醇的混合溶液(2:1,体积比)洗脱,收集所有洗脱液于试管中,40 ℃下旋转蒸发至干,加2 mL 乙腈定容,过0.22 μm 有机系滤膜,上机测定。
1.2.4 标准溶液的配制 称取TBHQ 10.0 mg、TQ 10.0 mg、TBK 10.0 mg 分别至3 个10 mL 容量瓶中,用甲醇溶解并定容至刻度,即为标准储备液。精密吸取TBHQ 储备液100 μL、TBK 储备液100 μL、TQ 储备液500 μL 至100 mL 容量瓶中,用甲醇稀释至刻度,即为标准使用液,则TBHQ 浓度为1 μg/mL、TBK 1 μg/mL、TQ 5 μg/mL。
1.2.5 仪器条件
1.2.5.1 GC 条件 色谱柱Agilent HP-5MS UI 毛细管柱(30 m×0.25 mm,0.25 μm);载气He;载气流速1.0 mL/min;进样口温度230 ℃;分流方式:不分流;柱温(程序升温):初始温度40 ℃,保持1 min,以15 ℃/min 升温至205 ℃,然后以20 ℃/min 升温至280 ℃,保持2 min;进样量1 μL。
1.2.5.2 MS 条件 电子轰击离子源(EI);电离电压:70 eV;离子源温度250 ℃;传输线温度280 ℃,四极杆温度150 ℃;溶剂延迟时间5 min;选择离子监测(SIM)模式下TBHQ 定量离子为m/z 123,定性离子为m/z 166、151,TQ 定量离子为m/z 121,定性离子为m/z 164、149,TBK 定量离子为m/z 205,定性离子为m/z 220、177。
TBHQ 损耗率计算
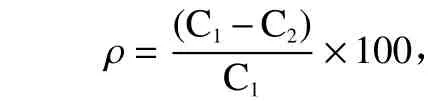
式中,ρ代表TBHQ 损耗率(损耗包括挥发部分及自身转化部分),C1代表加热前TBHQ 含量(g/kg),C2代表加热后TBHQ 含量(g/kg)。
1.3 数据处理
相关质谱数据由MS Quantitative Analysis 分析,数据汇总后,经过Microsoft Office Excel 进行数据处理。
2 结果与分析
2.1 模拟植物油油炸、煎炒时TBHQ 降解产物产生条件
2.1.1 加热温度的确定 考察了25、80、100、120、150、180、200 ℃ 7 个温度,并加热10 h 后,按照样品前处理要求处理样品,上机测定,统计、分析数据,最终得到TBHQ 损耗率与加热温度的关系图,结果见图1。由图1 可知,TBHQ 的损耗率随着温度的升高而逐渐增加,在加热温度为180~200 ℃时TBHQ的损耗率接近60%,这可能与高温加速TBHQ 反应,更多的TBHQ 被氧化有关。在日常生活中,油炸及煎炒时植物油的温度在200 ℃左右,并结合在180 ℃时TBHQ 的损耗率为57.87%,且有研究表明TQ 在180 ℃时生成的量最高,200 ℃时TQ 含量明显减少[31],因此确定加热温度为180 ℃。
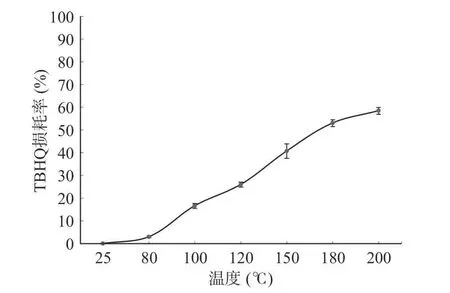
图1 不同的加热温度对TBHQ 损耗的影响Fig.1 Effects of different heating temperatures on TBHQ loss
2.1.2 加热时间的确定 考察了0、2、4、6、8、10、12、24、36、48 h 10 个加热时间,并在180 ℃下加热后,按照样品前处理要求处理样品,上机测定,统计、分析数据,最终得到TBHQ 损耗率与加热时间的关系图,结果见图2。由图2 可知,随着加热时间的增加,TBHQ 损耗也不断升高,这可能是由于TBHQ 自身挥发及自身降解转化造成的,在加热时间小于10 h时,TBHQ 损耗率逐渐提高,且提高速率较快,在10 h之后,损耗率提高速率逐渐趋于平稳,考虑时间及经济效益最终确定加热时长为10 h。
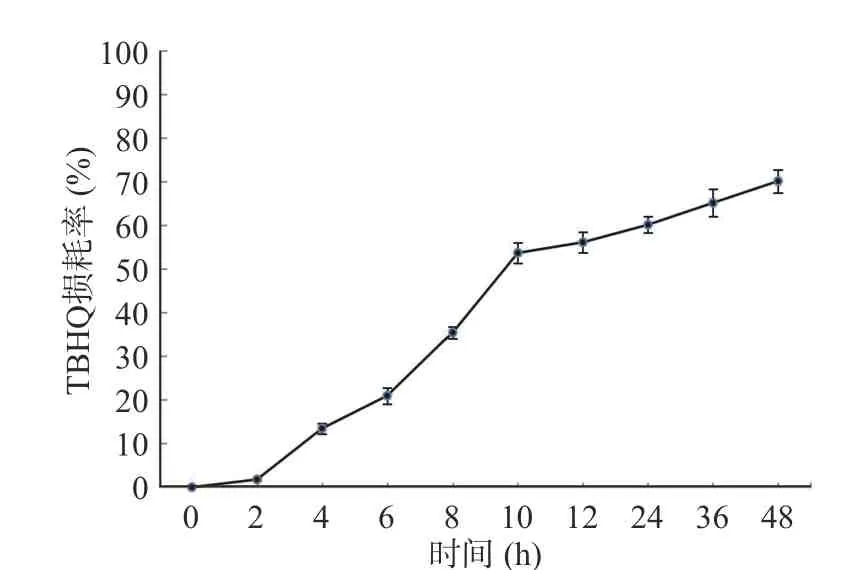
图2 不同的加热时间对TBHQ 损耗的影响Fig.2 Effects of different heating time on TBHQ loss
2.2 植物油加热中TBHQ 转化产物TBK 的确证及TBHQ 抗氧化机理初步分析
TQ 是目前TBHQ 已知、确定的降解产物,是由TBHQ 加热后产生的。本实验在测定TQ 的含量时,将180 ℃加热处理后的TBHQ 样品,经气相质谱全扫定性,在与TQ 色谱峰相差不远的保留时间处,始终存在一个色谱峰,虽然响应没有TQ 高,但峰形,保留时间较稳定,见图3-曲线B,并且空白样品中没有出现此峰,见图3-曲线A,因此考虑此峰可能为一个新的转化物,尝试查看其碎片离子,见图4,并通过美国国家标准与技术研究所NIST(National Institute of Standards and Technology)数据库匹配,匹配到的化合物为2,5-二叔丁基-1,4-苯醌(匹配分数为85.3%)。同时通过对照品的保留时间及碎片离子再次确证,见图3-曲线C,最后确认该化合物即为2,5-二叔丁基-1,4-苯醌(TBK),3 种化合物标准品的色谱图见图5。
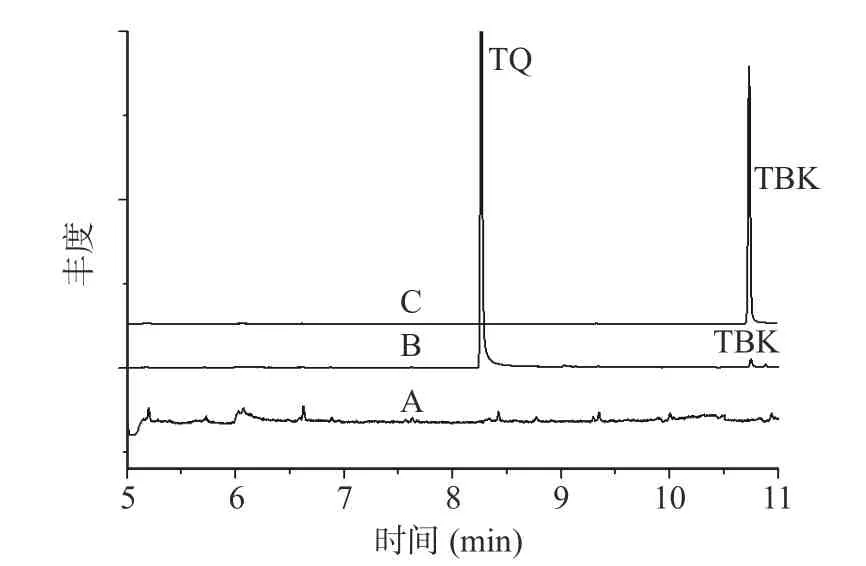
图3 不同样品全扫图与TBK 标准品全扫图对比Fig.3 Differences between full scanchromatograms of different samples and TBK standard注:曲线A:空白样品全扫图;曲线B:含TBHQ 的样品加热处理后质谱全扫图;曲线C:2,5-二叔丁基-1,4-苯醌对照品质谱全扫图。
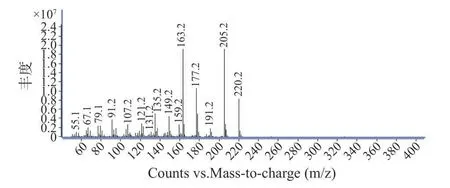
图4 2,5-二叔丁基-1,4-苯醌(TBK)质谱碎片离子图Fig.4 Fragment ion diagram of 2,5-di-tert-butyl-1,4-benzoquinone
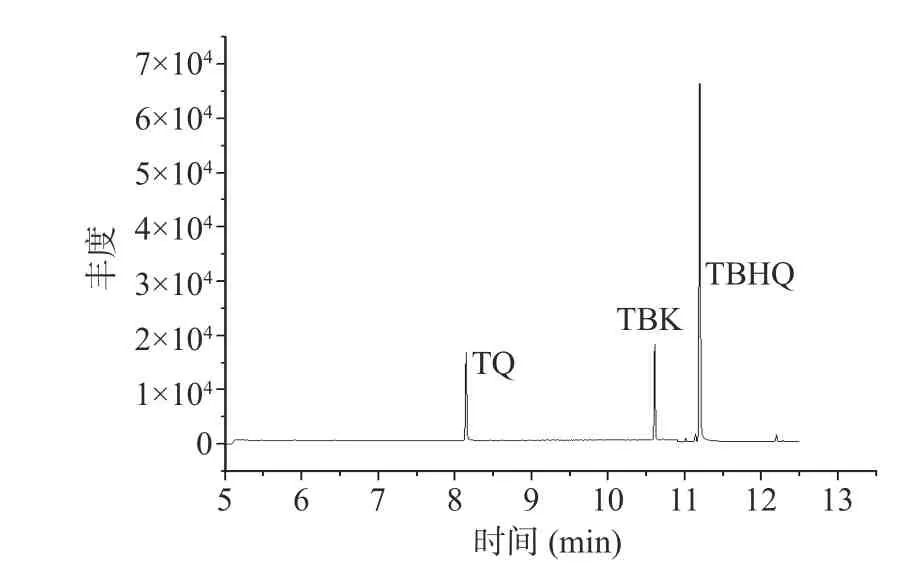
图5 3 种化合物对照品的GC-MS 总离子流图Fig.5 Total ion chromatograms of three compounds
TBHQ 在油脂中的抗氧化机理与其它酚类抗氧化剂抗氧化机理相同,在高温或有氧条件下TBHQ 失去质子并参与油脂中脂肪酸氧化的自由基反应,具体氧化过程如下:TBHQ 具有两个酚羟基,TBHQ 失去一个质子成为一酚氧离子,由单电子氧化变成酚氧自由基,从另一个羟基中质子离解得到半醌阴离子自由基,第二个单电子再氧化得到2-叔丁基苯醌。苯醌的共振稳定化作用,导致TBHQ 朝氧化生成醌的方向进行。TBHQ 也可能在+C(CH3)3攻击下转化成2,5-二叔丁基-1,4-苯酚[32−33],然后苯酚失去质子产生TBK,TQ 与TBK 形成示意图见图6。
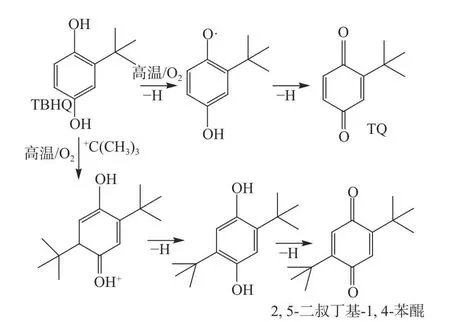
图6 TBHQ 转化产物形成示意图Fig.6 Flow chart of TBHQ transform product formation
2.3 TBHQ、TQ、TBK 的测定
2.3.1 样品前处理的优化 考察了甲醇直接提取样品、液-液萃取提取样品、固相萃取柱提取净化样品3 种不同的提取方式,以TBHQ、TQ 及TBK 回收率为指标选择合适的前处理方式。按照相应的前处理条件处理样品,上机测定,统计、分析数据,结果见表1,结果表明:甲醇直接提取样品上机测定的方法,由于基质干扰较大,杂质对目标物干扰较强,三个目标化合物回收率均较低;液-液萃取的方法与固相萃取柱提取净化样品的方法,三个目标化合物回收率均在85.35%~95.43%之间,回收率较好,表明这两种方法均可以减小杂质的干扰,可以作为三种化合物的前处理方法,但考虑到用固相萃取柱的方法操作会复杂于液-液萃取的方法,而且固相萃取的方法用时较长,最后选择了液-液萃取的方法作为三种化合物测定的前处理方法。
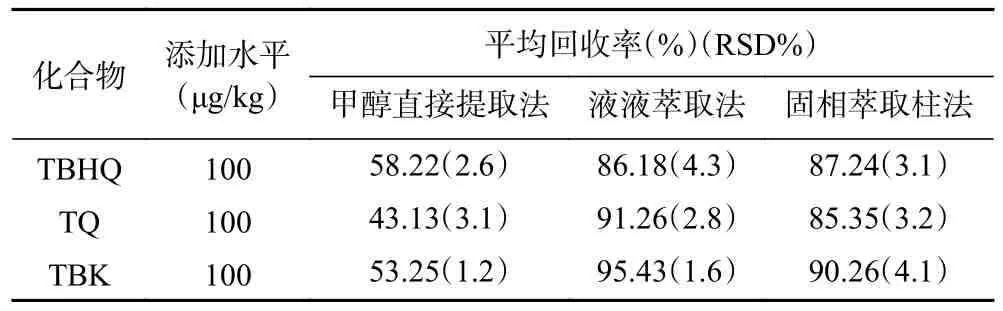
表1 3 种化合物的不同前处理条件下平均回收率(n=6)Table 1 Average recoveries of three compounds under different pretreatment conditions (n=6)
2.3.2 方法学考察
2.3.2.1 线性范围和定量限 选择空白样品,采用逐步定量的添加标准溶液方式,按照前处理方法步骤处理并上机测定,至定量离子定性离子信噪比均大于10 时添加浓度即为定量限。由定量限浓度来计算配制合适的混标使用液浓度,用甲醇稀释,以目标物定量离子的峰面积y 为纵坐标,以质量浓度x(ng/mL)为横坐标绘制标准曲线并进行线性拟合,得到线性回归方程,结果见表2,三种化合物在各自浓度范围内线性良好(R2>0.995),且3 种化合物定量限TBHQ和TBK 为10 μg/kg,TQ 为50 μg/kg 均低于国家标准GB 5009.32-2016 中规定的相关化合物定量限要求(TBHQ 定量限为0.5 mg/kg)[30]。
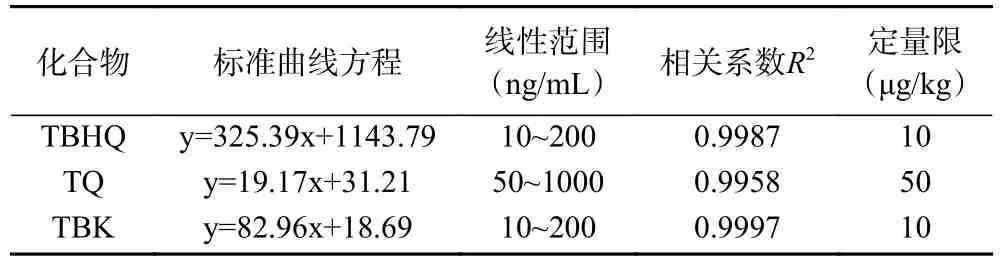
表2 3 种化合物的回归方程、线性范围、相关系数及定量限Table 2 Calibration equations, linear ranges, related coefficients and limits of quantitation of three compounds
2.3.2.2 回收率和精密度 于空白基质中分别添加1 倍定量限10 μg/kg、2 倍定量限20 μg/kg、10 倍定量限100 μg/kg 三个水平的TBHQ、TBK 标准溶液;分别添加1 倍定量限50 μg/kg、2 倍定量限100 μg/kg、10 倍定量限500 μg/kg 三个水平的TQ 标准溶液做回收率实验,每个添加水平重复测定6 次。方法的精密度用6 次平行测定的相对标准偏差(relative standard deviation,RSD)表示。结果表明,3 种化合物平均回收率为83.40%~107.71%,相对标准偏差为1.40%~8.50%,回收率良好,符合一般含量测定的要求,且相对标准偏差均小于10%,表明本方法稳定性良好。结果见表3。
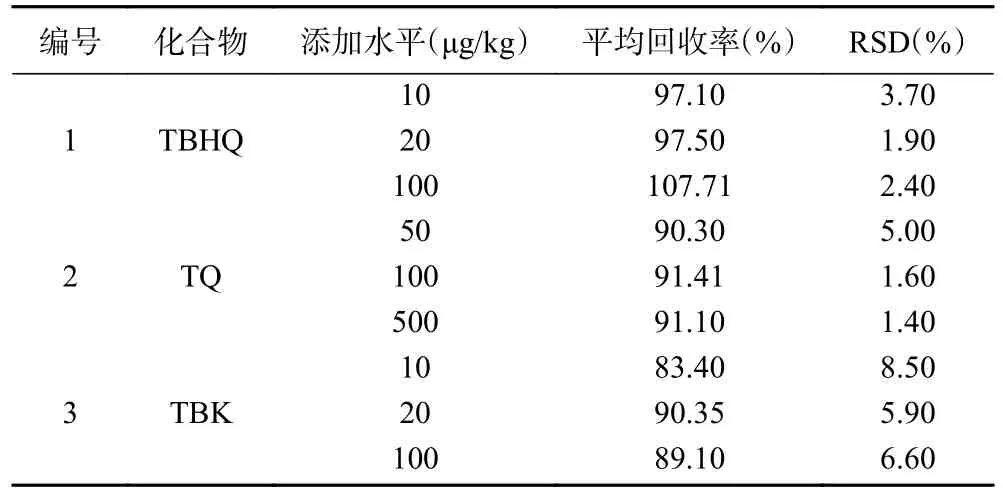
表3 3 种化合物在空白基质中的平均回收率及精密度(n=6)Table 3 Average recoveries and RSDs of three compounds in blank matrix (n=6)
2.4 实际样品的测定与分析
在市场上购买菜籽油5 批,花生油5 批,大豆油5 批,玉米油5 批,葵花籽油5 批,同一品种的油均来自不同的厂家。按照本方法测定,其中在一批标有TBHQ 的大豆油中检测出TBHQ 含量为0.061 g/kg,TQ 含量为0.005 g/kg,2,5-二叔丁基-1,4-苯醌未检出;一批标有TBHQ 的花生油中检测出TBHQ 含量为0.096 g/kg,TQ 含量为0.011 g/kg,2,5-二叔丁基-1,4-苯醌未检出。这两批植物油生产日期距离取样测定时的时间相差18 个月,这也表明,即使常温储存,TBHQ 也会转化为TQ,但均未检测出2,5-二叔丁基-1,4-苯醌,可能2,5-二叔丁基-1,4-苯醌需要高温加热才会产生,因此将上述测定出含有TBHQ 的大豆油、花生油模拟日常生活中煎炸时的油,200 ℃,加热1 h 后,放置,冷却至室温,按照本方法测定3 种化合物,结果见表4,两批油脂经加热后均产生TBK,这也验证了本实验TBK 产生的条件:高温;同时也表明不同的油脂样品TBK 生成量不一样,这可能和油脂不饱和脂肪酸含量有关[34−35]。
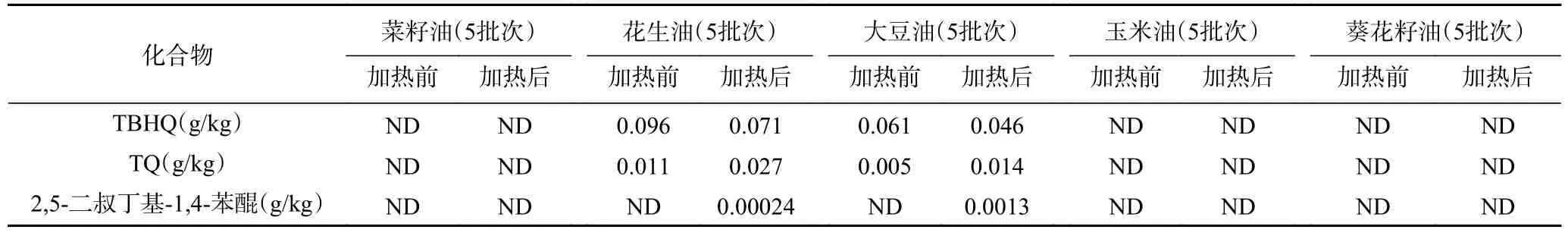
表4 实际样品中三种化合物的含量测定Table 4 Determination of three compounds in different samples
3 结论
在研究TBHQ 已知的转化产物TQ 时,通过气相质谱全扫发现一个新的转化物2,5-二叔丁基-1,4-苯醌,并用本方法测定市场购买的植物油,确定了添加TBHQ 的植物油,经过一定时间的存放,该植物油中TBHQ 会降解成TQ,但不会降解产生2,5-二叔丁基-1,4-苯醌,这可能与植物油使用的温度有关,经过加热处理该植物油,最终也检测出TBHQ 另外一种降解产物物2,5-二叔丁基-1,4-苯醌,同时TQ 含量升高。结果表明含有TBHQ 的植物油在常温放置时容易转化成TQ,在煎、炸等高温处理的过程中易转化成2,5-二叔丁基-1,4-苯醌,更易转化成TQ。本文通过气质联用法,发现并确证了TBHQ 的两种降解产物,并建立了植物油中TBHQ 及其两种降解产物测定的方法,并通过实际样品的验证,表明该方法,操作简单,灵敏度高,可以为植物油监管提供技术支撑。但是,由于TBHQ 新的降解产物2,5-二叔丁基-1,4-苯醌研究较少,其毒性目前也没有相关报道,后期可以对2,5-二叔丁基-1,4-苯醌毒性展开研究,为植物油的使用安全性提供更多有力的数据。
