PD-L1、CTLA-4 及CD276 蛋白在肝癌组织中的表达及其与临床病理特征的关系
2022-05-29厉张金王婕乐婷马海洁
厉张金,王婕,乐婷,马海洁
我国肝癌的发病率和病死率较高,5 年生存率<5%,其中高转移率是患者预后不良的最重要原因之一[1]。B7 家族是最重要的共刺激分子,其中B7 同源物1(B7H1)可与活化T细胞表面表达的程序性死亡因子-1(PD-1)结合,抑制T 细胞受体(T-TCR)介导的T 细胞活化,在肿瘤细胞免疫逃逸中发挥极其重要的作用[2]。细胞程序性死亡配体1(PD-L1)和CD276 分别是B7H1 和B7H3 家族中最重要的两个成员之一。细胞毒T 淋巴细胞相关抗原4(CTLA-4)可与B7 分子结合,参与免疫反应的负调节,为重要的免疫卡控点。本研究拟探讨PD-L1、CTLA-4及CD276 蛋白在肝癌组织中的表达及其与患者临床病理特征的关系,报道如下。
1 资料与方法
1.1 一般资料 84 例肝癌组织样本购自上海芯超生物科技有限公司,组织芯片编号为HLivH090Su01。纳入标准:(1)接受原发性肝癌切除手术患者;(2)病理诊断为肝癌,具有完整的临床病理资料;(3)肉眼辨认肿瘤病灶直径>1 cm;(4)患者术前未接受过放化疗、分子靶向治疗及免疫治疗。其中男75 例,女9 例;年龄31~78 岁,平均(52.3±10.7)岁;按照国际抗癌联盟的AJCC分期(第七版)为Ⅰ期55 例,Ⅱ~Ⅲ期29 例;肿瘤直径>5 cm 26 例,≤5 cm 58 例;所有组织均经过10%甲醛固定、石蜡包埋。
1.2 观察指标(1)患者基本资料:年龄及性别;(2)肝癌组织病理资料:病理分级、肿瘤大小、肿瘤数目、肿瘤包膜是否完整及T/AJCC 临床分期等指标;(3)患者病理资料:肝硬化、血液中乙型肝炎表面抗原(HBsAg)、乙型肝炎病毒核心抗体(HBcAb)、丙型肝炎病毒(HCV)抗体、总胆红素(TB)、丙氨酸氨基转氨酶(ALT)及甲胎蛋白(AFP)含量等指标;(4)免疫组织化学检测PD-L1、CTLA-4、CD276、CD4 及CD8 蛋白的表达情况。
1.3 免疫组织化学法检测 肝癌石蜡包埋组织块制成后,连续切片约4 m厚度,HE 染色,经脱蜡、抗原修复后,采用二步法染色检测 PD-L1、CTLA-4、CD276、CD4 及CD8 蛋白表达。一抗均来自河南赛诺特生物公司(货号分别是C12A19、G219-1129、GM024 和EP51),阴性对照则用PBS 磷酸缓冲液替代一抗。所用二抗是DAKO EnVisionTM 二步法抗兔、鼠通用型免疫组化试剂。将显色后的片子用清水冲洗一段时间后,浸泡于苏木素中染色30 s完成细胞核复染。最后脱水后,完成封片。
1.4 结果判定 染色强度:无着色为0分,淡黄色为1 分,棕黄色为2 分,棕褐色为3 分,深褐色为4 分。阳性范围:随机观察5 个中倍视野(10×20),每个视野计数100 个肿瘤细胞,将各个视野中阳性细胞数的平均百分比作为该切片的阳性细胞百分比;0 为0 分,<1%为1 分,1%~10%为2 分,11%~33%为3 分,34%~66%为4 分,>66%为5 分。上述两项结果相乘,0~5 分定义为该基因低表达,6~12 分定义为该基因高表达。判定过程由2 名以上具有认证资质的病理科医生通过双盲法独立进行,有异议的病例则提交上级医师进行重新判读。
1.5 统计方法 数据利用SPSS 15.0 软件及GraphPad Prism 5.0 软件分析,所有数据均用方差同质性检验。计数资料采用2检验或Fisher 精确检验。P <0.05为差异具有统计学意义。
2 结果
2.1 PD-L1及CTLA-4表达与肝癌临床病理特征的关系 84 例标本中,PD-L1高表达33 例,低表达51 例;CTLA-4 高表达15 例,CTLA-4 低表达69 例。PDL1 高表达组肝硬化阳性例数、ALT≤40 U/L 例数占比均高于PD-L1 低表达组(均P <0.05)。PD-L1 表达水平与其余临床病理特征差异均无统计学意义(均P >0.05)。CTLA-4 表达水平在不同的临床病理特征中的差异均无统计学意义(均P >0.05),见表1。
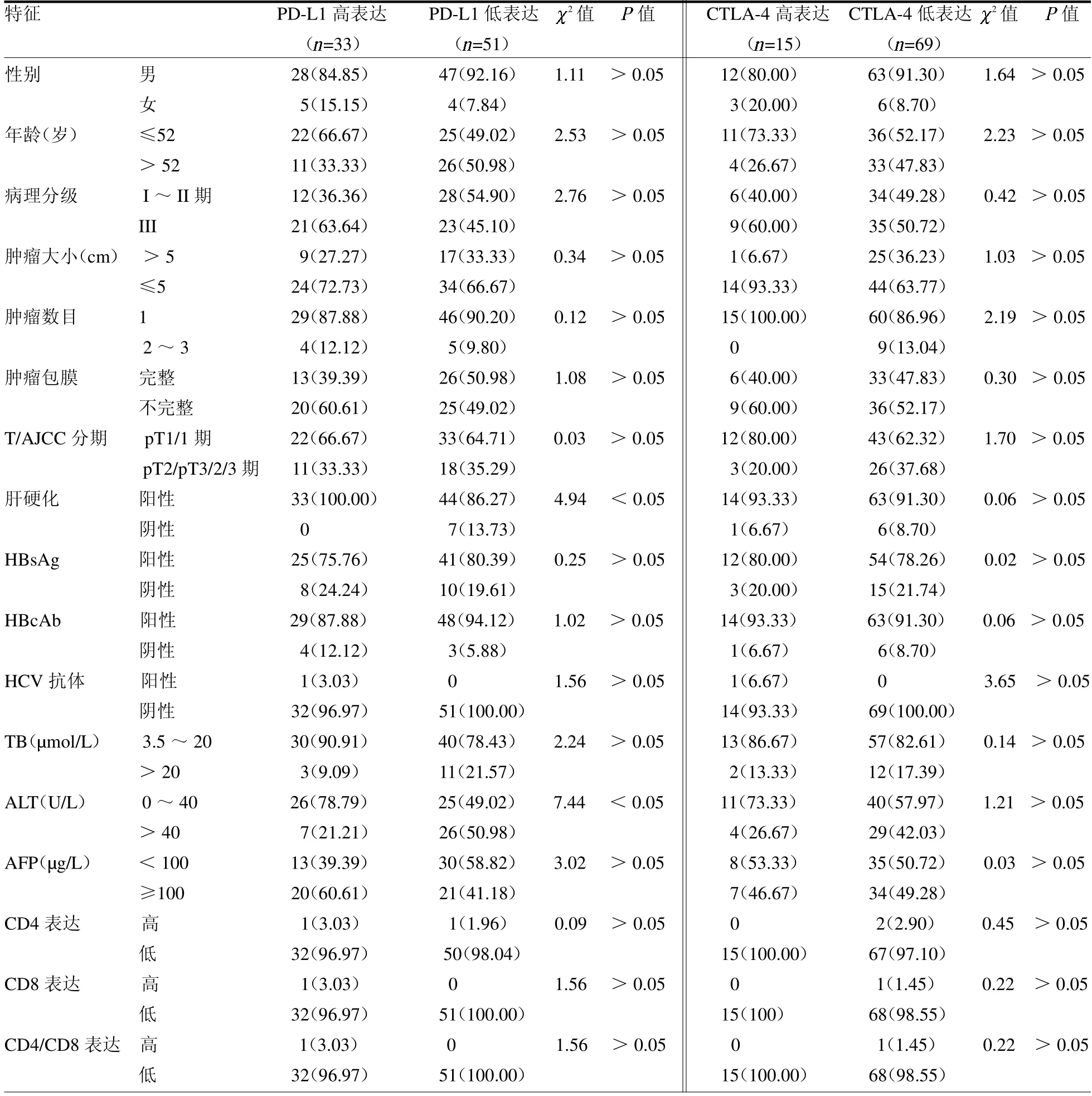
表1 肝癌临床病理特征与PD-L1、CTLA-4 分子表达的关系 例(%)
2.2 CD276 表达与肝细胞癌临床病理特征的关系 84 例标本中,CD276 高表达40 例,CD276 低表达44 例。两组AFP<100 g/L例数占比差异有统计学意义(P <0.05),其他肝癌临床病理特征差异均无统计学意义(P >0.05),见表2。

表2 肝癌临床病理特征与CD276 分子表达的关系 例(%)
3 讨论
近年来,癌症免疫治疗成为研究热点,特别是免疫卡控点抑制剂(ICIs)已经证明在肝癌中具有显著的抗肿瘤活性和可控制的耐受性。针对PD-1、PD-L1 和CTLA-4 的抗体可以阻断免疫卡控点[3],通过恢复耗竭T 细胞以增强肿瘤免疫力。目前,联合使用ICIs、分子靶向药物,全身治疗或局部治疗的联合治疗策略已在多种类型癌症的临床前和临床研究中充分证实有效,但大多数肝癌患者并未从中受益。本研究将 PD-L1、CTLA-4 和CD276 联合作为研究对象,研究其在肝癌组织中的表达水平,以期为肝癌免疫联合治疗方案提供依据。
研究表明,T细胞活化与增殖依赖于双信号:一是抗原递呈细胞(APC)递呈的抗原肽-人类白细胞抗原(HLA)复合物,由特殊T 细胞抗原受体(TCR 识别),并将信号传递给T 细胞,这是T 细胞活化必需的,但不引起T 细胞增殖和分泌细胞因子;二是共刺激信号(co-stimulatingsignal,第二信号),共刺激信号是T 细胞抗原特异性激活必需的,启动、维持并调节活化级联反应,决定了T 细胞是活化增殖,或转变为无反应状态甚至凋亡。
B7 家族是最重要的共刺激分子,是一类属于IgSF 具有高度同源性的基因,为跨膜蛋白,基本成员有B7-1、B7-2、B7-H1、B7-H2 和B7-H3 等。B7 家族成员表达后形成单链糖蛋白,大都存在于细胞壁上,分布于人体绝大部位的抗原递呈细胞,在肿瘤免疫中作为第二信号,起着至关重要的作用。B7H1 与活化T 细胞表面表达的PD-1 结合后,抑制T-TCR 介导的T细胞活化[4],导致活化T细胞的凋亡,在协助肿瘤细胞逃避免疫系统杀伤中起着极其重要作用[5]。B7H3 是316 个氨基酸组成的I 型跨膜糖蛋白,最初是通过对人树突状细胞来源的cDNA 库进行核酸序列分析得到的B7 家族同源基因,属于免疫球蛋白超家族。PD-L1 和CD276 分别是B7H1 和B7H3 家族中最重要的两个成员之一[6],在不同癌症中均高表达。
CTLA-4 又名CD152,是一种白细胞分化抗原,是T 细胞上的一种跨膜受体[7],与CD28 共同享有B7 分子配体,而CTLA-4 与B7 分子结合后诱导T 细胞无反应性,参与免疫反应的负调节。基因重组的CTLA-4 Ig 可在体内外有效、特异地抑制细胞和体液免疫反应,对移植排斥反应及各种自身免疫性疾病有显著的治疗作用,毒副反应极低,是目前被认为较有希望的新的免疫抑制药物。本研究结果显示,在肝癌组织中,PD-L1 表达水平与肝硬化阳性率及ALT 表达水平有关,CD276 表达水平与患者血清中AFP 含量有关。这表明PD-L1 及CD276与肝癌发生发展密切相关,为潜在的肝细胞癌免疫治疗的实验室指标。
