外周血内皮祖细胞对脓毒性休克患者早期预后的评估价值
2022-05-29潘振涛陈晓丹周银超杨磊袁园黄巧娟王俊聪叶恭杰
潘振涛,陈晓丹,周银超,杨磊,袁园,黄巧娟,王俊聪,叶恭杰
脓毒性休克,也称感染性休克,是指脓毒症患者给予足量的液体复苏后仍伴有无法纠正的持续性低血压,且乳酸>2mmol/L,其致死率高达30%~50%[1-2]。脓毒性休克常引起内皮细胞凋亡或坏死,加重病情的发展[3]。血管内皮受损可通过成熟内皮细胞的迁移和增殖来修复,但成熟内皮细胞的增殖分化能力有限,而内皮祖细胞(EPCs)具有定向分化成为成熟内皮细胞的能力,并可参与血管新生和损伤后的血管内皮修复,增加局部缺血组织血流[4]。足够数量和功能完善的EPCs 对增加局部缺血组织血流起着重要作用[5]。但目前脓毒性休克患者外周血EPCs 的数量并无系统化的研究。基于此,本研究检测脓毒性休克患者外周血EPCs 相对数量,探讨EPCs 对脓毒性休克患者早期预后的评估价值,报道如下。
1 资料与方法
1.1 一般资料 选择2018 年12 月至2021 年6 月入住宁波市医疗中心李惠利医院重症监护室(ICU)的脓毒性休克患者91 例,设为研究组。纳入标准:(1)符合脓毒性休克的诊断标准[6];(2)24 h 内入住ICU;(3)年龄≥16 周岁。排除标准:(1)入住ICU48h内死亡或自动出院;(2)合并严重心源性或失血性休克,合并免疫缺陷或自身免疫性疾病,长期服用他汀类药物、血管紧张素转化酶抑制剂(ACEI)或血管紧张素Ⅱ受体阻滞剂(ARB)类药物,长期应用免疫抑制药物、激素类药物者;(3)病历资料不完整,数据缺失者;(4)供体;(5)其他各种原因不适合入组的脓毒性休克患者;(6)患者或家属拒绝接受本研究。根据28 d 预后分为死亡组(34 例)和存活组(57 例)。另选45 例同期体检中心随机选取的健康志愿者设为对照组,均年龄≥16 周岁并同意接受本研究。
本研究方案符合医学伦理学标准,经宁波市医疗中心李惠利医院伦理委员会批准(审批号:KY2019PJ044),并获参与者或其家属的知情同意。
1.2 研究方法 分离研究对象外周血单个核细胞层,流式细胞仪检测外周血EPCs 的相对数量。同时记录研究对象的基本资料、临床和预后指标。
1.3 观察指标(1)基本资料:包括年龄、性别、感染原因、受教育程度、体质量指数(BMI)及急性生理与慢性健康评分(APACHE Ⅱ)评分等;(2)临床指标:记录研究组入科第1、3 和7 天内的体温、C-反应蛋白(CRP)、前降钙素(PCT)、血白细胞(WBC)、白介素-6(IL-6)和白介素-10(IL-10)等指标;(3)预后指标:机械通气时间、入住ICU 时间等指标。
1.4 统计方法 采用SPSS 25.0 统计软件进行分析。正态分布计量资料采用均数±标准差表示,两组比较采用t 检验,多组比较采用方差分析;非正态分布计量资料采用中位数(四分位数)表示,两组比较采用非参数秩和检验;计数资料比较采用检验;等级资料比较采用非参数秩和检验;危险因素分析采用二元Logistic回归分析;检验效能分析采用受试者工作特征曲线(ROC)。P <0.05 为差异有统计学意义。
2 结果
2.1 3 组基本资料及EPCs 相对数量比较 3 组年龄、性别、BMI 和受教育程度差异均无统计学意义(均P>0.05);死亡组EPCs相对数量低于对照组和存活组(均P <0.05),存活组与对照组EPCs 相对数量差异无统计学意义(P>0.05),见表1和封二彩图1。
2.2 存活组和死亡组感染原因、APACHE-Ⅱ评分、临床及预后指标比较 存活组和死亡组感染原因、机械通气时间和入住ICU时间差异均无统计学意义(均P >0.05),死亡组APACHE Ⅱ评分高于存活组(P <0.05),见表2。
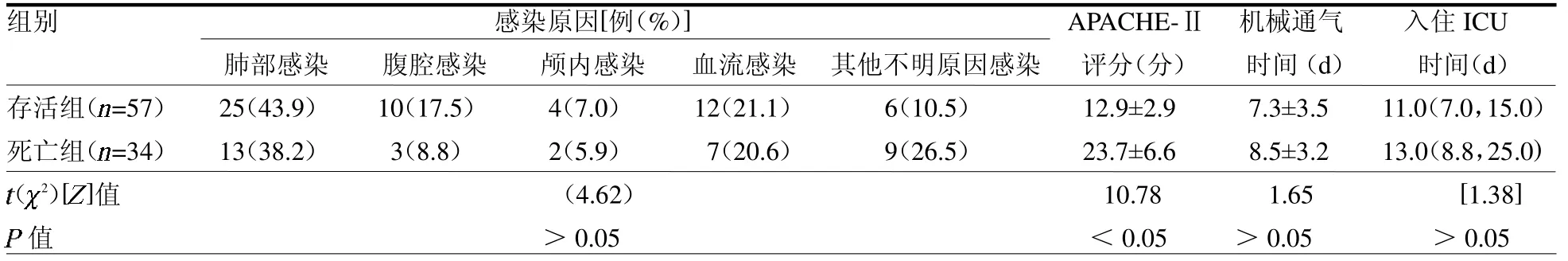
表2 存活组和死亡组感染原因、APACHE-Ⅱ评分及预后指标比较
入科第1、3 和7 天,存活组和死亡组体温、CRP、WBC 和IL-10 差异均无统计学意义(均P >0.05);死亡组入科第1 天IL-6 高于存活组(均P <0.05),入科第1、3 和7 天PCT 高于存活组(均P <0.05),见表3。
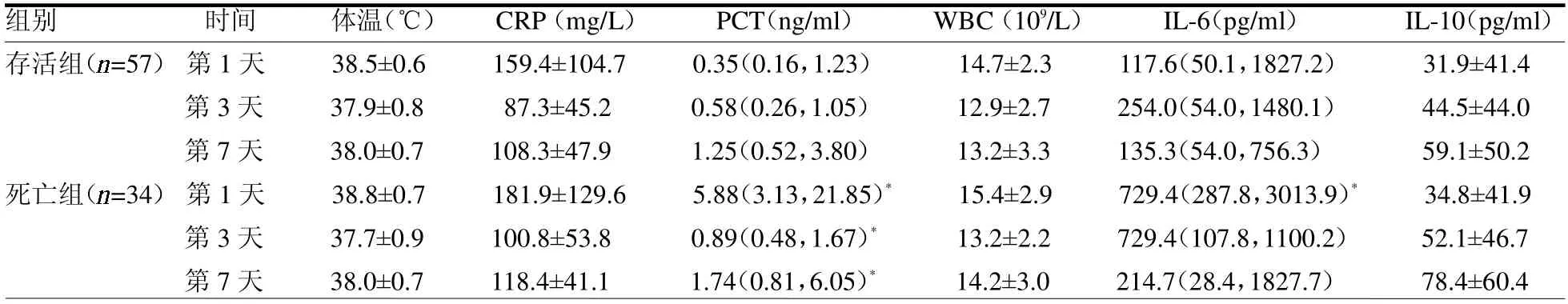
表3 存活组和死亡组临床指标比较
2.3 影响预后的危险因素分析 将单因素分析中差异有统计学意义的指标进行二元Logistic 回归分析,结果显示EPCs 相对数量和APACHE Ⅱ评分是脓毒性休克患者死亡的独立危险因素(均P <0.05),见表4。
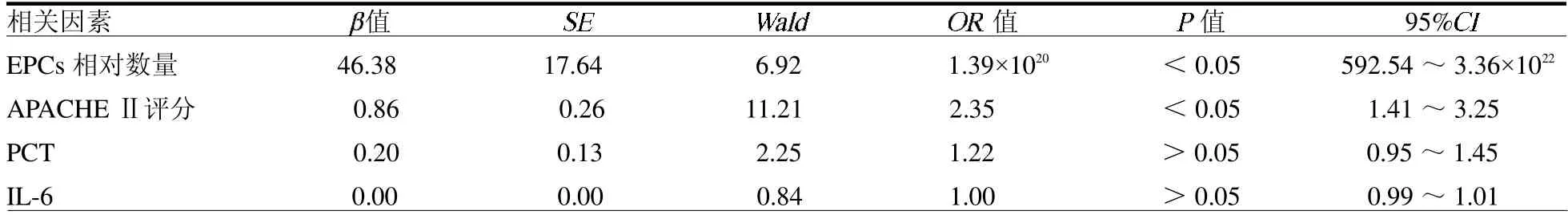
表4 影响脓毒性休克患者预后独立危险因素的二元Logistic 回归分析
2.4 外周血EPCs 相对数量预测脓毒性休克患者死亡的价值 ROC曲线分析发现,EPCs相对数量约登指数为0.508,具有中等预测价值,预测脓毒性休克患者死亡的曲线下面积(AUC)为0.79(95%CI=0.68~0.89),最佳临界值为0.108%时,敏感性77.2%,特异性73.5%,见图1。
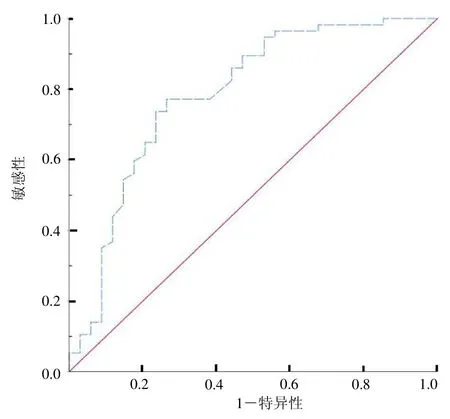
图1 EPCs 相对数量预测脓毒性休克患者死亡的ROC 曲线
3 讨论
脓毒性休克是ICU 患者死亡的主要原因之一,对于脓毒性休克的认知和研究,是ICU 医生永恒的话题。对于脓毒性休克的研究正在由稳定大循环向改善微循环转换[7]。EPCs 可参与血管新生和损伤后的血管内皮修复,增加局部缺血组织血流,进而改善微循环[8]。EPCs 不仅本身可以直接分化为成熟的内皮细胞,而且可以动员内皮细胞聚集在缺血组织中,起到快速血管重建、改善微循环的作用,所以EPCs在缓解组织缺血缺氧中起到至关重要的作用[9]。目前EPCs 主要依靠细胞表面标记来识别,一般将CD34+/ CD133+/ VEGFR-2+的细胞定义为EPCs[10]。有关脓毒性休克时,患者外周血EPCs相对数量变化的研究报道较少,且存在相当大的争议:部分学者揭示外周血EPCs 减少[9],部分则提示数量增加[11]。
本研究发现脓毒性休克死亡组EPCs 相对数量低于对照组和存活组,存活组和对照组差异无统计学意义。这与童朝阳[9]和Kung 等[12]的研究结果相一致。脓毒性休克患者外周血中EPCs 相对数量减少的机制目前尚不明确,主要的观点认为与炎症介质和多器官功能障碍综合征(MODS)有关。脓毒性休克患者病情加重会释放过量的炎症和抗炎症介质,引起MODS,抑制EPCs 的生成[13];而EPCs 的生成以及数量的减少,将导致患者血管内皮的结构无法修复,内皮屏障功能受损,进一步加重休克,导致患者微循环衰竭,加重MODS,最终引起患者死亡[14]。
同时本研究还发现,存活组和死亡组机械通气时间和入住ICU时间差异无统计学意义,与存活组相比,死亡组患者APACHE Ⅱ评分更高。在入科第1、3 和7 天,存活组和死亡组体温、CRP、WBC 和IL-10差异无统计学意义;死亡组入科第1 天PCT 和IL-6高于存活组,死亡组入科第3 和7 天PCT 高于存活组。二元Logistic 回归分析显示,EPCs 相对数量和APACHE Ⅱ评分是脓毒性休克患者死亡的独立危险因素。ROC 曲线分析发现,EPCs 相对数量约登指数为0.508,具有中等预测价值。APACHE Ⅱ评分是目前ICU评估预后较优的指标之一[15],但其包括的内容太多,不能反应疾病的本质,且APACHEⅡ评分一般需要入院24 h 甚至48 h 才能准确监测,无法对脓毒性休克患者进行早期预后评估。本研究未发现其他常见的临床指标(如体温、CRP、PCT、WBC、IL-6 和IL-10)对脓毒性休克预后具有良好的预测价值。
综上所述,外周血EPCs相对数量对脓毒性休克患者早期预后具有较好的评估价值。本研究为单一中心,样本量偏少,可能对实验结果有影响。笔者后期将对EPCs的细胞功能(增值、迁移和分化)进行检测,进一步探讨其可能的机制。
