基于坏死性凋亡相关基因的生物信息学分析构建喉癌复发风险预测模型
2022-05-29叶爽王丹陈雪章慧刘开泰周重昌叶栋
叶爽,王丹,陈雪,章慧,刘开泰,周重昌,叶栋
喉癌是全球最常见的头颈部恶性肿瘤之一,其发病率和死亡率均较高[1]。喉癌治疗失败的主要原因是局部复发,术后复发患者预后较差,构建喉癌复发风险预测模型尤为重要[2-3]。细胞凋亡又称细胞程序性死亡,是基因介导的细胞自主且有序的死亡。坏死性凋亡是最新提出的一种新型的细胞程序性死亡,在经典凋亡途径受抑时其以替补方式被激活[4]。研究证实,多种肿瘤发生发展与坏死性凋亡途径相关,包括黑色素瘤[5],结肠癌[6]等。坏死性凋亡的触发在结肠癌和血液系统肿瘤治疗中有一定效果[7]。本研究通过癌症基因组图谱(TCGA)数据库获得喉癌患者坏死性凋亡相关基因的表达谱数据,建立复发风险预测模型,来评估坏死性凋亡基因组成的复发风险预测模型对喉癌患者复发风险的预测价值。报道如下。
1 资料与方法
1.1 数据收集与处理 利用TCGA 数据库(https://portal.gdc.cancer.gov )下载111 例喉癌样本的RNA-seq数据及患者的临床信息。利用基因表达综合数据库(GEO)(https://www.ncbi.nlm.nih.gov/geo)下载GSE27020 数据集109 例喉癌样本的基因表达谱数据。研究入组病理确诊为喉癌的患者,排除没有完整临床资料的患者。TCGA 队列为训练集,GEO 队列为验证集。
1.2 坏死性凋亡基因差异表达分析通过检索与阅读文献,筛选获得67 个坏死性凋亡相关基因,使用“limma”软件包筛选喉癌组织和正常组织之间差异表达的坏死性凋亡基因用于下一步分析。
1.3 单因素Cox 回归分析及LASSO 回归分析 利用“survival”包对差异表达的坏死性凋亡基因进行单因素Cox 回归分析,筛选出与喉癌复发相关的坏死性凋亡基因。利用“glmnet”软件包对复发相关的坏死性凋亡基因进行LASSO 回归分析。采用10 倍交叉验证来确定模型中 值,最优 值为选择偏似然偏差最小 值。确定关键基因后构建预测模型并计算风险评分。风险评分=0.3232×FADD的表达水平+(- 0.4492)×ZBP1 的表达水平+(-0.4454)×TRAF2的表达水平+(-0.3687)×STUB1 的表达水平+0.4924×IDH1的表达水平+0.5242×APP 的表达水平。计算喉癌复发患者风险评分,利用风险评分中位数值分为高风险组和低风险组,建立喉癌复发风险预测模型。
1.4 复发风险预测模型评价和Kaplan-Meier(K-M)生存分析 利用“survival”软件包对低风险组和高风险组行无复发生存(RFS)的K-M 生存分析。利用“survival ROC”软件包建立喉癌患者1 年、3年和5年RFS的ROC曲线,并计算AUC值以评估其复发风险预测效果,当AUC值>0.7 时,说明预测模型的准确率优良。结合患者临床信息,对该模型进行多因素Cox 回归分析,评估该模型在预测喉癌复发方面的独立作用。
1.5 统计方法 数据使用R软件(4.0.3)进行统计学分析并绘制图像。采用t 检验或2检验。P<0.05为差异有统计学意义。
2 结果
2.1 基本情况 汇总符合纳入标准的TCGA 数据库中111 例喉癌患者临床基线资料,其中男91例,女20例;年龄≤60岁47 例,>60 岁64 例;病理分化程度为1 期8 例,2~3 期99 例,未知4 例;T 分期1~2 期19 例,3~4 期79 例,未知13 例;N 分期0 期39 例,1~3 期53 例,未知19 例;M 分期0 期40 例,1期9 例,未知62 例;临床分期I~II期13例,III~IV期85 例,未知13 例;死亡50例,生存61 例;复发42 例,未复发69 例。
2.2 与喉癌复发相关的坏死性凋亡基因的确定 结合患者相对应的临床信息,通过单因素Cox回归分析,初步筛选出6 个复发相关的坏死性凋亡基因,包括FADD、ZBP1、TRAF2、STUB1、IDH1和APP,见表1。其中FADD、IDH1 和APP为喉癌复发的危险因素,ZBP1、TRAF2和STUB1 是喉癌复发的保护因子。通过LASSO回归明确这6 个坏死性凋亡基因均是关键基因,见封三彩图1。
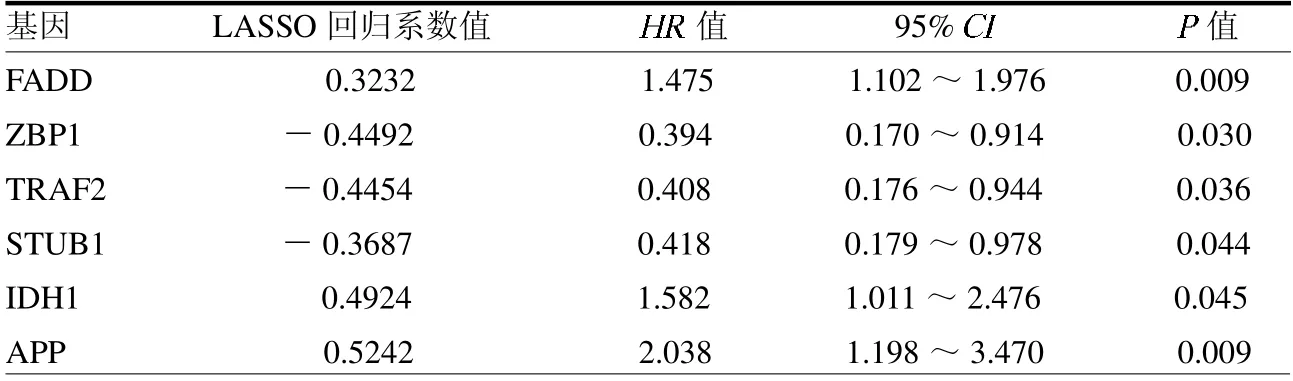
表1 6 个坏死性凋亡相关基因的详细信息
2.3 喉癌复发风险预测模型的构建和效果评价 K-M 无复发生存分析显示,低风险组患者无复发生存时间较高风险组长(P <0.00,封三彩图2a)。ROC 曲线显示(封三彩图2b),患者1 年、3 年和5 年无复发生存率的AUC 值分别为0.767、0.827 和0.765,表明该模型对喉癌复发风险的预测效果良好。在GEO验证集中验证了该模型预测喉癌复发的有效性,K-M生存分析显示,低风险组患者复发风险低(P=0.025,封三彩图2c)。患者1 年、3 年和5 年无复发生存率的AUC 值分别为0.631、0.664 和0.671(封三彩图2d)。多因素Cox 回归分析结果显示,该复发风险预测模型为独立的复发风险预测因子(HR=3.235,95%CI 1.777~5.888,P <0.01),见图1。
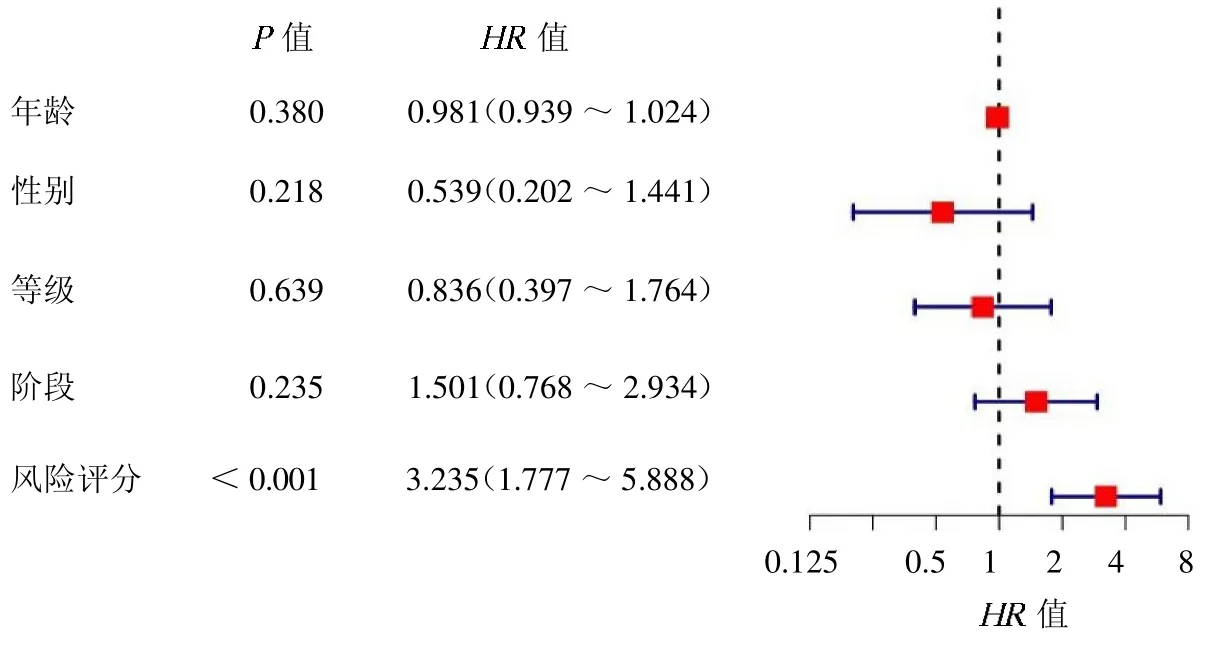
图1 多因素Cox 回归分析风险评分与无复发生存时间关系的森林图
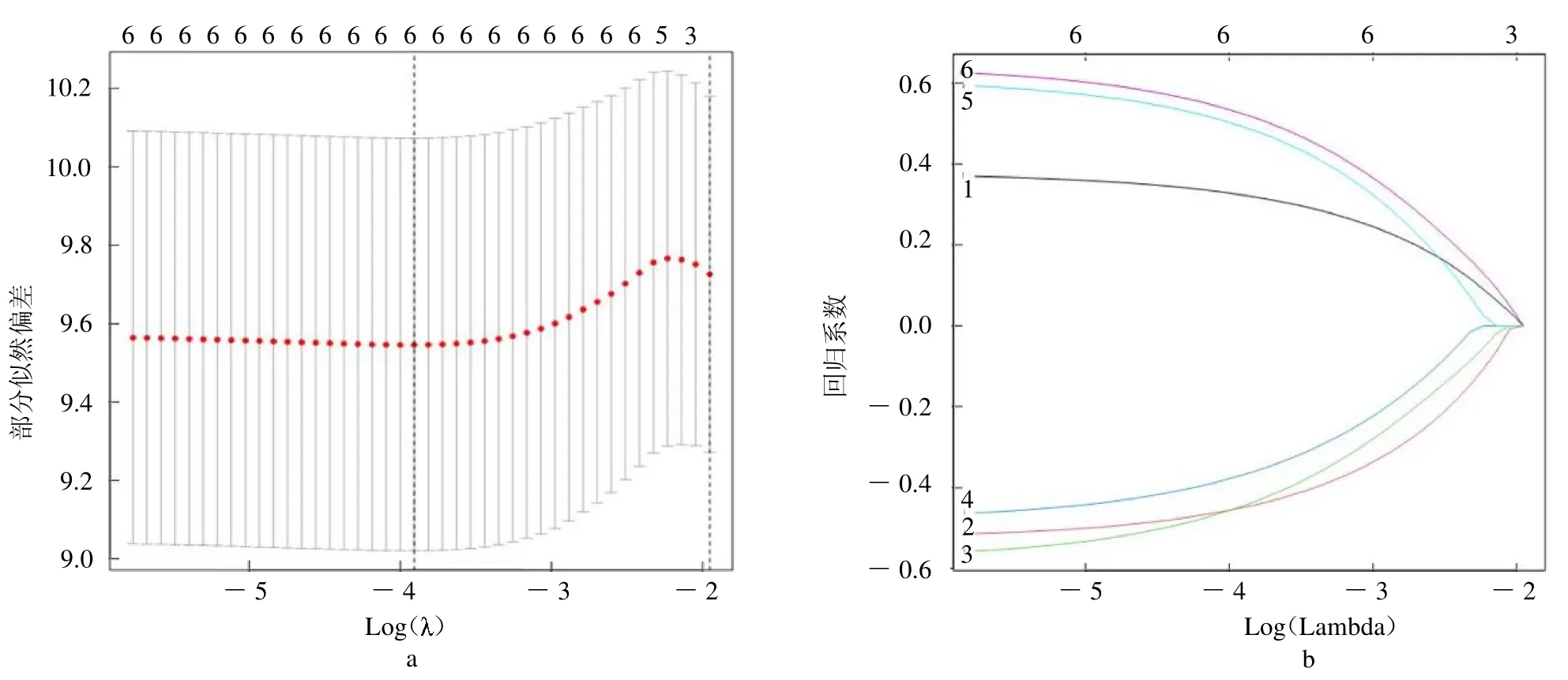
图1 基因LASSO Cox 回归模型
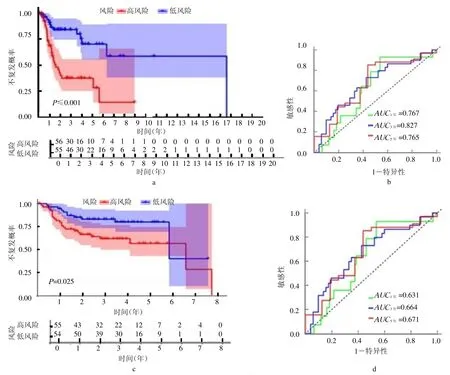
图2 喉癌复发风险预测模型
3 讨论
治疗后复发是喉癌患者术后最常见的死亡原因之一[2]。但对于喉癌复发患者,目前仍缺乏可靠的预测模型,本研究构建并验证一种基于坏死性凋亡基因的喉癌复发风险预测模型,高风险评分患者复发风险较高,ROC曲线证实了该模型在喉癌复发风险预测方面的良好效果。因此,对于高风险评分患者应该采取更彻底的治疗。
细胞凋亡是生物体内常见的一种细胞死亡方式。Degterev 等[4]首次报道一种新型细胞死亡模式,既坏死性凋亡。研究认为肿瘤细胞对经典细胞凋亡途径具有抗性时可能对坏死性凋亡途径敏感[7]。本研究构建并验证了基于坏死性凋亡基因的喉癌复发风险预测模型,该模型由坏死性凋亡相关基因FADD、ZBP1、TRAF2、STUB1、IDH1 和APP 组成。FADD基因拷贝数变异和蛋白表达是口腔鳞状细胞癌潜在的预后标志物,FADD拷贝数扩增和蛋白表达高的患者无病生存时间最短[8]。FADD 基因高表达喉癌患者的死亡率较高,预后较差[9]。在乳腺癌脑转移患者中,ZBP1高表达患者预后好于低表达患者[10]。抑制ZBP1的表达导致转移性乳腺癌细胞增殖和迁移的增加[11]。上述结果表明ZBP1 是乳腺癌的保护因子,但ZBP1 在喉癌中作用尚不明确。
研究表明,STUB1 在口腔癌组织中的表达被异常抑制,其低表达与口腔癌患者较差的无复发生存相关[12]。关于IDH1/2 突变的研究多集中在脑胶质瘤等中枢神经系统肿瘤,目前有关于IDH1在喉癌中作用的研究较少。研究表明,包括APP 在内的80 个基因被鉴定为预测喉癌复发的生物标志物[13],但目前仍缺乏直接证据表明APP 在喉癌中的作用。目前涉及上述6 个坏死性凋亡基因在喉癌复发中预测作用尚未被发现。
综上所述,笔者构建并验证了一种坏死性凋亡基因相关的喉癌复发风险预测模型,高危险评分患者的复发风险高于低危险评分患者,但需更多的临床研究来验证这一模型在预测喉癌复发风险中的作用。
