副溶血弧菌外膜铁蛋白受体pvuA基因的原核表达及产物的诱导条件优化
2022-05-28刘蕾周欣悦朱桢曹烨王文彬
刘蕾, 周欣悦, 朱桢, 曹烨, 王文彬*
1.江苏省海洋生物产业技术协同创新中心, 江苏 连云港222005;2.江苏省海洋生物资源与环境重点实验室, 江苏 连云港222005;3.江苏海洋大学食品科学与工程学院, 江苏 连云港222005
副溶血性弧菌(Vibrio parahemolyticus)属于弧菌科弧菌属[1],是一种广泛分布在海水及海产品中的耐盐性革兰氏阴性菌[2]。副溶血性弧菌可引起人体出现呕吐、眩晕等反应,严重时可致死,是危害公众健康的主要致病菌之一,近年来其引起的食物中毒案例占比不断上升[3-9]。副溶血性弧菌等引起的弧菌病也给水产养殖业造成了巨大的经济损失,目前主要采用抗生素和化学药品进行防治,但长期使用或不合理用药会导致鱼类等水产品药物残留,进而威胁人体健康[10],也降低了水产养殖动物本身的免疫能力,不利于水产养殖业的发展[11]。因此,寻求更加安全有效的方法抑制副溶血性弧菌等致病菌的方法已成为水产养殖业及食品行业的研究重点,同时对鱼类副溶血性弧菌的抗原微生物检测具有重要意义。
外膜蛋白是革兰氏阴性菌的一种重要的表面抗原,具有维持细胞结构及生命活动的作用[12],也是细菌与外界环境相互作用的靶点[13],其暴露的抗原决定簇致使外膜蛋白极易被宿主的免疫系统识别,能够引起宿主的体液免疫和细胞免疫。通过外膜蛋白诱导产生的免疫对副溶血性弧菌及其他致病菌的血清具有交叉保护作用,是一种很有潜力的保护抗原,如OmpK、OmpU、OmpW、OmpA等[14]。弧菌铁蛋白受体pvuA 是外膜蛋白的一种,作为摄取环境中Fe3+的弧菌铁蛋白表面受体具有重要的生理功能,该蛋白与弧菌属中的解藻酸弧菌(V. alginolyticus)、霍乱弧菌(V. fluvialis)、溶藻弧菌(V. alginolyticus)、哈维氏弧菌(V. harvey)、杀岩龙虾弧菌(V.jasicida)、需钠弧菌(V.natriegens)、灿烂弧菌(V. splendidus)的部分菌株具有相似性(80%~98%),与弧菌属外的气单胞菌、太平洋肠弧菌部分菌株有相似性(75%~93%),与其他细菌同源性较低。已有报道表明,副溶血性弧菌的psuA 和pvuA 的重组蛋白混合免疫大黄鱼4 周后,活菌攻毒后的免疫保护率为80%,有望作为高效疫苗抗原[15]。梁夏夏等[16]利用弧菌铁蛋白受体通过酶联免疫吸附反应(enzyme-linked immunosorbent assay,ELISA)和免疫印迹研究了小鼠多抗与不同副溶血性弧菌、其他弧菌等菌株的交叉反应,结果表明,重组弧菌铁蛋白受体以包涵体形式表达,且小鼠多抗与免疫重组蛋白的效价较好。周清等[17]研究表明副溶血性弧菌胁迫下的铁蛋白在先天性免疫中具有很好的防御作用。目前国内对副溶血性弧菌的外膜蛋白的免疫原性报道较多,但关于弧菌铁蛋白方面研究较少。
本研究从副溶血弧菌基因组DNA 扩增了弧菌铁蛋白受体pvuA基因,构建了重组质粒pET-28a(+)-ferric vibrioferrin receptor,转入大肠杆菌BL21 并经异丙基硫代半乳糖苷(isopropyl β-Dthiogalactoside,IPTG)诱导表达蛋白,但大肠杆菌中的蛋白表达产量不多。本研究采用响应面分析法(response surface,RSA),在单因素的基础上,以菌体初始浓度、诱导时间、诱导温度、诱导剂浓度为自变量,菌体蛋白浓度为响应值,根据响应面法的Box-Benhnken 中心设计原理,研究自变量及其交互作用对弧菌铁蛋白产量的影响,并利用Design-Expert 和响应面分析相结合的方法对诱导条件进行优化,以期提高其在大肠杆菌中的表达产量。
1 材料与方法
1.1 材料
限制性内切酶XhoⅠ、NcoⅠ、DNA Marker、胶回收试剂盒、质粒抽提试剂盒、IPTG、卡那霉素、双色预染蛋白Marker 及SDS-PAGE 凝胶电泳所需试剂均购自生工生物工程(上海)股份有限公司;牛血清蛋白(bovine serum albumin,BSA)购自Sigma 公司;原核表达载体pET-28a(+)、大肠杆菌DH5α、BL21(DE3)为本实验室保存;副溶血弧菌(CICC 21617)购自中国工业微生物菌种保藏管理中心;其他化学试剂均购自上海国药化学试剂有限公司。
1.2 方法
1.2.1 副溶血弧菌铁蛋白受体基因的克隆 根据
NCBI 中弧菌铁蛋白受体(GenBank:28901511)的基因序列,插入限制性酶切位点XhoⅠ、NcoⅠ后,使用软件Primer Premier 5.0 设计引物。将副溶血弧菌CICC21617 培养至对数期,CTAB 法提取基因组DNA作为模板。弧菌铁蛋白受体pvuA上游引物(5'→3'):5'-CCCATGGATGTCTTACCAGAATTTG-3';下游引物(5'→3'):5'-CCGCTCGAGAAACTGATAGTTCAGATC-3'。PCR 反应程序均为:95 ℃5 min;95 ℃45 s,53 ℃45 s,72 ℃60 s,30个循环;72 ℃10 min。PCR 产物经1%琼脂糖凝胶电泳验证后切胶回收。
1.2.2 重组质粒的构建及阳性克隆筛选 目的基因和pET-28a(+)质粒经双酶切后,通过T4连接酶连接得到重组质粒pET-28a(+)-ferric vibrioferrin receptor。将重组质粒转入E. coliDH5α 感受态,在平板上挑取6 个单菌落做PCR 验证,抽提重组质粒并由生工生物工程(上海)股份有限公司,将测序验证后的重组质粒转化到表达宿主E. coliBL21(DE3),制作甘油菌保藏于−80 ℃。
1.2.3 弧菌铁蛋白受体诱导表达条件优化 为提高重组蛋白的产量,对IPTG 浓度、菌株起始浓度、诱导温度、诱导时间进行优化。将添加诱导剂的终浓度设计为0.2、0.5、0.8、1.0 mmol·L−1,37 ℃摇床震荡培养至对数期OD600=0.6 时,诱导时间为12 h;菌株起始浓度设计为OD600为0.4、0.6、0.8,诱导剂的浓度为1.0 mmol·L−1,诱导温度为37 ℃,诱导12 h;诱导温度设计为16、28、37、42 ℃,菌株起始浓度OD600=0.6 时,加入IPTG 浓度为1.0 mmol·L−1;诱导时间设计为8、10、12、14 h,菌株起始浓度OD600=0.6 时,加入IPTG 浓度为1.0 mmol·L−1,诱导温度为37 ℃。对收集的菌体进行离心、超声破碎、离心,收集上清和沉淀进行SDS-PAGE电泳表征,分析蛋白表达情况。
1.2.4 弧菌铁蛋白受体诱导表达条件响应面设计弧菌铁蛋白受体pvuA 诱导条件的优化采用响应面分析方法。综合单因素试验结果,根据Box-Benhnken 中心设计原理,采用4 因素3 水平进行设计,各个因素根据单因素试验结果设定中心点和高、低水平,试验因素水平及编码见表1。
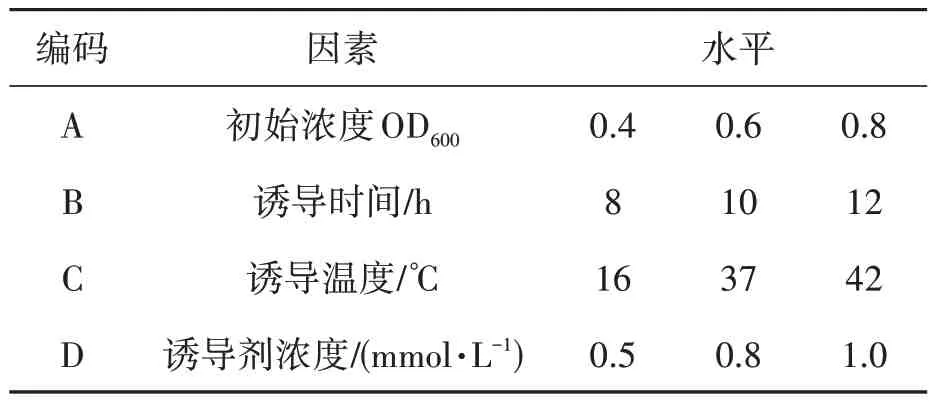
表1 RSA设计中定量因子的水平及编码Table 1 Levels and code of RSA test factors
1.2.5 弧菌铁蛋白受体的表达与纯化 将阳性克隆菌种子液按1%比例接种于50 mL含100 μg·mL−1卡那霉素的LB 液体培养基中,37 ℃摇床震荡培养至对数期(OD600为0.6~0.8),向菌液中加入IPTG 至终浓度为1.0 mmol·L−1,37 ℃、180 r·min−1摇床震荡过夜。离心后收集菌体,用5 mL 10 mmol·L−1PBS 重悬后,冰浴超声破碎(400 W,30 min)后,离心并收集上清和沉淀,用2 mL PBS将沉淀重悬,用SDS-PAGE 检测重组蛋白的表达情况。将蛋白包涵体用8 mol·L−1尿素变性后进行镍柱亲和层析纯化,将纯化蛋白进行尿素梯度透析复性,用Millipore 超滤管(截断分子量:10 kD)浓缩样品,Bradford法定量后−20 ℃冷冻贮存。
2 结果与分析
2.1 目的基因的PCR 扩增与阳性重组质粒的筛选
如图1 所示,PCR 扩增出来的产物DNA 分子量大小约为2 000 bp,与NCBI 副溶血性弧菌外膜蛋白弧菌铁蛋白受体(2 139 bp)的分子量大小相似。将目的基因双酶切、连接及转化后,构建到质粒pET-28a 上,重组质粒即为pET-28a(+)-ferric vibrioferrin receptor。重组质粒进行PCR 验证,验证结果如图2 所示,pET-28a(+)-ferric vibrioferrin receptor 平板上挑取的1、3、4、5 号单菌落可以扩增出弧菌铁蛋白受体基因大小相似的条带,将以上菌落提取质粒并送至生工生物工程(上海)股份有限公司进行双向测序验证,测序结果显示送检质粒的核苷酸序列与NCBI 公布的核苷酸序列相似性均在98.5% 以上,证明重组质粒构建成功。
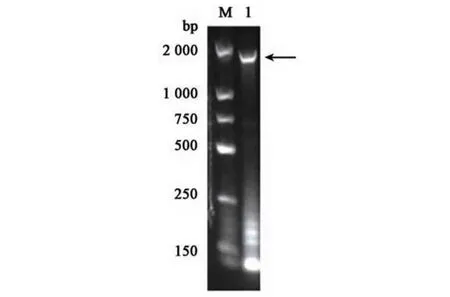
图1 弧菌铁蛋白受体pvuA基因PCR产物Fig.1 PCR product of ferricvibrioferrin receptorpvuAgene
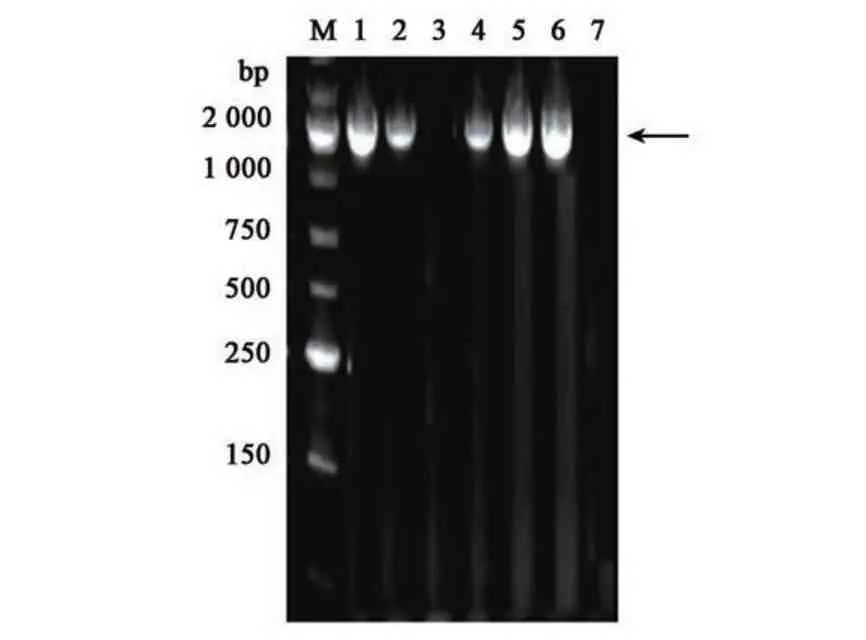
图2 弧菌铁蛋白受体重组质粒PCR验证Fig.2 PCR verification of ferric vibrioferrin receptor recombinant plasmid
2.2 重组蛋白的表达
将重组质粒菌株经28 ℃、IPTG 浓度为1.0 mmol·L−1,诱 导12 h 后,5 000 r·min−1,离 心30 min,弃上清,加入PBS 缓冲液重悬后进行超声破碎,再次离心,上清和沉淀用10%的SDS-PAGE进行凝胶电泳分析。由图3 可知,重组质粒诱导菌体裂解物上清中未见目的条带,沉淀中目的条带显著,与外膜蛋白弧菌铁蛋白受体理论分子量78.75 kD 大小相近,说明蛋白均以包涵体形式表达。空白质粒诱导后菌体裂解物上清和沉淀中均未出现目的条带。
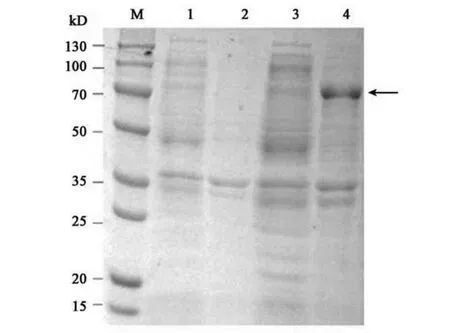
图3 重组蛋白诱导表达Fig.3 Expression induction of recombinant protein
2.3 重组外膜蛋白弧菌铁蛋白受体表达条件优化
2.3.1 IPTG 浓度的优化 将阳性重组菌株于液体培养基37 ℃摇床震荡培养至对数期OD600=0.6时,诱导时间为12 h 后,10%SDS-PAGE 电泳验证诱导结果。结果显示,诱导剂在0.2~1.0 mmol·L−1浓度区间内,重组弧菌铁蛋白受体蛋白的表达产物随着诱导剂的增加而增加,当IPTG 浓度为1.0 mmol·L−1时目的条带最宽,经蛋白浓度测定仪所测得的蛋白表达量最高,为8.58 mg·mL−1,因此1.0 mmol·L−1为最佳IPTG浓度(图4)。

图4 IPTG浓度优化Fig.4 Optimization of IPTG concentration
2.3.2 菌株起始浓度的优化 阳性重组菌株加入IPTG 诱导剂的浓度为1.0 mmol·L−1、诱导温度为37 ℃时,诱导12 h,对菌株起始菌液浓度进行优化。蛋白凝胶电泳结果显示为当OD600从0.4 增加到0.6,重组蛋白表达量随起始浓度的升高而升高,当OD600继续增加到0.8,重组蛋白表达量无明显变化,即OD600达到0.6时,重组蛋白的表达量较高,为8.92 mg·mL−1(图5)。
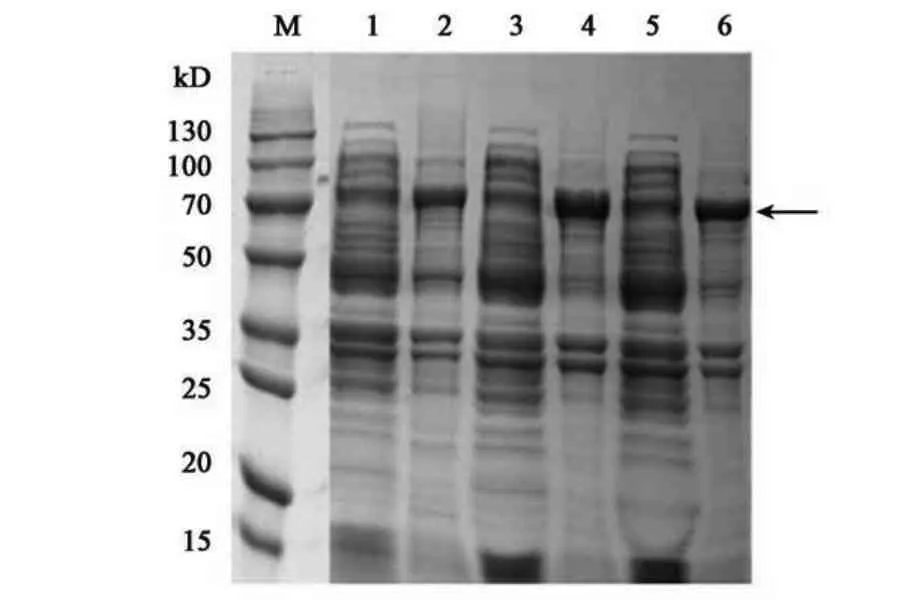
图5 起始菌液浓度优化Fig.5 Optimization of the initial bacterial concentration
2.3.3 诱导温度的优化 菌株起始浓度OD600为0.6,加入IPTG 浓度为1.0 mmol·L−1,诱导时间为12 h,对梯度诱导温度进行优化。实验结果显示,与诱导温度为16 ℃相比,诱导温度为28、37 ℃时,包涵体蛋白表达产量有一定增加,并且在37 ℃时表达量略高,为8.98 mg·mL−1。诱导温度42 ℃时,重组蛋白表达量略有降低。因此重组蛋白的最优诱导温度为37 ℃(图6)。
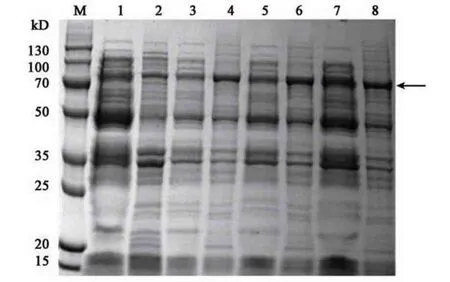
图6 诱导温度优化Fig.6 Optimization of induction temperature
2.3.4 诱导时间的优化 菌株起始浓度OD600为0.6,加入IPTG 浓度为1.0 mmol·L−1,诱导温度为37 ℃,对梯度诱导时间进行优化。蛋白凝胶电泳结果显示,诱导时间为8 h 时,重组蛋白表达产物较少;诱导时间10 h时,重组蛋白表达产量增加达到最大值,为10.58 mg·mL−1。诱导时间为12、14 h时,蛋白表达产量与10 h 时产量无统计学差异。因此,确定重组蛋白的最优诱导时间为10 h(图7)。
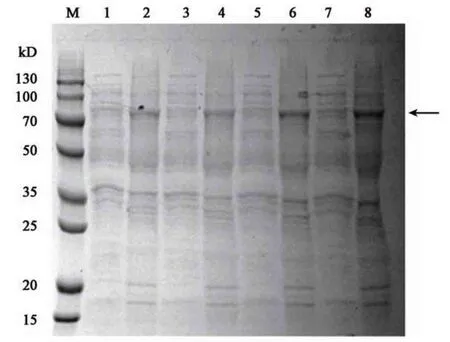
图7 诱导时间优化Fig.7 Optimization of induction time
2.4 响应面优化试验设计和结果
以初始浓度(A)、诱导时间(B)、诱导温度(C)、诱导剂浓度(D)为自变量,蛋白浓度(Y)为响应值,优化弧菌铁蛋白的诱导条件。试验设计及结果见表2。
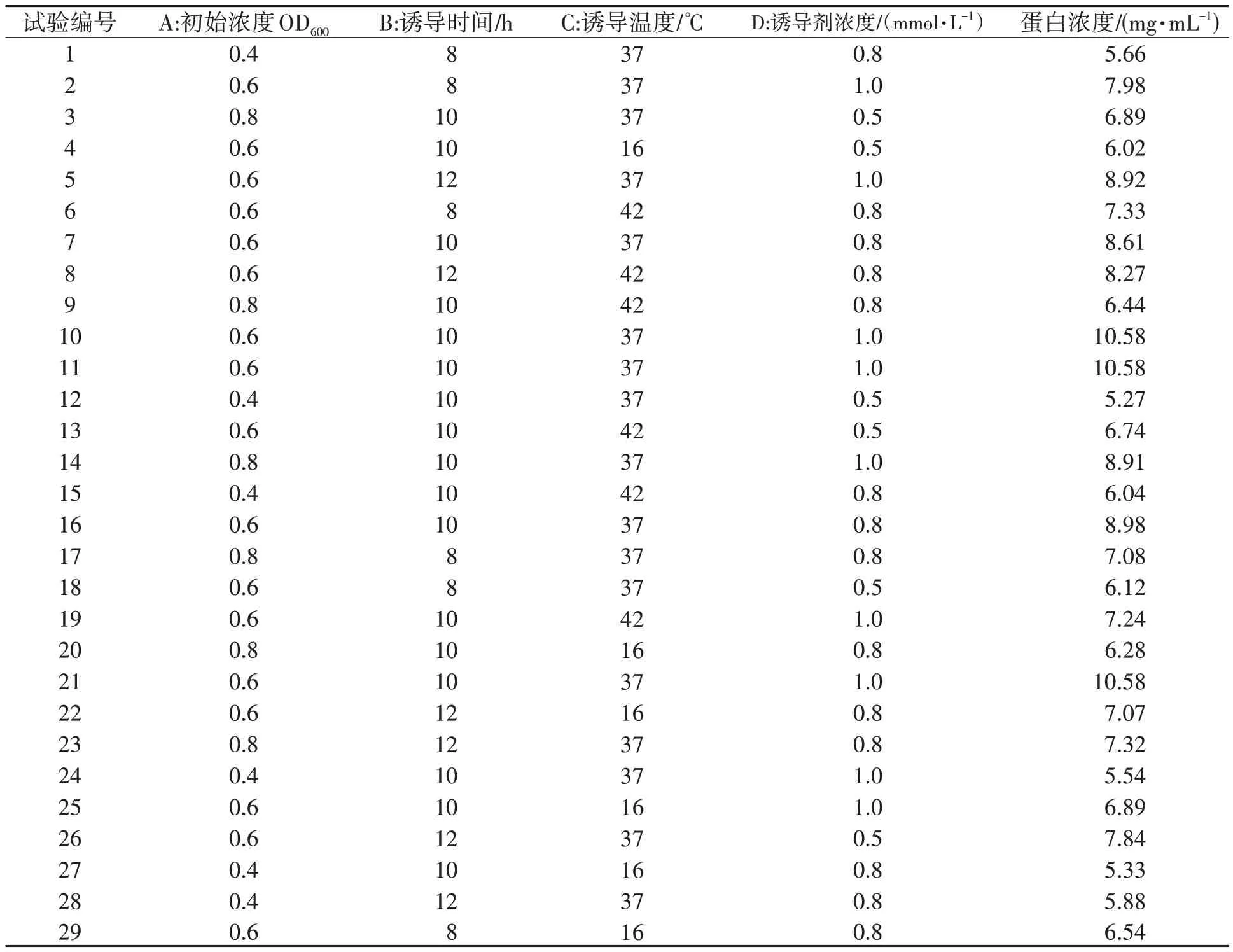
表2 试验设计与结果Table 2 Experimental design and results
2.4.1 回归方程的方差分析 由表3 可知,回归模型的P=0.000 7,表明回归模型极显著(P<0.01);失拟系数的P值为0.106 5,在统计学上分析其影响不显著(P>0.05),说明参与响应面的考察因素设计合理,未知因素对目的蛋白的表达量影响很小。因此不需要引入更高次数的项,模型适当。由回归方程系数显著性检验可知,一次项A 和D 处于显著水平(0.01<P<0.05)。二次项A2和C2处于极显著水平(P<0.01),B2处于显著水平(0.01<P<0.05)。
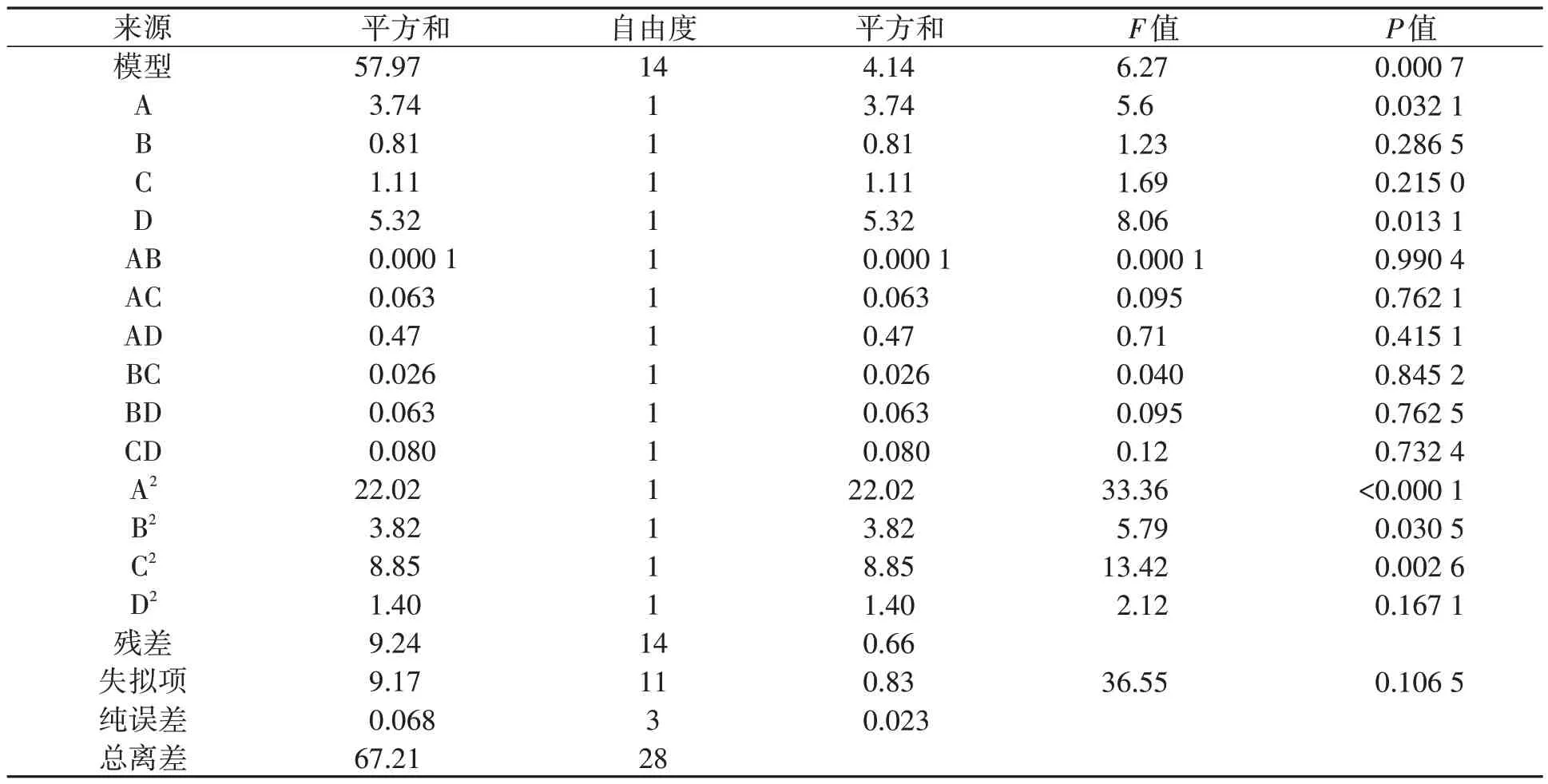
表3 回归方程各方差分析Table 3 Analysis of variance of regression equation
2.4.2 响应面图及其等高线 弧菌铁蛋白pvuA
各诱导条件的交互作用响应面曲线和等高线见图8。响应面图显示曲面均成山丘型,在试验中所选的范围内,响应面有最高点,存在最大值。不同因素交互效应的强弱可以通过等高线的形状判断。图8 中,诱导剂浓度及菌体初始浓度的等高线为椭圆形,表明这两因素交互作用显著。其他因素间等高线为圆形表示其交互作用不显著。

图8 菌体初始浓度与诱导温度、诱导剂浓度、诱导时间对菌体蛋白产量影响的响应面与等高线图Fig.8 Response surface and contour map of the effects of initial cell concentration with induction temperature,inducer concentration and induction time on the production of bacterial protein
2.4.3 最佳表达条件的确定 由Design-Expert分析得到最大响应值,其对应的最佳诱导表达条件:初始菌体浓度OD600=0.6,IPTG 浓度1.0 mmol·L−1,诱导温度37 ℃,诱导时间10 h,理论最佳蛋白浓度为10.58 mg·L−1。为验证该模型得到的最佳条件,进行3 组平行试验,结果表明,实际最高蛋白浓度为11.00 mg·mL−1,与理论值相当,说明该方程与实际情况具有较好的拟合度,验证了该模型的准确性,方程如下:
Y=10.03+0.68A+0.35B+0.31C+0.77D+0.0005AB+0.11AC+0.34AD+0.073BC−0.17BD+0.12CD−2.04A2−0.9B2−2.25C2−0.61D2
2.5 重组蛋白的纯化及含量测定
将制备得到的包涵体蛋白进行变性、复性实验后,未得到可溶的蛋白,后续实验以蛋白包涵体进行,将纯化的重组蛋白(图9)采用超滤管浓缩后,用Bradford 法测得的重组蛋白含量为11.00 mg·mL−1。
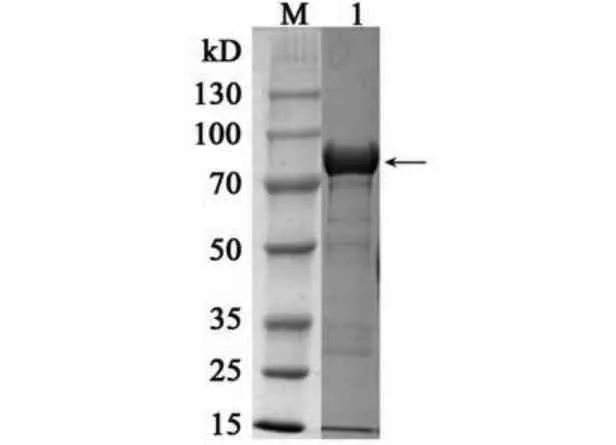
图9 重组蛋白纯化Fig.9 The recombinant protein purification
3 讨论
铁是绝大多数细菌生存所必需的元素,自然环境中存在的铁元素是微量的,并且多数为不溶性状态,而宿主中的铁多以亚铁红素、铁结合蛋白、转铁蛋白和乳铁蛋白等形式存在[18],细菌难以直接获取。因此,铁的摄取通常与细菌生存及在宿主内的致病过程相关。副溶血性弧菌有多种铁摄入系统,在缺铁环境下,其本身产生一种载铁体,即弧菌铁蛋白以促进铁的获取[19]。弧菌铁蛋白与环境中Fe3+络合后,被运送到与之特异性结合的表面受体蛋白,即弧菌铁蛋白受体;该蛋白分子量79 kD,由pvuA基因表达,其转运过程需要TonB 系统的帮助[20]。目前对于弧菌铁蛋白受体的免疫原性研究仅见于大黄鱼,本研究旨在构建弧菌铁蛋白受体重组质粒并优化表达条件,为抗体制备奠定基础。
大肠杆菌E.coli被证实能够重组表达多种细菌外膜蛋白[21],pET-28a(+)具有T7 启动子,具有较强的启动能[22]。pET 系统能将外源目的基因克隆到T7启动子之下使目的蛋白本底表达量较低,并且表达的重组蛋白带有6个His标签,便于后续纯化[23]。本试验结果表明,弧菌铁蛋白受体的pET-28a(+)重组表达质粒构建成功,重组蛋白诱导后以包涵体形式表达,蛋白分子量与理论值一致。通过单因素试验和响应面试验优化发现,带重组质粒的初始菌体浓度OD600(0.4~0.8)、诱导时间(8~14 h)对蛋白表达产量影响较大。当OD600在0.6 时,包涵体在凝胶上的目的条带最粗,重组蛋白表达量达到最大。这可能是因为OD600在0.4~0.8 时是大肠杆菌生长的对数期,但初始菌浓度较低会造成菌量较低,影响总体表达量;而初始菌浓度较高时,由于重组蛋白的合成与细菌的生长繁殖竞争营养物质,总蛋白表达量趋于稳定。诱导时间的影响也与重组菌的生长繁殖有关,随着诱导时间的延长,重组蛋白的表达量也随之增大,当诱导时间达到10 h 后重组菌的生长趋于平稳,此时的重组蛋白表达量无明显增加。本试验结果显示诱导温度为28、37 ℃时,弧菌铁蛋白受体表达量较高。大肠杆菌最适生长温度为37 ℃,此时蛋白表达的速度较快,蛋白常以无活性的包涵体形式存在。温度在16 ℃时,不利于大肠杆菌的生长,蛋白表达量较少,主要用于减少蛋白合成速度、促进蛋白可溶性表达。本研究中,在各种温度下均无可溶性蛋白表达,这可能与弧菌铁蛋白受体自身结构、性质、分子量有关。此外诱导剂IPTG 浓度也是影响表达量的重要因素,通常随着诱导剂浓度增加,会增强重组蛋白表达,但过高的IPTG 浓度会产生毒性,从而影响表达量。
本研究成功构建了弧菌铁蛋白受体pvuA 的pET-28a(+)重组表达质粒,IPTG 诱导后蛋白以包涵体形式表达,经响应面设计优化最终得到了诱导表达条件为IPTG 浓度1.0 mmol·L−1、菌株起始浓度OD600=0.6、诱导温度37 ℃、诱导时间10 h,此时包涵体沉淀中的蛋白浓度为11.00 mg·mL−1。本研究经纯化后得到了纯度较高的重组弧菌铁蛋白受体蛋白,为下一步制备多克隆抗体及研究该蛋白的结构、功能和免疫原性奠定了基础。
