PRNs基因家族研究进展
2022-05-28樊锦瑞王磊邹俊杰
樊锦瑞, 王磊, 邹俊杰
中国农业科学院生物技术研究所,北京100081
Pirin(PRN、PIR)蛋白在人类中最初是通过酵母双杂交筛选发现的,其与转录因子NFI/CTF1(nuclear factor I/CCAAT box transcription factor)相互作用,发挥相关功能[1]。已有报道表明,人hPRN 可作为转录因子辅因子和氧化还原感受器,参与多个生物学过程,与癌症的发生密切相关[2]。除了人类,在其他哺乳动物、植物、真菌甚至原核生物中也都存在PRN 同源蛋白,PRN 蛋白的N 端蛋白结构高度保守[1,3-5]。本文总结了PRN蛋白的基本结构和生化特征,重点综述了不同物种的PRN 蛋白生物学功能研究进展,并对植物PRN 蛋白今后的研究进行了展望,以期为癌症治疗和作物改良提供新的靶点。
1 PRNs的结构
PRNs 在哺乳动物、植物、真菌和原核生物中高度保守,根据序列和结构相似性被归类为Cupin 超家族的一个亚家族。Cupin 来源于拉丁文“cupa”,在拉丁语中是指木桶或小桶的意思,因此,将具有β 折叠片围成的桶状结构的蛋白命名为Cupin[6]。Cupin 家族蛋白除具有保守的β-barrel 结构外,还有两个保守的基序(motif),即[G(X)5HXH(X)3,4E(X)6G]和[G(X)5PXG(X)2H(X)3N],两个基序由15~50 个氨基酸隔开,形成了与金属离子结合的区域,被保护在β 桶状结构中[7-9]。
Winaker 等[1]首次克隆了人类hPRN基因,对hPRN基因的表达、蛋白结构和亚细胞定位进行了分析。如图1所示,hPRN 蛋白的晶体结构含有两个不同的Cupin 家族基序:一个是β-桶状折叠区域,在其N 端区域,含有金属离子结合位点,由3个组氨酸和1个谷氨酸组成;另一个是含α-螺旋的C-末端结构域,该结构域不含金属结合位点,也不含保守的金属配位残基。C-末端的α-螺旋结构并不是在所有物种中都保守,如大肠杆菌中就缺失了这段保守序列[4,10]。
PRN蛋白的晶体结构与槲皮素2,3-双加氧酶结构相似,具有类似槲皮素酶的功能,能够降解槲皮素。槲皮素是一种类黄酮物质,具有抗氧化、预防癌症、DNA 防护、抗炎反应和保护心脏等作用[11]。PRN与槲皮素2,3-双加氧酶均是利用槲皮素作为底物,酶促反应过程中均释放一氧化碳,且槲皮素2,3-双加氧酶抑制剂还能抑制PRN 活性,表明PRN蛋白具有类似槲皮素酶的活性[4]。
不同物种PRNs 结合不同金属离子的能力存在差异,与其功能密切相关。研究发现,PRN 可以结合Fe2+、Fe3+、Cu2+、Ni2+、Mg2+、Zn2+、Mn2+等不同金属离子[9,12]。hPRN结合的最适金属离子是Fe2+/Fe3+,大肠杆菌YhhW 为Ni2+,假单胞菌pirin-like为Cu2+[9,12]。这些物种中,PRN 与最适金属离子结合后,可以增强其槲皮素酶的活力。保守的金属离子结合域表明,PRN 可能通过结合不同金属离子来改变蛋白酶活性,也可通过结合不同价态的离子来参与基因表达调控。
2 不同物种PRNs进化关系
与哺乳动物、微生物仅有1个PRN 成员不同,不同植物的PRNs 均包含1 个小基因家族(图2),其中拟南芥中有4 个成员,水稻有3 个成员,玉米有4个成员,推测植物的PRNs可能具有更丰富的功能。同时,同一家族中的成员并未形成一个基因簇,而是分散在同一染色体的不同部位,或位于不同染色体上,暗示同一物种PRNs 可能具有不同的表达调控模式;一些同种家族成员也并未分布在同一进化分支中,进化距离较远,可能发挥不同的生物学功能。水稻的3 个成员在进化关系上分布于3 个不同的分支。拟南芥4 个成员中,AtPRN1、AtPRN2 和AtPRN3 进 化 关 系 更 近,而AtPRN4 被聚集到另一组(图1)。大量研究报道AtPRN1 和AtPRN2 具有不同的生物学功能[3,13-18],不同植物PRNs生物学功能仍有待进一步研究。
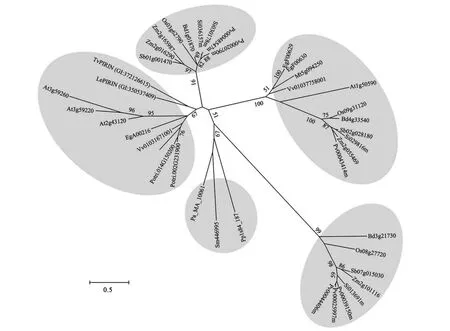
图1 部分植物PRN蛋白系统发育树[13]Fig.1 Phylogenetic tree of parts of plant PRN proteins[13]
3 PRN蛋白的生物学功能
自1997年PRN蛋白首次被发现以来,PRN的相关研究持续开展,PRNs在人、微生物、植物等不同物种中的生物学功能见表1。
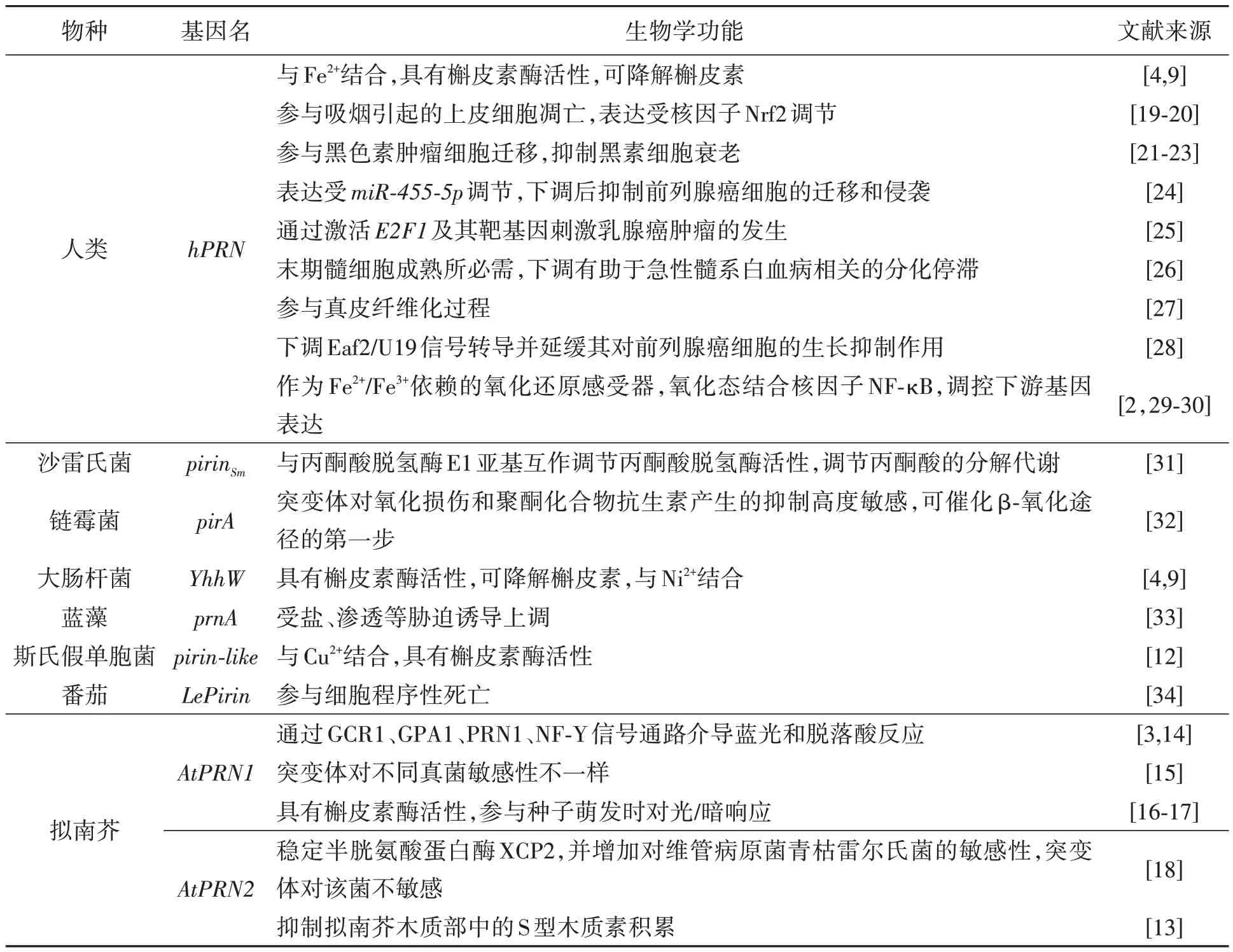
表1 PRN蛋白在不同物种中的生物学功能Table 1 Biological functions of PRN proteins in different species
3.1 PRN在人体中的生物学功能
hPRN 是一个32 kD 的蛋白质,由290 个氨基酸组成,定位于细胞核并呈点状分布[1]。hPRN 蛋白在人体中的研究较为广泛,在人体正常组织中表达水平相对较低,癌症发生过程中其表达量或定位发生变化。在急性髓系白血病(acute myeloid leukemia,AML)中hPRN的 表 达 下 调,hPRN是终末期髓细胞成熟必须的,其下调可能与AML 相关的分化受阻有关[26]。hPRN在大部分癌症中受到诱导会上调表达,与癌症发生密切相关。香烟刺激气道上皮细胞hPRN表达增加,转录因子Nrf2 能够结合hPRN的启动子区域的AREs 元件,调控hPRN的表达,参与上皮细胞凋亡和口腔癌的过程[19-20]。HPV16 E7 癌蛋白可以促进hPRN上调,导致上皮-间质转化(epithelialmesenchymal transition,EMT)和细胞迁移增加,从而引起口腔肿瘤细胞中hPRN/NF-κB 的活化[35]。在黑色素瘤细胞中,hPRN高表达,可抑制细胞衰老。黑色素瘤细胞中hPRN 亚细胞定位发生由细胞核向细胞质转移,细胞质hPRN 的水平与黑色素瘤的进展密切相关[26,36]。
hPRN 蛋白具有槲皮素酶的功能,同样参与了疾病的进展过程。在人体中高表达hPRN降低了体内槲皮素的含量,进而降低了槲皮素对脊髓灰质炎病毒的抑制作用,而siRNA 诱导hPRN水平的下降,使该病毒复制时对黄酮类化合物更加敏感[37]。
hPRN 可作为转录因子辅因子发挥功能,参与调控基因的转录。hPRN 能够与诱导凋亡的转录因子NF-κB(p50)相互作用,与原癌蛋白Bcl3形成复合物,抑制hPRN 与Bcl3 的结合,降低转录因子SNAI2表达和黑色素瘤细胞移动[22]。NF-κB 是一种普遍存在的转录调节因子,被认为在免疫反应、细胞凋亡、炎症和氧化应激中起重要作用[38-39]。在氧化条件下,hPRN 的结构从Fe2+(非活性形式)转变为Fe3+(活性形式),可改变蛋白R-shape 构象,氧化态的hPRN-Fe3+可促进p65 与DNA 分子的结合[2,29-30],说明hPRN 可作为氧化还原感受器(redox sensor),感受体内氧化还原变化,参与基因转录的调控。另外,hPRN 也能通过直接结合细胞周期激活因子E2F1启动子区域,激活E2F1的转录,进一步调控E2F1 的靶基因cdk4、cdk6、cycD、cycE和DDR1的表达,促进乳腺癌细胞G1期到S期的转变[25]。
hPRN 主要通过以下两个方面发挥其生物学功能:一是具有槲皮素酶的功能,参与调节体内槲皮素水平;二是可以作为转录因子辅因子,通过调控转录因子的活性,参与基因表达调控,以及癌症的发生和增殖过程。研究表明,降低hPRN的表达水平,有助于治疗癌症,如宫颈癌发生过程中hPRN 通过降低上皮细胞钙粘附蛋白(E-cadherin)的表达而诱导EMT;敲除hPRN基因可提高E-cadherin 水平,降低宫颈癌细胞中粘附素、锌指蛋白ZeB和锌指转录因子Snail的转录水平[40]。而在黑色素瘤细胞中,利用小分子抑制剂TphA可以阻断hPRN 和BCL-3之间的相互作用,最终抑制黑色素瘤细胞的迁移[22]。此外,降低hPRN的水平后发现,转移性黑色素瘤细胞的形态和大小均发生了改变,呈现出衰老的表型[23]。乳腺癌中,hPRN的敲除显著降低了乳腺癌细胞的增殖率,并降低了小鼠异种移植瘤的生长[25]。以上研究表明,hPRN可能成为一个重要的潜在生物标志物或治疗靶点。
3.2 PRN在微生物中的生物学功能
细菌PRNs 同样具有槲皮素酶活性,并且可以与不同金属离子结合改变其活性。斯氏假单胞菌(Pseudomonas stutzeri)的pirin-like通过大肠杆菌中异源表达,在二价金属离子的作用下表现出槲皮素酶活性,并且在Cu2+的情况下表现出最高的活性[12]。而大肠杆菌中的PRN 同源蛋白YhhW也具有降解槲皮素的酶活性,其被鉴定为一个新的含镍双加氧酶成员。此外,在催化腔附近有一个灵活的“Ω 环”,这可能有助于通过镍-黄酮醇络合物稳定反应中间产物[9]。
另外,原核生物PRNs 也参与逆境和氧化胁迫等过程。在原核生物中,蓝藻prnA的表达受到高盐、山梨醇、乙醇和甲基紫精处理诱导增加,而不受高低温和强光诱导[33]。沙雷氏菌(Serratia marcescens)pirinSm与丙酮酸脱氢酶E1亚基相互作用,通过调节丙酮酸脱氢酶活性来调节丙酮酸分解代谢,参与丙酮酸代谢向三羧酸循环(tricarboxylic acid cycle,TCA 循环)或发酵途径的过程[31]。链霉菌(Streptomyces ambofaciens)中PirA 对中枢碳代谢和能量代谢基因的表达有显著影响,pirA突变体表现为对氧化损伤和聚酮化合物抗生素产生的抑制高度敏感,其突变体负调控长链乙酰辅酶,可催化β-氧化途径的第一步[32]。
3.3 PRN在植物中的生物学功能
拟南芥的PRNs 影响种子萌发、木质素积累和器官发育等过程。拟南芥AtPRN1定位于细胞质和细胞核,其表达受脱落酸(abscisic acid,ABA)和红光诱导增加,能够与G 蛋白的α 亚基GPA1 互作,位于GPA1 的下游。AtPRN1突变体发芽率降低,脱落酸处理下发芽和早期幼苗发育延迟,参与了种子萌发和早期的幼苗生长[3]。研究表明AtPRN1 是一种穿梭蛋白,在感受信号后进入细胞核与转录因子NF-Y 结合,G 蛋白偶联受体GCR1、GPA1、AtPRN1和NF-Y 形成信号通路介导蓝光和ABA 响应,影响种子萌发[14]。AtPRN2定位于细胞质和细胞核,主要在维管束附近的细胞中表达。通过调节木质素生物合成基因的表达抑制了木质部导管附近S 型木质素的积累[13]。另外,寄生植物利用寄主根提供的特定分子来启动吸器的发育,吸器是植物寄生的关键入侵结构。TvPRN在寄生植物杂色三叶草(Triphysaria versicolor)的根中受到吸器诱导分子2,6-二甲氧基苯醌(2,6-dimethoxybenzoquinone,DMBQ)的诱导后表达上调,说明TvPRN与吸器发育相关,可能在寄生植物的寄主因子识别中发挥作用[41]。
AtPRNs家族成员具有槲皮素酶的功能,其中AtPRN1能够分解槲皮素,且其槲皮素酶活性受到其互作蛋白GPA1 影响,AtPRN1的突变体prn1中槲皮素含量增加。AtPRN1启动子区域存在可能与ABA 和激素信号有关的顺式作用元件,影响光或激素导向的早期发育[16]。说明AtPRN1 的槲皮素酶活性和转录辅因子活性相关,并共同参与拟南芥多个生物学过程。同时,AtPRNs还参与植物防御过程。AtPRN1影响真菌条件下种子的萌发过程,突变体对不同真菌敏感性存在差异[15]。拟南芥AtPRN2参与抗病反应,其突变体降低了侵染的发展和细菌的生长,表现出对维管束植物病原菌青枯雷尔氏菌(Ralstonia solanacearum)的抗病反应。细胞质中AtPRN2 通过稳定半胱氨酸蛋白酶XCP2,抑制XCP2 自噬,增加对青枯雷尔氏菌的敏感性[18]。番茄Le-PRN的表达与细胞死亡密切相关,表达量随着细胞衰老和死亡显著升高,这为研究PNN 在植物防御机制中的作用提供了新的线索[34]。
4 展望
最初鉴定的hPRN被认为定位于细胞核,后来研究证明hPRN也可定位于细胞质中,且其发挥作用的潜在分子机制通常被认为是与核蛋白的相互作用[1,23]。拟南芥中PRNs 也存在穿梭入核的现象[14],因此植物的PRNs 蛋白可能与hPRN 蛋白类似,在细胞核中也起到转录协同调节的作用。另外,根据亚细胞定位预测,玉米和水稻PRNs 部分成员具有线粒体和叶绿体定位肽(http://cello.life.nctu.edu.tw/),这些细胞器是活性氧产生的重要场所,同时也是植物生长发育的关键[42]。根据系统发育树中同种植物基因家族间距离较远的进化关系[5],推测植物中不同的PRNs 可能发挥不同的功能。同时拟南芥AtPRN1具有槲皮素酶活性,可改变植物体内槲皮素含量[16]。与细胞核的定位相结合,槲皮素酶活性和转录辅因子活性可能存在相关性,参与多个生物学过程。此外,槲皮素含量改变可能影响植物体内活性氧的水平,进而影响代谢、激素水平和抗逆,暗示植物PRNs 可能参与植物生长发育和抗逆过程,在抗逆品种培育方面具有一定的潜力。
目前植物PRNs 在调节重要的生物学功能的分子机制和功能多样性仍未明确。hPRN 可作为药物靶点,用于开展癌症治疗[43]。植物中是否存在类似hPRN 的氧化还原反应感应机制,以及是否在逆境胁迫调控中发挥重要作用还有待于进一步研究。未来可通过进一步阐明植物PRNs 功能及其调控机制,为作物分子设计育种提供新的靶点。
