光信号转导因子HY5调控拟南芥分枝的功能研究
2022-05-28周琴谢钰容
周琴, 谢钰容
中国农业科学院生物技术研究所,北京100081
自然界中的维管植物形态各异,每株植株均具有独特的视觉外观和形态特征,其中分枝是植物形态建成的重要组成部分,有助于物种对环境的适应和生存,分枝可增加植物的多样性。分枝的模式影响植株形态的建成、光吸收的效率及对可利用资源的适应等,在农作物中,花、果实、种子的分枝直接影响产量[1];同时,分枝还影响作物对杂草的竞争能力和害虫的抵抗力,间接影响作物产量[2]。在观赏性植物中,分枝调控植物的形态和密度,从而影响植物的观赏性[3]。
植株形态建成分为胚胎发育时期和胚胎发育后期两个阶段,其中,胚胎发育时期由增殖细胞构成的茎端分生组织和根端分生组织形成主要的顶端-基部生长轴,随后发育为主茎和主根;胚胎发育后期是指植物通过形成其他分生组织来建立多个次级生长轴,衍生自周细胞的根分生组织产生侧生根,而衍生自叶腋中的细胞的腋生分生组织产生分枝。
腋生分生组织的形成和活性取决于植物的基因型、内在生长发育阶段和外在的环境因子,其中外界环境包括温度、光照时间、光照质量、养分等因素[4],此外,多种植物激素也参与了分枝调控。研究表明,植物激素生长素和细胞分裂素之间的拮抗作用可共同调节腋芽的生长[5]。近年来,一组衍生自类胡萝卜素的倍半萜内酯或其衍生物独角金内酯也在抑制分枝中具有关键作用[6]。研究表 明LATERAL SUPPRESSOR(LAS)编 码1 种GRAS 蛋白[7],REGΜLATOR OF AXILLARY MERISTEMS(RAX)编码1 组R2R3 MYB 蛋白[8-9],对于维持叶片基部细胞的分生能力以及起始腋生分生组织的形成必不可少。REVOLUTA/INTER-FASCICΜLAR FIBERLESS1(REV/IFL1)编码1 种同源框亮氨酸拉链蛋白,也参与调控了腋生分生组织早期阶段的发育[10]。当腋生分生组织发育为腋芽后,腋芽的活性受到各种信号的调控。研究表明TCPs 转录因子家族中的TEOSINTE BRANCHED1(TB1)调控腋芽活性,进而影响分枝[11]。TB1最早是在对玉米的驯化过程中根据其作用命名的,相比于野生型祖先大刍草,玉米由于组成型过表达TB1,抑制了分枝,因此,只有1根茎秆[12]。在其他物种中,也发现了TB1的同源基因,包括水稻中的FINECΜLM1(FC1)和拟南芥、豌豆、番茄等中的BRANCHED1(BRC1)[13-15]。
光作为植物生长发育最重要的环境因素之一,影响植物从种子萌发到衰老死亡的整个发育过程。植物利用各种光受体接收光信号,并传递转化为化学能量以满足其生长发育。研究表明,在拟南芥中有5 个光敏色素,即Phytochrome A~E(PHYA~E),其中,PHYB 参与了光照影响腋芽生长的调控过程[16],且与野生型相比,phyB突变体的分枝显著减少;在拟南芥中,低红光∶远红光(red light∶far-red light,R/FR)比率光照条件下会造成野生型分枝的减少,与phyB突变体相似。在高粱中,白光下生长的野生型植株增加FR 处理后,分枝表型也显著减少,与phyB-1突变体相似[17]。说明PHYB 能够感应R/FR,并在高R/FR条件下促进分枝的发生[18]。
HY5 在拟南芥光敏色素信号转导中发挥关键的调控作用,HY5 参与调控叶绿素和花青素合成、主根和侧根发育、开花时间、遮荫、高温响应等过程[19-20],但其是否参与分枝调控尚鲜见报道。本研究以模式植物拟南芥为实验材料,通过观察HY5-GFP 过表达植株和hy5突变体的分枝数目表型,从而探究光信号因子HY5 对分枝的调控及其分子机理,以期为培育分枝适当的理想株型作物提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验材料 拟南芥野生型种子Col-0和hy5突变体hy5-215由本实验保存,拟南芥hy5-10(SALK_096651)为从诺丁汉拟南芥储存中心(Nottingham Arabidopsis Stock Centre,NASC)购买的T-DNA 插入突变体。所有野生型和突变体材料均培养于23 ℃,有效光照强度(photosynthetically active radiation,PAR)100 μmol·m−2·s−1,16 h 光照/8 h 黑暗的人工气候培养室中,用于后续DNA和RNA的提取、表型观察和数据统计。
1.1.2 实验试剂 快速质粒小提试剂盒(DP105-03)、反转录试剂盒(KR106-02)、通用型DNA纯化回收试剂盒(DP214-03)、荧光定量试剂盒(FP205-02)均购于天根生化科技(北京)有限公司;Trizol试剂盒购于赛默飞世尔试剂公司;限制性内切酶购 于TaKaRa 与NEB 公 司;In-fusion HD Cloning Kit 购于Clontech 公司;KOD Fx PCR 扩增酶购于东洋纺公司(TOYOBO);大肠杆菌DH5α 感受态和农杆菌GV3101 感受态由本实验室保存;pEGAD载体由本实验室保存。
1.1.3 实验器材 s1-802型真空泵购于林贝尔仪器制造有限公司;EOS 6OD 型单反相机购于佳能公司;TC-XP 型PCR 仪购于广州博日科技公司;Quant Studio3实时定量PCR 仪购于美国应用生物系统公司(ABI);Tanon-100 一体化凝胶成像系统购于上海天能公司;NANO DROP 2000C 购于Thermo公司。
1.2 方法
1.2.1HY5-GFP过表达株系的构建 采用Trizol法提取野生型拟南芥的RNA,反转录得到cDNA,使用HY5基因特异性引物(表1)扩增HY5基因的编码区序列,并连接至pEGAD 载体上(图1)。利用农杆菌介导转化野生型拟南芥Col-0,并通过载体上的潮霉素(Hyg)进行抗性筛选,得到单拷贝的HY5-GFP过表达转基因株系。

表1 实验所用引物Table1 Primers used in the experiment

图1HY5-GFP过表达载体Fig.1 Vector ofHY5-GFP
1.2.2HY5-GFP过表达株系GFP 荧光检测 为检测转基因纯合株系的真实性,利用载体上的GFP标签进行鉴定。将种子在1/2 MS培养基上培养10 d,剪取幼苗的根部在荧光显微镜下观察,利用GFP激发光检测GFP蛋白是否表达。
1.2.3HY5-GFP过表达株系中HY5mRNA水平检测 采用Trizol 法提取HY5-GFP过表达株系的RNA,并反转录为cDNA。以cDNA 为模板,PP2A为内参基因,使用HY5基因特异性引物,通过RTPCR 对过表达株系的HY5基因进行表达量检测(表1)。
1.2.4hy5-215突变体鉴定 实验室保存hy5-215种子,hy5-215突变体为HY5基因组第1 个内含子最后1 个碱基突变,从而干扰RNA 的剪切拼装,下调mRNA 的转录。剪取hy5-215突变体幼嫩叶片提取DNA,用特异引物(表1)PCR 扩增相应区段后进行测序,将测序结果用DNAMAN 进行比对。
1.2.5hy5-10突变体的鉴定 从NASC 购买T DNA 插入突变体Salk_096651 并命名为hy5-10。根据T-DNA 插入突变鉴定原理,提取hy5-10的DNA,并设计特异性引物LP/RP 和LB(表1)进行PCR扩增鉴定。
1.2.6 各株系分枝表型观察 在人工气候室培养Col-0(野生型)、HY5-GFP和hy5株系,30 d 后观察分枝数目,采用EOS 6OD 型佳能单反相机收集表型,并统计莲座叶分枝数目,每个株系至少15株,进行统计学分析。
1.2.7BRC1的mRNA水平检测 采用Trizol法提取野生型、HY5-GFP和hy5株系的RNA,进行反转录得到cDNA。以cDNA 为模板,PP2A为内参基因,使用BRC1基因特异性引物(表1),通过RTPCR 方法对3 个株系的BRC1基因的mRNA 水平进行检测。
1.2.8 数据处理与分析 利用Excel 软件对测定的相关基因表达水平和莲座叶分枝数目数据进行处理,显著性分析采用Student'st-test,以P<0.01为差异具有统计学意义。
2 结果与分析
2.1HY5‑GFP过表达株系构建
将构建好的35S∷HY5-GFP过表达载体转化拟南芥野生型Col-0 得到T0代种子,在含Hyg 抗性的1/2 MS 平板上筛选抗性幼苗(图2),待存活幼苗生长至种子成熟时收取T1代种子,再在抗性板上筛选得到T2代种子。将T2代种子再进行抗性筛选,选择全部存活的株系即为纯合株系,收取T3代种子,得到纯合株系种子。

图2 转基因阳性植株的筛选Fig.2 Screening of transgenic positive plants
2.2 转基因纯合株系GFP蛋白荧光检测
为检测转基因纯合株系的真实性,利用载体上的GFP标签进行鉴定。利用荧光显微镜下GFP激发光检测GFP 蛋白是否表达。如图3 所示,筛选得到的3 个株系在GFP 激发光下均有绿色荧光,说明转基因株系均有GFP 蛋白的表达,得到的株系为转基因纯合株系。

图3HY5-GFP过表达植株激发光检测Fig.3 Fluorescence detection ofHY5-GFPoverexpression plants
2.3 过表达株系HY5表达水平检测
为检测外源HY5基因在拟南芥中的表达量,挑取单拷贝转基因株系,即在抗性板上存活植株∶死亡植株分离比为3∶1 的株系,在1/2 MS 培养基上培养10 d,提取幼苗的RNA,反转录后采用qPCR检测HY5基因的表达量,结果显示各株系的HY5表达量均高于野生型(P<0.01),表明选择表达量相近的3 个过表达株系均可用于后续研究(图4)。
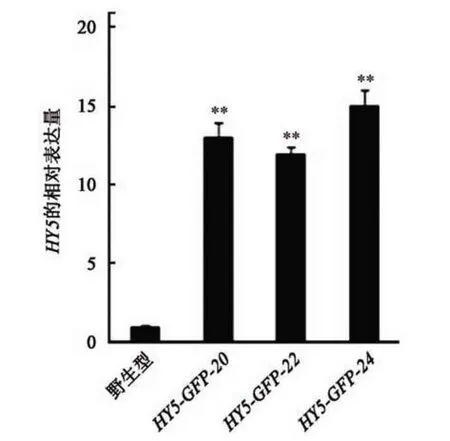
图4 转基因株系HY5相对表达量Fig.4 Relative expression ofHY5in transgenic lines
2.4hy5突变体鉴定
提取实验室保存的hy5-215种子DNA,进行PCR 扩增并测序,根据测序结果与野生型进行比对,结果显示基因组内含子最后1 个碱基由G 变为A,验证了所用hy5-215材料的真实性(图5A)。采用HY5基因的另一T-DNA 插入突变体SALK_096651(hy5-10)对hy5-215的功能进行佐证。特异引物hy5-salk-LP/hy5-salk-RP 扩增野生型DNA得到1条1.1 kb的条带,突变体hy5-10无条带;LB/hy5-salk-RP 引物扩增野生型DNA 无条带,突变体hy5-10有500 bp 左右条带,根据T-DNA 鉴定原理可知,得到的为纯合突变体(图5B)。
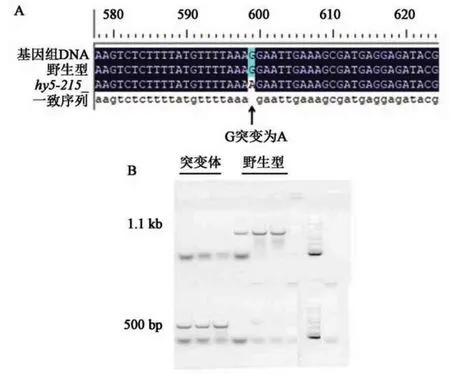
图5 hy5突变体鉴定Fig.5 Identification ofhy5mutant
2.5 各基因型分枝表型分析
为研究HY5基因在拟南芥分枝发育方面的生物学功能,本研究比较了拟南芥突变体hy5-215、HY5过表达株系HY5-GFP与野生型在分枝数目的差异。如图6所示,突变体hy5-215的莲座叶分枝少于野生型,而过表达株系HY5-GFP的莲座叶分枝多于野生型。进一步统计分析发现,与野生型相比,突变体hy5-215植株莲座叶数目显著下降,HY5-GFP过表达株系莲座叶数目显著增多(P<0.01)。将HY5基因的另一T-DNA插入突变体hy5-10,进一步确认了突变体分枝减少的表型。

图6 拟南芥各基因型表型分析Fig.6 Analysing of branching phenotype ofArabidopsis thaliana
2.6 各基因型BRC1表达水平检测
BRC1是抑制分枝发生的关键基因,因此,检测 了HY5-GFP和hy5突 变 体 中BRC1的mRNA 水平。如图7所示,与野生型相比,过表达株系HY5-GFP-20/22/24腋芽中BRC1的表达量降低(P<0.01),而突变体hy5-215植株腋芽的表达量增高(P<0.01),说明在拟南芥中,HY5 抑制BRC1的转录进而促进分枝的发生。

图7 BRC1表达水平检测Fig.7 Detection of expression ofBRC1
3 讨论
植物的分枝是株型的重要组成部分,其模式是由受复杂时空调控的腋芽决定的。多数叶片的叶腋处会形成腋生分生组织,并膨大形成腋芽。这些腋芽可以立即生长形成侧枝或进入休眠。休眠的腋芽也可能受诱导打破休眠生长成侧枝[21-23]。分枝的数目和位置受到各种内源因子和发育信号的共同调控,且强烈依赖于环境因子[24-25],植物则可根据其生存环境调整分枝以适应环境并高效利用资源,其中,光照是最重要的环境因子之一[26]。最为典型的光调控是在密植条件下,周边植物的遮荫使得植株感知光照的R/FR比率急剧下降,诱发避荫反应,导致植株分枝减少[27]。近年来,研究表明,BRC1基因能够响应密植遮荫条件,短时间的遮荫处理即可引起BRC1的转录水平显著上升,从而抑制拟南芥分枝的发生,其中,光敏色素PHYB 调控BRC1的转录水平[28]。PHYB 接受光信号后,负调控光敏色素作用因子(phytochrome action factor,PIFs),PIFs直接结合并抑制小分子RNA MIR156 的表达,SPL9/15能够结合BRC1的启动子,激活BRC1的表达从而抑制分枝。因此,PHYB调控分枝的其中1条通路是通过PIFs 调控MIR156/SPLs模块影响BRC1的表达量[29]。有研究发现,光信号因子FHY3和FAR1突变体植株也存在分枝减少的表型[30]。最近研究发现FHY3 和FAR1 参与避荫反应调控分枝,通过与SPL9/15 互作,抑制SPL9/15 激活BRC1的表达,从而促进分枝[31]。与PIFs 和FHY3/FAR1相似,HY5也是重要的光信号因子,HY5是第1个被发现参与植物光形态建成的正调控因子,在拟南芥光形态建成过程中起重要的正调控作用,影响植株从萌发到衰老的整个发育过程。然而,HY5基因是否参与以及如何调控拟南芥的分枝目前尚不清楚。本研究结果显示,与野生型相比,HY5过表达植株分枝数目显著增多,突变体hy5分枝数目显著减少,说明HY5 促进了拟南芥植株莲座叶分枝的产生;进一步通过RT-qPCR 检测各株系BRC1的mRNA 水平发现,HY5 抑制BRC1的转录。因此,推测转录因子HY5 是通过抑制BRC1的转录,下调BRC1的表达水平从而促进分枝的发生。研究表明,拟南芥HY5 在长时间FR处理后转录本水平上调[32-33],且蛋白稳定性增强[34],表明HY5 蛋白参与了植物避荫反应,然而,HY5 是否参与以及如何参与密植遮荫条件下植株分枝的调控目前尚不清楚。
植物激素对植物分枝也发挥了重要的调控作用,细胞分裂素促进植株分枝的发生[5],而生长素和独角金内酯在抑制分枝中具有关键作用[6]。有研究者认为,腋芽中脱落酸(abscisic acid,ABA)升高与被分枝抑制相关[35],且赤霉素(gibberellin,GA)也能够调控腋芽的生长[36]。在水稻和豌豆中油菜素内酯(brassinolide,BR)缺失突变体分枝受到抑制,此外,HY5 也参与了多条植物激素信号通路对植物生长和发育的调控[37]。HY5 是否以及如何与激素耦合协同调控分枝需进行更深入地研究,以更好地理解光信号因子和植物激素在拟南芥分枝调控上的作用机制和机理,最终为培育适当分枝的理想株型植株,提高作物产量奠定理论基础。
