施氏假单胞菌A1501 铁吸收调节蛋白Fur 的表达特性与功能鉴定
2022-05-28刘一超陆超战嵛华柯秀彬陆伟燕永亮
刘一超, 陆超, 战嵛华, 柯秀彬, 陆伟, 燕永亮
中国农业科学院生物技术研究所,北京100081
铁元素是几乎所有微生物生长、繁殖和代谢所必需的营养元素。目前已知铁元素的功能大都基于其作为关键酶辅因子展开,例如,它可以作为辅因子参与构成血红素蛋白和铁-硫蛋白的核心,或参与构成二铁单核酶的活性中心并稳定其构象,也可与铁载体结合而发挥作用[1]。研究表明,不同物种内铁元素的存在和作用模式不同,对微生物来说,并不是铁的吸收越多越好,胞内过高浓度的铁会对细胞产生毒性,破坏微生物内环境的稳定性[2],微生物必须在铁的摄取不足与铁过多导致毒性之间保持平衡。革兰氏阴性菌中,胞内铁转运、储存和利用主要由铁吸收调节蛋白Fur(ferric uptake regulator)调控[3]。大量研究发现,Fur 在铁的转运和利用、光合作用、呼吸作用、DNA 的生物合成、微生物-宿主互作、环境竞争等过程中发挥重要作用[4-6]。
Fur 蛋白在原核生物中广泛存在,Hantke 等[7]最早在大肠杆菌中发现了该蛋白,而Bagg 等[8]进一步通过实验证明了该蛋白可以与亚铁离子结合,并对铁转运系统起调控作用。Fur 通过其蛋白结构上一个富含组氨酸区域与靶标基因启动子上富含A/T 区域的Fur box 结合[3]。这种序列的特异性在不同细菌间存在较大差异[9]。近年来的研究发现,Fur 蛋白对靶标的表达存在正调控和负调控两种模式,如Fur 作为转录因子的负调控机制[10]、apo-Fur 的正调控机制[11]和Fe2+-Fur 复合体的正调控机制[12-13]。此外,也有研究发现,Fur蛋白可通过非编码RNA 介导的RNA-RNA 互作调控模式,对铁代谢相关的基因进行精准调控,如大肠杆菌中参与氧化胁迫调控的非编码RNA RyhB[14-16]。
施氏假单胞菌(Pseudomonas stutzeri)A1501是一株分离于水稻根际的联合固氮菌[17],也是目前联合固氮研究的模式菌株之一,其高效固氮和根表定殖需要大量含铁蛋白(如固氮酶)的参与,因此了解其如何适应不同生境铁有助于完善A1501 的生境适应机制及固氮调控网络。近年来,科研人员通过对A1501在抗氧化胁迫、碳源利用、固氮调控与氮循环、生物膜形成以及根表定殖等方面的深入研究,对其基本调控模式和适应环境的能力有了更为清晰的理解[18-24],但是关于A1501如何响应外界铁信号并调控其根际适应和高效固氮等的相关研究仍较匮乏。本研究以A1501 的Fur 蛋白为研究对象,通过比较Fur 蛋白及其编码基因fur的表达特性,并开展功能鉴定,初步明确A1501 中fur影响铁离子转运和氧化胁迫适应的作用机制,以期为进一步解析A1501 根际环境适应和高效固氮机制奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株与培养条件 施氏假单胞菌A1501为本实验室长期保存菌株。Luria-Bertani(LB)培养基:10.0 g·L−1胰蛋白胨,5.0 g·L−1酵母抽提物,10.0 g·L−1氯化钠。铁限制培养基通过在LB 培养基中加入终浓度为200 μmol·L−1的二联吡啶获得。铁过量培养基通过在LB 培养基中加入终浓度为100 μmol·L−1氯化铁获得。A1501 及其衍生菌株培养条件为LB培养基,30 ℃,220 r·min−1。
1.1.2 试剂与耗材 细菌RNA 提取试剂盒(innu-PREP RNA mini kit)购自Analytik Jena AG 公司;逆转录制备cDNA 试剂盒(HiScript 1st strand cDNA synthesis kit)及染料法荧光定量预混液(2×SYBR Mix TaqII)购自诺维赞公司;Fur 单抗由北京华大蛋白质研发中心有限公司制备;羊抗鼠二抗购自上海碧云天生物技术有限公司;二联吡啶购自Sigma公司;其余试剂均为国产分析纯。
1.1.3 主要仪器 涡旋振荡仪(型号Vortex Genie2)购自美国Scientific Industries 公司;紫外可见分光光度计(型号U3010 Hitachi)购自日立高新技术公司;微量紫外可见分光光度计(型号Nano Drop 2000)购自Thermo Fisher 公司;恒温培养箱(型号DH4000AB)购自HEB 西安禾普生物公司;台式冷冻离心机(型号3K-15)购自Sigma-aldrich公司;PCR仪(型号9700)购自Bio-Rad 公司;小型离心机(型号5424)购自Eppendorf 公司;实时荧光定量PCR仪(型号7500)购自美国Applied Biosystems公司。
1.2 实验方法
1.2.1 突变株构建 通过同源双交换的方法构建fur缺失突变株,采用pLFRA3 载体构建功能回补株,具体方法参照Zhan 等[24]的方法。突变株及回补株构建涉及的引物见表1。
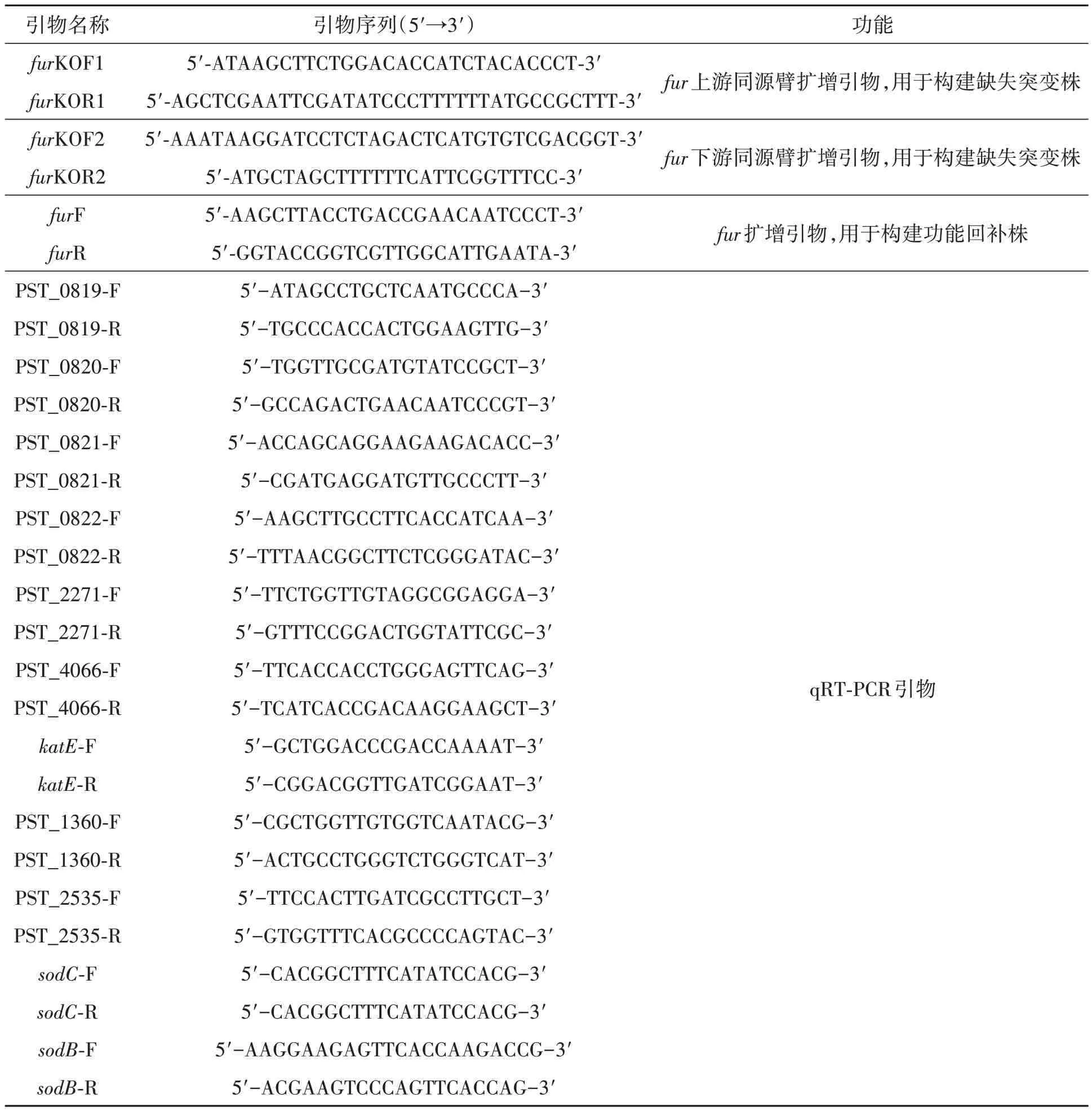
表1 本研究所用引物Table 1 Primers used in this study
1.2.2 实时荧光定量反转录PCR(qRT-PCR)引物铁转运系统及氧化胁迫调控相关基因表达差异涉及的qRT-PCR引物见表1。
1.2.3 生长曲线的测定 从固体平板上挑取A1501及其衍生菌单菌落接种至20 mL的LB液体培养基中,30 ℃、220 r·min−1过夜培养;次日,将菌液于4 ℃、6 000g离心8 min 收集菌体,弃上清后用20 mL 0.85%的氯化钠溶液在相同离心条件下清洗菌体2次;初始浓度OD600=0.1转接菌液,每组设置3 个平行,于30 ℃、220 r·min−1条件下震荡培养,每隔1 h 取样,测定菌液在600 nm 下的吸光值。根据所测得的数据,以时间(h)为横坐标,吸光值(OD600)为纵坐标绘制生长曲线。
1.2.4Biolog碳源代谢差异分析 野生型A1501与fur突变株于LB 液体培养基中生长至对数中期,用接种环蘸取菌液并转接至LB 固体平板,30 ℃过夜静止培养;次日,将平板上的新鲜菌体重悬于LB 液体培养基中并调节OD600至0.1;将菌悬液接种至预装95 种已知碳源的GN2 Biolog 碳源鉴定板中;在30 ℃培养箱中静置培养至4 h 和24 h时用Biolog酶标仪读取吸光值。
1.2.5 胞内铁含量测定 将调至OD600=1的A1501与fur突变株接种到500 mL LB 培养基中,调整终浓度为OD600=0.1,30 ℃、220 r·min−1培养6 h 后收集菌体。菌体用含有5 mmol·L−1乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的磷酸缓冲液清洗2遍,再用不含EDTA 的PBS缓冲液清洗两遍,于50 mL 离心管中50 ℃过夜烘干。称取干重后用浓硝酸和双氧水将菌体溶解,经蒸发和定容后用电感耦合等离子体质谱测定铁元素含量。
1.2.6 Western blotting 将过夜富集培养的野生型A1501液转接(1%)至LB液体培养基中,并于菌体的指数生长期(约6 h)收集细胞沉淀并制备全细胞提取液。铁过量和铁限制条件下分别通过额外添加终浓度为100 μmol·L−1的FeCl3和200 μmol·L−1的二联吡啶实现。利用12%(质量体积分数)的SDS 聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gels,SDS-PAGE)对等量的不同蛋白样品(以定量分析目标蛋白的表达量变化)进行分离,然后通过半干电转印的方法,将蛋白样品从SDS-PAGE 转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上。带有蛋白样品的PVDF 膜分别依次与阻断缓冲液室温孵育2 h、抗P. sttzeriA1501 Fur 蛋白的血清(anti-Fur antisera)在4 ℃孵育过夜后,再与抗鼠二抗室温孵育2 h,最后采用HRP-DAB 化学显色试剂盒对膜上可能存在的蛋白样品进行化学显色。PVDF 膜在不同抗体或显色缓冲液中切换时使用含0.1% Tween-20的Tris缓冲液洗涤膜3次,每次10 min。
1.2.7 过氧化氢冲击 将A1501野生型、fur突变株以及回补株接入LB液体培养基,30 ℃、220 r·min−1摇床培养,过夜;按1%接菌量,转接到LB 液体培养基,培养至OD600=0.5左右;分别取1 mL菌体,用0.85%的氯化钠溶液分别稀释到10−1、10−2、10−3、10−4、10−5作为对照组,然后再取1 mL 菌体加入终浓度为20 mmol·L−1的H2O2冲击10 min并且依次稀释至10−5,用移液器分别取出8 μL点在LB平板上,30 ℃过夜培养;培养16~20 h,用菌落计数仪拍照。1.2.8 qRT-PCR 反应 根据细菌RNA 提取试剂盒说明书对目的菌株提取总RNA。根据逆转录制备cDNA 试剂盒说明书去除样品中的基因组DNA并逆转录为cDNA。以16S为内参基因,测定菌株中目的基因的表达情况。每个反应设置3个重复。
2 结果与分析
2.1 A1501 中Fur 及其编码基因的生物信息学分析
施氏假单胞菌A1501 基因组中存在一个Fur编码基因fur,由PST3330 编码,该基因在假单胞菌属中的基因位置非常保守,均位于DNA 修复蛋白基因recN和外膜蛋白基因omlA之间,而大肠杆菌中fur的侧翼基因与假单胞属中fur侧翼基因没有同缘关系(图1A)。A1501 中Fur 蛋白由134 个氨基酸残基组成。分别选取了同属的施氏假单胞菌ATCC 17588、铜绿假单胞菌PAO1、模式菌株大肠杆菌K12、棕色固氮菌CA6的Fur蛋白进行了同源性比对,结果表明,A1501 与ATCC17588 的Fur蛋白一致性为100%,与铜绿假单胞菌、棕色固氮菌、大肠杆菌的Fur 蛋白一致性分别为90%、89%和60%,表明该蛋白在进化上相对保守。蛋白质二级结构预测表明,以上菌株中Fur 蛋白均含有5个α螺旋和5个β折叠结构域(图1B),其中β3折叠前具有典型的HHDH 离子结合区域,该区域的功能可能与Fur蛋白形成二聚体结构有关。

图1 不同细菌中fur基因的染色体位置以及Fur蛋白的二级结构比较Fig.1 Comparative analysis of the chromosomal location offurgene and primary structure of Fur protein in different bacteria
2.2 A1501中fur基因的表达特性分析
为了探究A1501 中fur基因的表达对环境中铁浓度的响应,分别通过在LB 培养基中添加100 μmol·L−1的FeCl3以及200 μmol·L−1铁离子螯合剂——二联吡啶来创造铁过量和铁限制条件,通过qRT-PCR 方法测定fur基因在不同条件下的表达水平。结果表明,相比正常的培养条件,在铁限制条件下,fur基因的表达量提高了2.5 倍以上;而在铁过量条件下,fur的表达量均下降了50%左右(图2A)。此外,本研究制备了Fur 蛋白的单克隆抗体,通过Western blotting 实验检测了A1501在含有不同铁离子浓度的LB 培养条件下Fur 蛋白的表达差异,结果表明,在铁限制条件下Fur 蛋白的表达量明显高于正常培养条件和铁过量条件(图2B)。以上结果表明,在施氏假单胞菌中,fur的表达受到环境中铁含量的影响,在环境中铁缺乏时,Fur 蛋白的表达量会升高;在环境中铁过量时,Fur蛋白的表达量会降低。
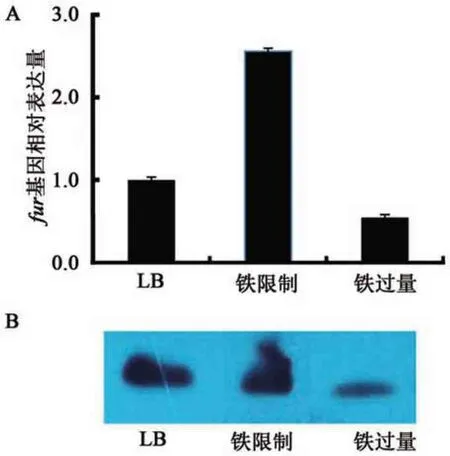
图2 A1501fur基因及Fur蛋白在不同铁离子浓度培养条件下的表达水平Fig.2 Expression offurgene and Fur protein in wild type A1501 under different iron conditions
2.3fur基因突变对菌株的碳代谢及铁元素跨膜转运的影响
通过同源双交换的方法构建了fur基因的缺失突变株和功能回补菌株。采用GN2 Biolog 碳源鉴定板测定了fur基因突变对碳源代谢利用的影响,结果表明,在测定的95种碳源中,fur基因的突变改变了A1501 种类的碳源利用种类:与野生型A1501 相比,fur突变使菌株几乎完全丧失了对碳源L-天冬氨酸的利用能力,但是对α-丁酮酸的利用能力增强。除此之外,fur的突变降低了糊精、α-D葡萄糖、丙酮酸甲酯、D,L-乳酸、D-丙氨酸、L-焦谷氨酸的利用能力(图3)。这说明Fur 可能通过参与某些关键的细胞代谢过程影响了A1501 的碳代谢。
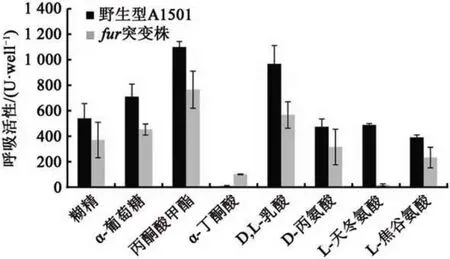
图3 野生型A1501和fur突变株的碳源代谢谱比较Fig.3 Changes in the carbon metabolite profiling between wild type A1501 andfurmutant
本研究进一步测定了野生型、突变株和回补株在铁丰富培养基LB中的生长曲线。结果表明,在正常铁浓度条件下,与野生型相比,fur突变株的生长情况没有受到明显的影响(图4A),而在铁限制条件下,fur突变株的生长受到影响(图4B)。推测其可能的原因在于,Fur 在铁限制条件下高表达以适应铁限制环境,而fur的基因缺失突变导致菌体无法合成足够的Fur 蛋白,胞内的铁代谢紊乱从而影响菌株生长,具体机制值得进一步研究。
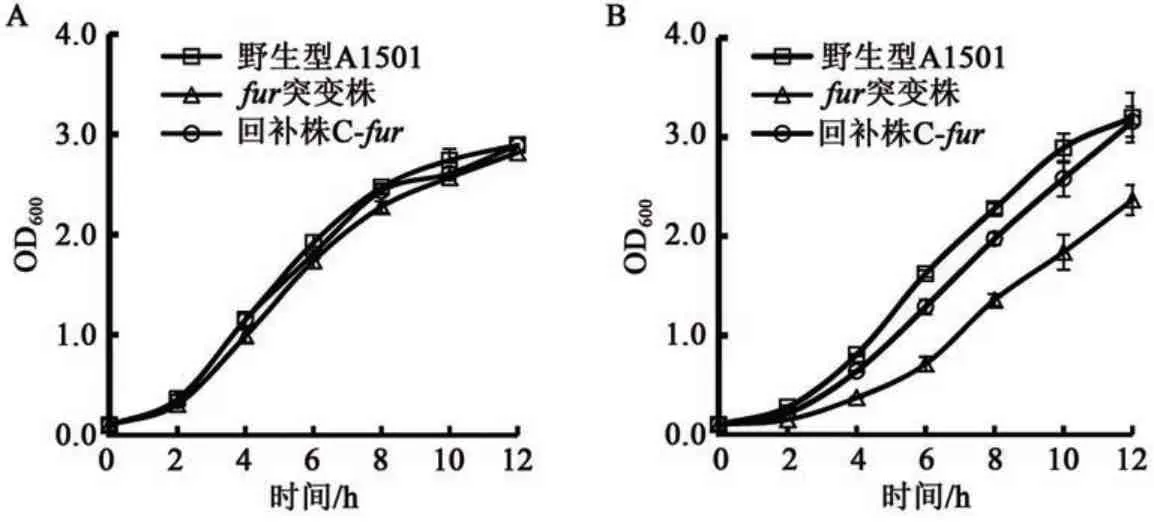
图4 野生型A1501、fur突变株和回补株在铁过量和铁限制条件下的生长情况Fig.4 Growth curves of wild type A1501,furmutant and C-furunder iron-excessive and iron-limited conditions
大量研究表明,Fur 对铁元素的吸收发挥调控作用,以适应铁缺乏的环境。为了验证fur突变是否对A1501 的铁离子运输产生影响,本研究采用电感耦合等离子体质谱技术测定了A1501 和fur突变株胞内的铁离子浓度。结果如图5 所示,在LB 条件下,与野生型相比,fur突变株的胞内铁含量上升了30%左右(图5A),推测可能的原因是fur突变导致铁离子的胞内主动运输能力增强,并且Fur 对铁离子的转运系统存在负调控作用。为了验证上述推测,进一步挑选了与铁转运相关的基因进行了qRT-PCR 分析,其中PST_0819、PST_0820、PST_0821 和PST_0822 分别与编码铁转运蛋白的TonB 系统关键组分高度同源,PST_4066是ABC 转运系统,PST_2271是一个细胞外膜特异性受体。qRT-PCR 发现其TonB 系统相关基因、ABC 转运蛋白和TonB 依赖的受体表达量都显著上升至少8倍以上(图5B)。该结果表明,A1501中fur突变导致了铁转运的表达量上升从而导致了细胞内铁含量升高。
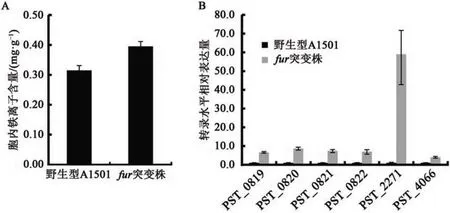
图5 野生型A1501和fur突变株胞内铁元素水平Fig.5 Intracellular iron level between wild type A1501 andfurmutant
2.4fur基因突变对菌体过氧化氢冲击的影响
细胞内过量的铁会对细胞产生毒性:胞内铁离子含量的增加会引发芬顿反应,产生大量的自由基对细胞产生氧化损伤[25]。过氧化氢是可以引起细胞氧化损伤的成分,本研究检测了野生型A1501、fur突变株及回补株在过氧化氢冲击下的存活率并对fur基因突变前后菌株的氧化应激耐受能力进行了比较。结果如图6 所示,fur基因突变后,菌株的抗氧化胁迫能力明显减弱,经H2O2冲击后的fur突变株存活率较野生型明显降低约3 个数量级,而回补株C-fur与野生型A1501 差异不显著。
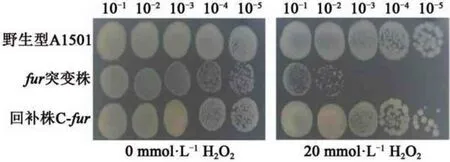
图6 H2O2冲击条件后野生型A1501、fur突变株及回补株存活率的比较Fig.6 Comparision of survival rates among wild type A1501,furmutant and complementary strain after treatment with H2O2
通过分析H2O2冲击前后fur突变株的存活情况,我们推测fur可能参与了A1501 的抗氧化胁迫调控。本研究进一步选取了A1501中可能与氧化胁迫相关的5 个基因——超氧化物歧化酶sodB(铁超氧化物歧化酶)、sodC(铜超氧化物歧化酶)、katE(过氧化氢酶)基因和2 个谷胱甘肽过氧化物酶编码基因(分别由PST_1360 和PST_2535编码)进行了qRT-PCR 分析。结果表明,在过氧化氢冲击条件下,fur突变株中sodB基因表达显著下调(图7),其他基因的变化并不显著。SodB 蛋白是以铁离子为核心的超氧化物歧化酶,由此推测,fur可能通过某种机制调控sodB基因的表达,并进而影响了菌体的抗氧化胁迫能力。
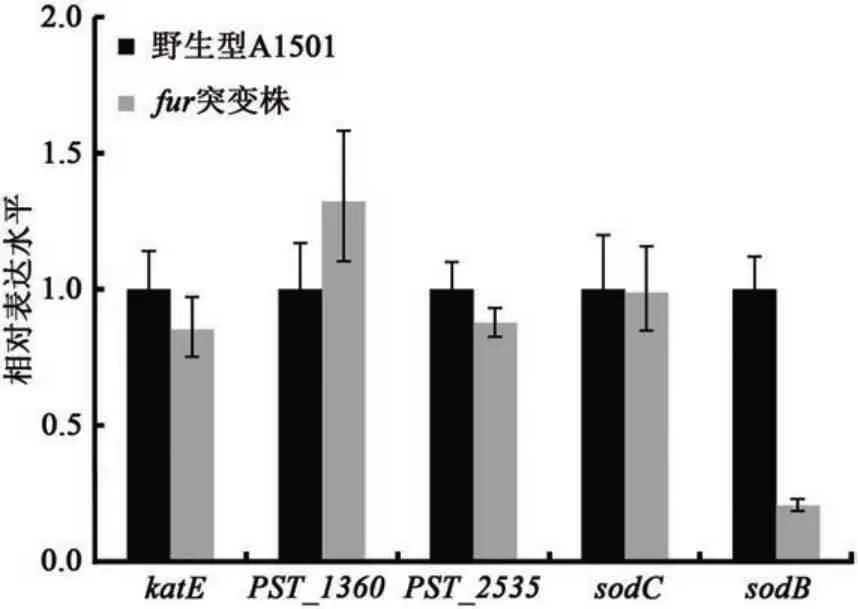
图7 qRT-PCR检测H2O2冲击条件下野生型A1501、fur突变株氧化胁迫相关基因表达Fig.7 Expression of oxidative-response genes in wild type A1501,furmutant after treated with H2O2by qRT-PCR
3 讨论
自然环境中,大多数微生物并不能完全“积极”地生长。正如对植物抗性研究一样,关于微生物的研究也越来越多地考虑到胁迫耐受以及竞争关系和生理或生物干扰等诸多因素[26]。微量元素是所有植物生长的必需营养素,但与C、H、O 等大量元素不同,植物对微量元素的需求量少,即营养缺乏与过量毒害之间的含量范围很小[27]。对于植物根际微生物来说,如何高效适应根际环境中不断变化的微量元素显得尤为重要。目前微生物学领域对于Fe 和Mg 等关键酶辅因子吸收、利用及相关稳态的相关研究大多集中在致病细菌,如铜绿假单胞菌等[28]以及根瘤菌等物种[4]。
施氏假单胞菌A1501生物固氮的核心组分是固氮酶,其一般由铁蛋白和钼铁蛋白两个组分组成,其结构中共需34 个铁原子[29]。因此,A1501的高效固氮和根际定殖同样需要很多含铁蛋白的参与。在关于A1501 的早期研究中,Yan 等[18]发现该菌基因组上存在1个由11个转录单元构成的49 kb的固氮岛,该固氮岛内许多基因直接编码了含铁酶或铁硫簇。关于这些蛋白表达模式的相关研究中,除了已知受到NifA-RpoN 的调控外[20,30],其他转录调控因子是否对这些固氮相关基因表达存在直接或间接的调控作用等相关研究尚未开展。由于这些固氮相关基因(如nifHDK、nifU和hesB等)所编码的产物蛋白的生物学活性的形成及生物学功能的发挥均需要大量的铁作为辅基,因此我们推测这些基因的表达可能受到Fur 蛋白的影响。
Fur 蛋白经证实是一个重要的全局调控因子。在不同的细菌中,其调控的靶标存在差异。在革兰氏阴性菌中,Fur 的一个基本功能是调控铁吸收和转运体系。通过控制铁转运系统的表达来维持菌体内的铁稳态。本研究发现,A1501中,fur的突变导致了细菌铁吸收系统解除抑制,进而导致了胞内铁含量的升高,说明在A1501 中fur的基本功能也与其他假单胞菌属中Fur 蛋白功能相似,是铁吸收的一个调控基因[31]。该基因可以抑制A1501中参与铁吸收与运输的依赖于嗜铁素的铁吸收系统,该系统一般由嗜铁素、特异性的受体、ABC转运系统和TonB 系统组成[32]。通过荧光定量数据分析,本研究发现A1501 中该系统与其他细菌中一样,也受到了Fur 的负调控。由于细胞内铁含量的升高,可能导致了芬顿反应产生过多的自由基对细胞产生了损害,降低了对氧化胁迫的抗性[33]。在幽门螺旋杆菌中,apo-Fur 可以激活sodB基因的表达[11],从而调控细胞对氧化胁迫的抗性,而A1501 中是否存在这一直接调控途径还有待进一步研究。
通过正常条件下和铁缺乏条件下生长曲线的测定,本研究发现,突变株对铁缺乏的胁迫更敏感,这与前面的fur突变导致细胞内铁含量升高的结果并不矛盾,分析原因为Fur 的缺失引起了包括铁吸收和利用在内的铁稳态系统的紊乱,由于铁吸收是受到Fur 负调控的,所以导致了细胞内铁含量的升高;而其他Fur 调控涉及TCA 循环、呼吸作用等的基因有一大部分是受到了Fur 的正调控。由于fur的缺失,A1501 的维持铁吸收和铁代谢的稳态系统已经被破坏,一方面导致了突变株细胞内铁含量的升高,另一方面导致了细胞对缺铁环境的抗性降低。
综上所述,本研究初步解析了A1501 中Fur蛋白在铁离子运输和氧化胁迫适应中的功能,即Fur 蛋白在高浓度铁环境下表达下调,对铁转运基因表达存在负调控作用,维持了菌株铁稳态平衡,此外Fur 通过正调节sodB基因表达参与菌株的氧化胁迫适应,从而降低铁过量导致的芬顿反应对细胞的损害。未来的研究将在此基础上进一步聚焦Fur 蛋白调控相关基因的分子机制,同时探索Fur 蛋白对固氮酶表达的影响,为进一步探究A1501适应生境铁并调节固氮过程的分子机制奠定理论基础。
