电子表格工具在定性体外诊断试剂临床试验数据统计中的应用
2022-05-28国家药品监督管理局医疗器械技术审评中心100081
国家药品监督管理局医疗器械技术审评中心(100081)
高 宇 吕允凤
体外诊断试剂的临床试验是指在相应的临床环境中,对体外诊断试剂的临床性能进行的系统性研究[1]。对于定性体外诊断试剂,通常是以经典的诊断试验为基础[2],根据被测标志物的性质及相应的临床应用,将试验用体外诊断试剂的检测结果与已公认的“金标准”结果或已上市体外诊断试剂的检测结果进行比较,评价其临床性能。
根据法规要求[3],体外诊断临床试验所得到的数据在提交注册时需要对试验结果进行汇总,完成总结报告。在实际的操作过程中通常使用电子表格工具,如金山WPS表格、微软excel,对试验信息进行汇总,打印后由操作者、复核者签字、临床试验机构盖章,作为临床试验报告的附件提交至监管部门。利用电子表格工具可以完成经典的诊断试验评价[4]。但由于体外诊断试剂临床试验需根据被测标志物、试剂性能及临床用途等因素进行综合分析评价,以证明所申报的试验用体外诊断试剂符合其预期用途且性能满足临床需求,因此需要在经典诊断试验评价的基础上对评价方法进行扩展。本文以金山WPS表格为例,根据体外诊断试剂临床试验数据统计、评价工作的实际,在经典的诊断试验评价的基础上对定性体外诊断试剂性能的参数估计、多标志物联合风险预测模型、分层分析方法及不一致结果分析的实现过程进行了介绍,以期为行业临床评价工作提供参考。
四格表分析
使用电子表格工具对于临床试验数据进行四格表分析,是对原始数据进行转换,对转换后的数据进行四格表中四种情形的判定,并对符合相应情形的样本数量进行统计。以图1所示数据表为例进行四格表分析。在临床数据表格中通常包括受试者(样本)编号、年龄、性别、样本类型、临床诊断结果、考核试剂检测结果等数据列。
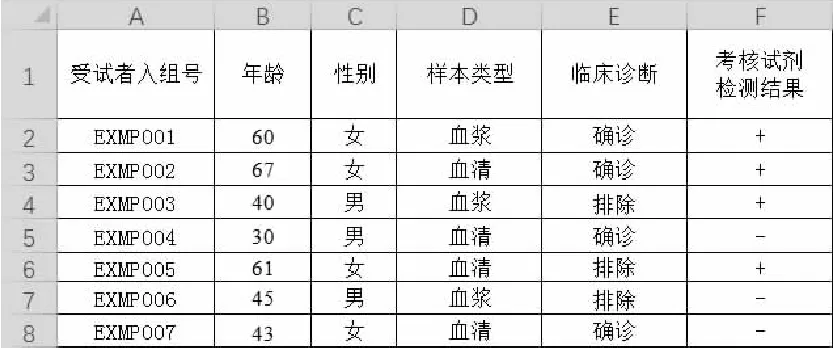
图1 定性试剂临床试验数据汇总表
其中用于四格表分析的为“临床诊断”列与“考核试剂检测结果”列。首先需利用IF条件函数对上述结果进行转换,将“临床诊断”中的“确诊”以及“考核试剂检测结果”中的“+”转换为“1”;将“临床诊断”中的“排除”以及“考核试剂检测结果”中的“-”转换为“0”。IF条件函数结构为IF([逻辑判断公式],[为“真”的值],[为“假”的值]),例如对临床诊断列的判断公式为“IF([临床诊断]=”确诊“,1,0)”。根据该公式在原始数据表右侧两列填充转换后的数据,并根据四格表的定义(见表2)进行判定,根据判定规则生成相应的判定结果。

表2 四格表结果的判定规则
数据转换后在表格中绘制四格表。根据如表1所示四格表定义,通过COUNTIF函数(如图3所示)统计图2“四格表”列中相应字母的数量,通过求和函数(SUM)获得“总和”格子的数值。

表1 “金标准”的检测结果与申报试剂检测结果四格表
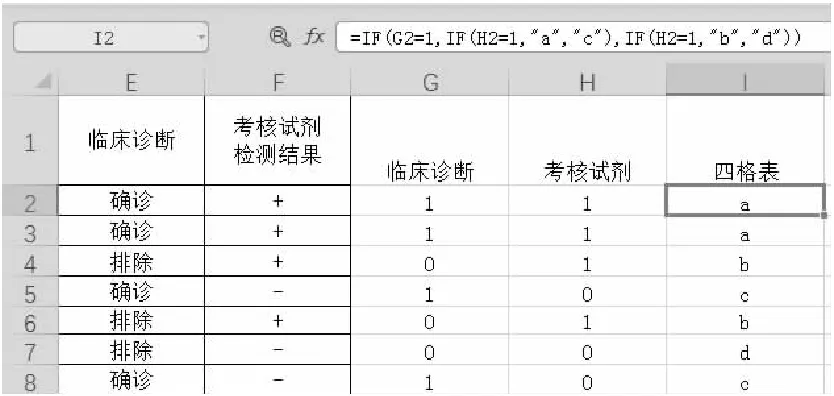
图2 四格表判定公式及判定后的临床试验数据汇总表
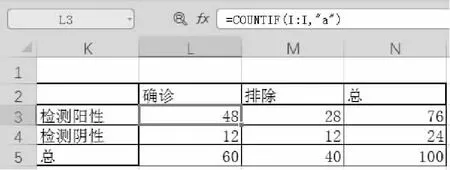
图3 四格表结果汇总公式及结果
体外诊断试剂临床性能的主要评价指标为灵敏度、特异度及总符合率。根据灵敏度、特异度及总符合率的定义在四格表下方表格分别计算点估计值。区间估计建议按照威尔逊分值法5进行计算(公式见图4),以避免试验用体外诊断试剂检测结果与对比方法结果符合率为100%的情况下,按二项分布近似正态公式无法计算置信区间。
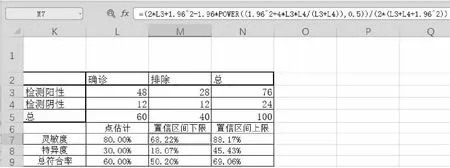
图4 四格表统计结果及置信区间下限计算公式
多标志物联合风险预测模型相关计算
进行体外诊断试剂检测得到的直接结果通常是连续分布,需通过实验室阶段经充分研究所设定的截断值(cut-off值)转化为符合二项分布的阴、阳性结果。如截断值为针对单一标志物检测结果,可以使用IF条件函数进行转换,转换公式为“=IF([检测结果]>[截断值],1,0)”。但随着生物医学的发展,多标志物联合检测预测疾病风险模型逐渐成为行业热点。
假设一种检测试剂包含三个被测物(M1、M2、M3);每种检测结果均以42为截断值,大于42为阴性、小于或等于42为阳性;三个标志物的分值均为1分,风险的截断值为2(即三个标志物任意两个为阳性便报告阳性)。临床试验病例信息汇总表如图5所示。

图5 三标志物定性检测试剂临床试验数据汇总表
首先在病例信息汇总表右侧三列对检测结果进行判断。使用条件公式“=IF([检测结果]>42,0,1)”对检测结果进行判断,公式中的“1”为该标志物分值。对于转换后的以1/0表示的结果可使用加和的方式进行判断(SUM)。由于三个标志物分值均为1分,截断值为2,因此上述三个指标的加和结果为2和3时,该检测便报告阳性。可以使用IF条件函数“=IF([加和结果]>1,1,0)”对检测结果进行判定,得到以1/0表示的检测结果(T),并对所得检测结果使用第一部分所述方式进行临床性能的评价。
分层分析
在进行体外诊断试剂临床性能评价的过程中需要根据试剂的预期用途、临床特点对其中某类人群进行单独分析或不同人群的差异性进行分析,称之为分层分析(stratified analysis)。分层因素可以是通过受试者基线信息直接得到,亦可是通过基线信息进行二次分析得到。

图6 三标志物试剂四格表的判定及公式
例如一项检测其预期用途的样本类型为咽拭子或痰液。在总体性能可以满足临床需求的情况下,还需针对两种不同样本类型进行分别的评价。其病例信息汇总表如图7所示,表中已完成整体性能四格表统计。
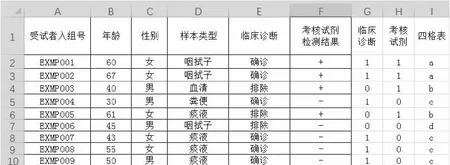
图7 多样本类型定性检测试剂临床试验数据汇总表
可以看到,在样本类型中包括了“咽拭子”、“血清”、“痰液”、“粪便”等样本类型。首先需要通过条件判断语句生成样本类型列,由于样本类型包括多种样本类型,因此需要通过嵌套条件公式进行判断。公式为“IF([样本类型]=”咽拭子“,1,IF([样本类型]=”痰液“,2,3))”,将“咽拭子”转换为1、“痰液”转换为2、其他样本类型转换为3。之后将转换后的结果作为逻辑判断条件对“四格表”列判断结果进行筛选,将符合目标样本类型的四格表结果保留,而不相关样本类型的结果用其他符号表示。其公式为“=IF([转换后样本类型]=1,[四格表结果],“z”)”,将样本类型转换后为“1”(咽拭子)的结果保留至“咽拭子四格表”列,将其他样本类型转换为字母“z”。用同样的方式可以将样本类型转换后为“2”(痰液)的结果筛选至“痰液四格表”列。之后分别对“咽拭子四格表”列和“痰液四格表”列使用第一部分“数格子”的方法进行四格表统计并完成针对两种不同样本类型的临床性能参数估计。

图8 多样本类型定性检测试剂分层分析临床试验病例信息汇总表
对于通过基线信息进行二次分析的结果进行分层,可以结合第二部分截断值的判断方法进行。若某一标志物浓度会根据病程的不同而发生高低变化,例如病程早期及治疗后期相对较低,病程中期相对较高,当截断值一定的情况下早期及治疗后期假阴性率会较高,而病程中期检测灵敏度会有很好的表现。由于临床试验为连续入组,整体分析的情况下试剂性能可能并不理想,因此需要针对病程进行分层分析。首先,需要通过受试者基线信息获得采样日期距离发病日期的间隔,通过临床上对于发病后不同时程的截断值(例,以7天、14天作为三分类的两个截断值)对采样时的病程进行分期,分析方法与第二部分对连续分布检测结果的处理方法是一致的,对于上述例子可用“1”表示早期、“2”表示中期、“3”表示治疗后期。当获得分期后根据分期列的数据作为分层因素对四格表的数据进行有条件保留,分析方法与上面的分层分析方法一致,在“早期四格表中”把分期为“1”的数据保留,其他的分期数据用“z”表示。“中期四格表”、“后期四格表”列亦如此处理。最后对“早期四格表”、“中期四格表”、“后期四格表”采用第一部分“数格子”的方式进行统计,完成按病程分层分析的试剂性能参数估计。
不一致结果的分析
在进行临床试验数据分析时,不仅要通过统计学方法得到临床性能的参数估计,还需要注意针对异常结果进行分析。例如,通过对四格表中“b”、“c”格以及根据标志物特性判定为异常值的受试者的背景信息等进行分析,发现是否会在具有某一特征的受试者中有趋势性的提示信息。在进行分析时,主要使用表格工具的数据筛选功能对受试者基线信息进行展示分析。
虽然本文为定性体外诊断试剂的分析方法,但此部分选择一定量检测试剂的临床试验数据进行举例,亦可清晰说明不一致数据的筛选和分析方法。图10显示的是一个乙型肝炎病毒核酸定量检测试剂盒的临床试验结果。根据国家药品监督管理局发布的《乙型肝炎病毒脱氧核糖核酸定量检测试剂注册技术审查指导原则》6,临床试验需要入组不少于450例乙肝病毒感染受试者,其中需不少于10例的D基因型乙肝病毒感染受试者。考核试剂与对比试剂定量检测值的对数差值大于1是两个定量试剂检测结果不一致的判定标准之一。通过图中可以看出,在进行临床数据分析时,首先计算了考核试剂与对比试剂的定量结果的对数值(第AA、AB列),然后计算对数值的差值(AC列),通过IF条件判断对数值差值是否大于1(AD列),之后对对数值差值大于1的受试者进行筛选展示。该临床试验共入组乙型肝炎受试者496例,对数值差值大于1的受试者为17例。进一步对对数值差值大于1的受试者进行筛选展示后发现,D基因型感染受试者有9例。而该临床试验共入组15例D基因型感染受试者,检测的偏离有显著的在D基因型中集中趋势。因此在临床评价时需要针对D基因型进行分析,同时评价试剂针对D基因型的检测性能能否满足临床需求。

图9 基于病程分层分析的定性检测试剂临床试验病例信息汇总表
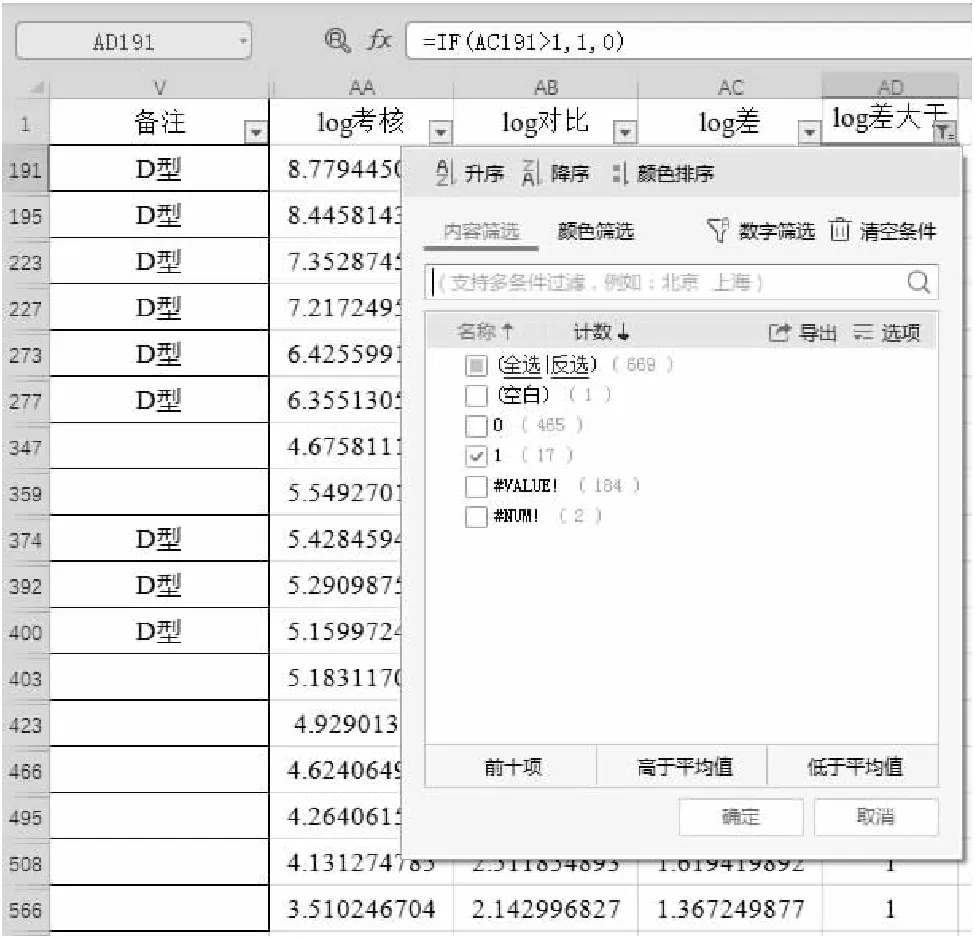
图10 根据检测结果的对数值差值进行筛选展示的病例信息汇总表
对于定性检测试剂的不一致结果的分析,可在临床试验数据统计的过程列中勾选判定为“b”和“c”的受试者进行分析。
讨 论
体外诊断试剂临床试验的评价主要基于流行病学中诊断试验、筛检及队列研究章节的研究方法,需要对人群特征及检测结果进行分析,是流行病学调查的一个特例。使用电子表格软件对电子病历信息汇总表直接进行统计分析可以保证与提交至监管部门文件的一致性,同时大大提高申报和审评效率。由于在形式上类似于在纸质病例信息汇总表旁的空白处进行数据的统计、验算,因此可以将这样的统计方法命名为“表旁统计”。
在进行电子表格统计时,应当注意数据结构的完整性及数据的准确性。数据结构的完整性主要通过病例信息汇总表表头控制,进行临床试验的各临床试验机构应使用结构(表头)相同的病例信息汇总表。同时对数据结构相同的电子病例信息汇总表在分析时可直接粘贴统计单元格,无需重复录入公式。而数据的准确性不仅是病例信息汇总表中的数据与原始病例信息表中一致,同时要注意信息表达方式的一致性。例如,各临床试验机构之间应当注意“阳性/阴性”、“+/-”的表达一致性。此外,在实际的工作中,病例信息汇总表中不可见的“空格”是导致在后续统计过程中产生统计结果错误的重要原因之一。
使用电子表格工具对电子病例信息汇总表数据直接进行统计分析,可有效避免数据转换的错误、人工数据统计的错误,同时大大提高数据统计效率。本文为一般情形下的二分类临床数据使用电子表格工具统计分析的举例,具体产品应根据实际情况进行灵活运用,亦可选择其他统计工具软件。
应当注意,虽然电子表格工具作为申报、审评审批过程中的核对工具可提高效率,但由于无法保留稽查轨迹,在临床试验数据管理方面并不推荐。
(注:本文中所列举数据及统计结果仅为方法举例,不代表真实产品的统计结果。不同产品的性能估计能否符合临床性能要求视具体产品的临床要求确定。)
