以羧基化石墨烯量子点为载体的荧光-磁共振双模态分子探针的制备及体外研究
2022-05-28李忠涛陈颂郝利国郭靖谷弘谦刘强王丽王雷李国华
李忠涛,陈颂,郝利国,郭靖,谷弘谦,刘强,王丽,王雷,李国华
1.齐齐哈尔医学院附属第一医院 影像科,黑龙江 齐齐哈尔 161041;2.齐齐哈尔医学院 a.药学院药物化学研究室;b.医学技术学院分子影像研究室,黑龙江 齐齐哈尔 161000;3.齐齐哈尔医学院附属第三医院 放射影像中心,黑龙江 齐齐哈尔 161000
引言
磁共振成像(Magnetic Resonance Imaging,MRI)具有多方向性和多参数的成像特征,可以显示解剖结构的细节并提供其他信息,但细胞、分子水平成像灵敏度较低。荧光成像技术依靠外界能量激发荧光物质,引起电子的跃迁并在返回基态的过程中产生可被检测的荧光信号,荧光探针具有灵敏度高、非侵入性、实时成像等优点,微量的荧光物质即可在细胞水平上观察成像。因此,MRI荧光双模态成像可以为疾病的诊断和治疗提供更多有用的信息,逐渐成为研究热点。近年来,已有多篇文章报道磁共振显像剂结合荧光物质合成多功能探针的报告[1-3]。石墨烯量子点(Graphene Quantum Dots,GQDs)是石墨烯的衍生物,有着独特的光学性质[4-5]。有研究表明,与其他石墨烯衍生物相比(如氧化石墨烯),GQDs有着较好的生物相容性、较低的生物毒性[6-7]。作为一种新型的荧光材料,GQDs具有抗光漂白能力、优良的光学性能[8]。因此,GQDs与其功能化材料已在生物成像、药物输送等领域被广泛应用。Gd3+因其具有7个不成对的电子,可以降低组织内氢质子的弛豫时间,T1成像呈现高信号;与大分子螯合物结合后失去细胞毒性,被广泛应用于临床显像如钆喷酸葡胺;新型Gd基造影剂的开发也在进行[9]。本研究将磁共振T1正向对比剂Gd3+负载于GQDs上,其中GQDs作为载体与荧光显像剂,合成双模态分子探针,讨论制备探针的理化性质并探讨其细胞成像与小动物成像潜能;本研究的主要目的是为GQDs载药研究及靶向探针的制备奠定一定基础。
1 材料与方法
1.1 试剂与仪器
(1)试剂耗材。肝癌细胞HepG2、甲状腺癌细胞FRO、肺癌细胞A549购自中国科学院上海细胞库。GQDs购自先丰纳米材料科技有限公司。N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)及 1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid,DOTA)购自艾览化工科技有限公司。1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC)购自Adamas,聚乙二醇双胺(H2NPEG-NH2,M.W2000)购自 Sigma,GdCl3·6H2O 购自上海阿拉丁试剂公司。
(2)仪器设备。荧光分光分度计(RF-5301PC,日本岛津);紫外分光光度计(UV-2550,日本岛津);傅立叶转换显微红外光谱仪(Nicolet-IN10,美国赛默飞世尔);透射电镜(HT-7700,日本日立);粒度分析仪(NICOMP-380ZLS,美国PSS);3.0 T磁共振(Achieva,飞利浦);多功能酶标仪(SAFIRE2,瑞士Tecan);冷冻干燥仪(HXLG-12-50D,上海沪析);NM120核磁共振造影剂弛豫率分析与成像系统(苏州纽迈分析仪器股份有限公司);电感耦合等离子体质谱-质谱仪(ICP-MS,Agilent 770s,美国);美国光谱医学即用型透析袋(截留分子量3500 Da),实验所用溶液均用去离子水配置。
1.2 Gd@GQDs的制备
分别精确称取H2N-PEG-NH2(M.W2000)和DOTA(摩尔比为4:1),放入含有EDC的溶液中,使用0.01 mol/L的盐酸溶液将溶液pH调整到6,加入NHS,混匀后室温搅拌12 h后,加入100 mL(0.1 mg/mL)羧基化GQDs溶液,再次室温搅拌12 h后,以去离子水为透析液将未反应的EDC/NHS除去,得到产物H2N-PEG-DOTA-GQDs;将GdC13.6H2O加入GQDs-DOTA的醋酸钠缓冲液(pH 5.5)中搅拌24 h,将Gd3+鳌合于DOTA中,多余的Gd3+以透析的方法除去。最后,将所得到的Gd@GQDs冻干待用。
1.3 Gd@GQDs的表征检测
用透射型电子显微镜观察形态、大小、分布等,用紫外-可见光分光光度计、荧光光谱仪检测光学性质,用傅立叶变换红外光谱检测表面官能团,用粒度分析仪检测水合粒径及Zeta电位。
1.4 Gd3+浓度的测定
将钆元素溶液标准物质加入硝酸溶液中,配置成不同浓度的标准液。用ICP-MS测定所配置标准液,以浓度对信号强度作图,得到标准曲线。将样品混匀后,准确称取5 mL样品至50 mL消解容器中,加入1:1硝酸,放入石墨加热板120~200 ℃消解20~60 min,至样品消解完全,赶酸,冷却后过滤,定容至10 mL量瓶中上仪器测试。结合标准曲线,即可得到Gd3+量。
1.5 弛豫性能检测
使用飞利浦3.0 T磁共振扫描仪获取Gd@GQDs(Gd3+浓度0、0.1、0.2、0.3、0.4、0.6和0.8 mmol/L)的T1加权T2加权MR图像。T1图是使用反转恢复序列获得的,参数如下:TR/TI 2000/800 ms,TE 20 ms,矩阵 232×139,层厚4 mm,FOV 230 mm×198 mm。T2加权图像参数如下:TE 108 ms,TR 4000 ms,矩阵256×256,切片厚度4 mm,FOV 230 mm×230 mm。使用NM120核磁共振造影剂弛豫率分析与成像系统,使用反转恢复序列进行分析,具体参数如下 :SW 100 kHz,TW 3000 ms,RFD 0.08 ms,NS 4,TE 1 ms,NTI 25。分别检测其中4个样品(Gd3+浓度为0.1、0.2、0.6和0.8 mmol/L)对应的纵向弛豫时间T1,横坐标为Gd3+浓度,纵坐标为1/T1,将所得坐标点数据使用origin 8软件进行拟合,所得拟合曲线的斜率即为Gd@GQDs的弛豫率r1。
1.6 细胞培养
复苏HepG2、FRO、A549细胞,分别接种于含青霉素/链霉素与10%胎牛血清的RPMI 1640培养基中,在37 ℃、5% CO2培养箱中培养,取对数生长期细胞进行相关实验。
1.7 细胞毒性实验
为评价制备探针的体外细胞毒性,使用CCK-8法检测细胞毒性。将HepG2、FRO、A549细胞分别置于不同的96孔板中,每孔加入细胞悬液100 μL,37℃预孵育96孔板。贴壁过夜后,弃旧培养基,加入新培养基,分别在每孔中加入不同浓度(0、25、50、75、100、150和200 μg/mL)Gd@GQDs溶液,每组设置6个复孔,孵育24 h,然后在各孔加入10 μL的CCK-8溶液,孵育3 h。只存在培养基与CCK-8溶液的为空白组。使用多功能酶标仪测量在490 nm波长的吸光度。细胞毒性测定方法为将细胞存活率与对照组比较。计算公式为:细胞活力(%)=[A(加药)-A(空白)]/[A(不加药)-A(空白)]×100%。
1.8 统计学分析
纳米粒径使用Nano Measure 1.2软件分析,所得数据使用SPSS 13.0软件分析,计量资料用±s表示,组间比较使用单因素方差分析,P<0.05为差异具有显著性。
2 结果
2.1 Gd@GQDs的表征
Gd@GQDs冻干后呈白色粉末状;在制备过程中,液体均为无色透明状态,未见絮状物沉积,水溶性好。TEM图如图1a所示,平均粒径约为(31.58±11.82)nm,呈圆形,大小较为一致,分散性良好;水合粒径如图2所示,平均粒径为(39.7±21.5)nm,呈正态分布;Zeta电位测试结果如图3所示,Gd@GQDs电位为-17.95 mV。

图1 Gd@GQDs的表征

图2 水合粒径

图3 ZETA电位
考察Gd@GQDs在PBS、DMSO和1640溶液中的稳定性。图4a显示,Gd@GQDs可以均一地分散在不同的溶液中;图4b为静置7 d后,各个溶液状态未出现明显改变。

图4 Gd@GQDs的稳定性
Gd@GQDs在不同激发波长下的荧光光谱图如图5所示,最适激发波长为350 nm左右,在手持紫外灯照射下呈蓝色,随着激发波长的增加,出现发射波长随之增加的量子点典型特征;紫外吸收光谱如图6所示,Gd@GQDs的紫外吸收曲线在240 nm出现明显的特征吸收。

图5 Gd@GQDs在不同波长下的荧光光谱

图6 紫外吸收光谱
Gd@GQDs的红外光谱图如图7所示,Gd@GQDs在3404 cm-1出现了OH的伸缩振动峰,2886 cm-1饱和C-H的伸缩振动峰,1620 cm-1C=O双键的伸缩振动峰,1111 cm-1聚乙二醇中醚的伸缩振动峰。
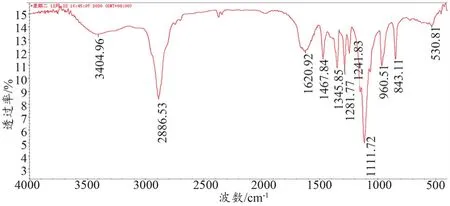
图7 Gd@GQDs的红外光谱
2.2 弛豫性能检测
ICP-MS结果显示Gd3+掺杂质量分数为2.46%。如图8所示,随着Gd3+浓度的增高,T1加权MR图像亮度随之增加,呈明显阳性信号,图中纯水为低信号;T2加权图像显示水为高信号。且随着Gd3+浓度的增高,T2加权MR图像亮度随之降低。表1为NM120核磁共振造影剂弛豫率分析与成像系统测量Gd@GQDs纵向弛豫时间的结果。图9为线性拟合后所得直线方程,结果显示Gd@GQDs的弛豫率为r1=9.05 mM-1S-1,大于临床所用钆喷酸葡胺弛豫率,相关性为R2=0.998,呈现正相关。

表1 不同Gd3+浓度下的T1弛豫时间

图8 加权成像图
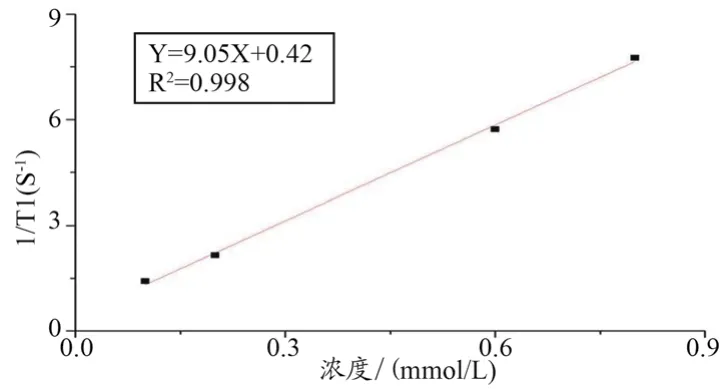
图9 T1弛豫时间线性拟合
2.3 细胞毒性实验
使用CCK-8法评估Gd@GQDs的细胞毒性,WST-8在电子载体的作用下被细胞线粒体中的脱氢酶还原为具有高度水溶性的黄色甲臜产物,生成的甲臜物的数量与活细胞的数量成正比。用多功能酶标仪在490 nm波长处测定其光吸收值,可以反映活细胞数量。HepG2、FRO、A549细胞在不同浓度的(25、50、75、100、150、200 μg/mL)Gd@GQDs 中培养 24 h 的细胞存活率结果如表 2 所示,结果显示,不同浓度的Gd@GQDs 作用于上述细胞24 h后,均显示出较高水平细胞存活率(>70%)。

表2 细胞存活率(%)
3 讨论
纳米材料与纳米医学的发展,为生物标记提供了新的思路[10]。GQDs作为石墨烯家族的新成员,通常由较小的石墨烯碎片组成,不仅具有石墨烯的特性,还具有量子点的量子限域效应、量子隧道效应以及边缘效应[11-12]。GQDs在生物医药中进行了广泛的应用,如标记神经干细胞[13]、Hela细胞[14]等,负载治疗药物如阿霉素、MTX[15-16]。李大鹏等[17]还研究了GQDs对膀胱癌T24细胞的作用,发现经激光照射后GQDs对细胞有明确的杀伤作用。目前已有GQDs结合磁共振材料合成双模态分子探针的研究报告[1-3]。但既往研究尚缺乏新型材料羧基化GQDs结合磁共振T1阳性对比剂Gd3+的研究数据。
本实验将Gd3+通过大分子螯合物修饰,与双氨基聚乙二醇一同连接到载体羧基化GQDs上,制备了荧光-磁共振双模态探针,证实了探针制备的路线及应用于体内外标记领域的可行性。本次实验制备的Gd@GQDs由TEM图可见,粒径约为(31.58±11.82)nm;水合粒径为(39.7±21.5)nm,呈正态分布;本次实验结果显示水合粒径较TEM结果较大可能是探针表面存在羧基等官能团及PEG修饰后表面形成水化膜所致;Gd@GQDs电位为-17.95 mV。粒径的大小、电性、亲疏水性会影响探针在体内的循环时间,粒径过大(>500 nm)或过小(<10 nm)会被网状内皮细胞截留或肾脏代谢,而肾脏毛细血管壁因带负电,倾向于清除带正电的颗粒,疏水性大的颗粒易被血液中蛋白清除[18-19]。本实验合成的探针粒径为10~100 nm,经PEG修饰后亲水性良好,带负电,在体内可拥有更长的体内循环时间,可保证探针在病变部位富集,图4a的结果也证明合成的Gd@GQDs在不同的溶液中具有良好的分散性与稳定性,为其作为理想的载药探针提供了保证。制备的探针具有较低的细胞毒性,CCK-8法检测细胞毒性的结果显示,当Gd@GQDs浓度为100 μg/mL时,HepG2、FRO、A549,3种细胞活度仍在90%左右,浓度为200 μg/mL时3种癌细胞的存活率都在70%以上,表明该探针细胞毒性较低,其原因可能有以下三点:① Gd3+螯合在大分子DOTA中,而非以游离态形式存在[20-21];② GQDs具有较低的生物毒性;③ Gd@GQDs纳米探针外围修饰有聚乙二醇与大量的亲水官能团以保证探针的亲水性。图6紫外吸收与图7红外光谱图中特征吸收峰可证明探针制备成功[21-25];MR图像结果显示Gd@GQDs作为T1阳性对比剂的潜力,使用纽迈磁共振检测得到Gd@GQDs的r值为9.05 mM-1S-1,远大于临床用钆喷酸葡胺的弛豫率(约为2倍),这意味着较钆喷酸葡胺,可以使用更少的Gd@GQDs来达到同样的成像效果,具备应用于小动物体内MRI的应用前景,Gd@GQDs具有很高弛豫率的原因是:相较于小分子造影剂,大分子造影剂因其尺寸较大,可以改善整个分子的磁学性质,减缓分子的旋转运动,提高弛豫率。
综上所述,本次实验证明了新型材料羧基化GQDs与Gd3+合成双模态探针的可行性,其稳定性好、细胞毒性低,具备体外荧光成像及MRI的应用前景;为进一步实验奠定了一定基础,如石墨烯通过π-π共轭载药研究;或进一步对MRI进行研究,如研究探针体内清除速率等;或利用GQDs较大的比表面积连接单抗或小分子抑制剂等靶向基团,从而实现靶向探针或者诊疗一体化探针的制备。
