小鼠第13.5 天胚肝细胞诱导HepG2 细胞分化的作用机制
2022-05-28肖志刚王梓瀛瑜齐锦生栗彦宁
肖志刚 郑 丽 王梓瀛 刘 昆 王 瑜齐锦生*栗彦宁
(1.河北医科大学中西医结合学院,石家庄 050017;2.河北医科大学实验动物学部,石家庄 050017;3.邢台医学高等专科学校,河北 邢台 054000)
原发性肝癌是全球第四位的致死性癌症,我国肝癌发病人数占全球一半以上,其中,肝细胞来源的肝细胞肝癌(hepatocellular carcinoma,HCC)约占90%,是原发性肝癌中最常见的类型[1]。目前,针对HCC 治疗主要以手术切除为主,切除率低及复发率高等,严重影响了病人生存率,亟需治疗新思路[2-3]。基于胚胎干细胞和肿瘤细胞有很多共同特性,例:可塑性、永生化、免疫逃逸等,齐锦生教授提出“同源同步诱导分化”理论,即肿瘤是发育受阻于某个阶段而无限增殖的“干细胞”或是“返祖细胞”,而胚胎发育过程包含了所有组织细胞的所有发展阶段,用相同组织来源、发育阶段匹配的胚胎干细胞可诱导相应肿瘤细胞分化,且根据越原始越相似的理论,这种诱导作用是不受种属限制的[4-6]。在此理论指导下,本课题组前期研究证实小鼠第13.5 天胚肝细胞可诱导HepG2 细胞株分化,但机制尚未阐明[5-6]。已知,高度保守的Wnt/β-Catenin 信号通路与发育、分化等密切相关,也是促进HCC 分化的重要因素[7-8]。那么,小鼠第13.5 天的胚肝细胞是否通过调控β-Catenin,诱导HepG2 细胞株分化,尚不清楚。本文以小鼠第13.5 天胚肝细胞与HepG2 细胞株体外共培养模型,研究了小鼠第13.5 天胚肝细胞调控β-Catenin,诱导HepG2 细胞株分化机制,为HCC 治疗提供新的理论依据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
清洁级健康KM 小鼠,雄鼠30 只,雌鼠90 只,体重25~30 g,6~8 周龄,由河北医科大学实验动物中心提供[SCXK(冀)2018-004],饲养条件如下:自由进食和饮水,温度约25℃,湿度约50%,12 h 光照/12 h 黑暗,在河北医科大学实验动物中心饲养动物[SYXK(冀)2018-008],动物实验经由实验动物管理委员会批准(2018-0042),实验过程中严格遵循实验动物使用的3R 原则,给予人道主义关怀。
1.1.2 细胞
人肝癌细胞HepG2,购自中国科学院上海生命科学研究院细胞库(TCHu 72)。
1.2 主要试剂与仪器
胎牛血清购自北京全式金公司(货号:FS101);Gibco 的DMEM 培养基(货号:C11885500BT)购自Life Technology 公司;Millicell 细胞培养小室(货号:PICMORG50)购自美国Millipore 公司;β-Catenin 抑制剂XAV-939 购自Selleck(货号:S1180);白蛋白(ALB,货号:sc-271605)、甲胎蛋白(AFP,货号:sc-8399)、肝细胞核因子4α(HNF-4α,货号:sc-374229)、β-Catenin 抗体(货号:sc-7963)、β-actin(货号:sc-8432)购自美国Santa Cruz 公司;TRITC 标记二抗(货号:BA1089) 购自博士德公司;DAPI (2-(4-Amidinophenyl)-6-indolecarbamidine dihydrochloride,货号:D9542-1MG)购自SIGMA 公司;TRIzol 试剂(货号:15596-026)购自美国Invitrogen 公司;反转录试剂盒(货号:K1622)购自Thermo Fisher Scientific 公司;qPCR 试剂盒(SYBR® Premix Ex TaqTMⅡ,货号:RR820A)购自日本TaKaRa 公司;PCR 引物由上海捷瑞生物工程技术服务有限公司合成;0.45 μm PVDF 膜(货号IPVH00010)购自美国Merk miliplore公司。二氧化碳培养箱(英国NEW BRUNSWICK 公司,型号:Galaxy 170R);体视显微镜(德国Leica 公司产品,型号:S9);倒置荧光显微镜(日本OLYMPUS 公司产品,型号:IX-51);PCR 仪(美国Thermo 公司产品,型号:PX2);实时荧光定量PCR仪(中国香港Gene 公司产品,型号:Corbett Rotor-Gene 3000);Odyssey 双色红外荧光成像系统(中国香港Gene 公司产品,型号:9120)。
1.3 实验方法
1.3.1 小鼠第13.5 天胚肝细胞分离纯化
采用本实验室方法,用6~8 周龄KM 小鼠,雌鼠:雄鼠=3 ∶1 合笼,次日出现阴栓日期为妊娠0.5 d,取13.5 d 孕鼠,消毒,在体视显微镜下取出胚肝,分离成小块,采用Ⅳ型胶原酶消化。过滤网后,采用差速贴壁法纯化胚肝细胞,常规培养,备用于鉴定及共培养实验[5-6]。
1.3.2 小鼠第13.5 天胚肝细胞与HepG2 细胞株的共培养
将HepG2 细胞株置于37℃、5% CO2细胞培养箱中培养。培养液为高糖培养基,含1%的非必需氨基酸,10%的新生牛血清。利用“Transwell”小室建立小鼠第13.5 天胚肝细胞与HepG2 细胞株的非接触式共培养模型,1 mL 胚肝细胞(每毫升1×106个)培养于六孔板中“Transwell”小室上层膜上,2 mL HepG2(每毫升5×104个)培养于六孔板中,于37℃、5% CO2细胞培养箱中培养。分为对照组、共培养组,培养24、48 h 后检测相关指标。
1.3.3 β-Catenin 抑制剂处理及分组
建立小鼠第13.5 天胚肝细胞与HepG2 细胞株的共培养模型后,给予β-Catenin 抑制剂XAV-939处理,分为对照组、XAV-939 组(1 μmol/L)、共培养+XAV-939 组(1 μmol/L)、共培养组,作用48 h 后,相差显微镜观察HepG2 细胞株形态,同时检测AFP、β-Catenin 的蛋白含量。
1.3.4 免疫荧光法检测ALB 的分布
取原代胚肝细胞,4%多聚甲醛固定后,1%的TritonX-100 室温下处理30 min,10%山羊血清37℃封闭1 h。弃除封闭液,加入AFP 抗体(1:50),4℃孵育过夜,加入FITC 标记二抗(1 ∶50),避光37℃孵育1 h,加入细胞核染色液DAPI,避光室温作用15 min,滴加适量的抗荧光衰减封片液(50%甘油),盖玻片封片后荧光倒置显微镜下观察、拍照。ALB 的染色为绿色,细胞核的染色为蓝色。采用Image Pro Plus 6.0 版软件计数3 个随机视野中免疫荧光阳性细胞。
1.3.5 qRT-PCR 检测mRNA 水平
收集共培养24 h、48 h 的HepG2 细胞株,采用TRIzol 法提取RNA,并测定RNA 浓度。按照试剂盒进行反转录和PCR 反应。PCR 反应条件:95℃30 s,95℃5 s,60℃20 s,72℃20 s,第2 步至第3 步进行40 个循环。以β-actin为内参,采用2-ΔΔCt计算相关基因的mRNA 的相对表达量。引物见表1。

表1 Real-time PCR 引物序列Table 1 Primers for Real-time PCR
1.3.6 Western blot 检测蛋白含量
共培养及β-Catenin 抑制剂处理48 h 后,收集HepG2 细胞株,用RIPA 裂解液进行裂解,取上清至预冷的EP 管中,即为细胞总蛋白提取物。蛋白精准定量后,取蛋白样品每孔150 μg 经SDS-PAGE 电泳分离后将蛋白转至PVDF 膜上,5%脱脂牛奶封闭后,一抗封闭(5%牛奶1 ∶200 稀释),4℃过夜,二抗(5%牛奶1 ∶2000 稀释)室温孵育2 h,采用Odyssey双色红外荧光成像系统读取图像。将所得图片用美国UVP 公司LabWorks 4.5 软件对条带进行定量分析,计算目的条带的灰度值。
1.3.7 免疫荧光法检测β-Catenin 的分布
方法同1.3.2,共培养48 h 的HepG2 细胞株,使用β-Catenin 抗体(1:50)和TRITC 标记的二抗,检测β-Catenin 蛋白的分布。β-Catenin 的染色为红色,细胞核的染色为蓝色。
1.4 统计学方法
采用SPSS 21.0 软件进行统计学分析,所得结果采用平均数±标准差()。两组之间采用独立样本t检验分析,多组之间分析先进行方差齐性检验,组间比较采用One-Way-ANOVA 法,进一步两两比较,采用LSD-t检验,P<0.05 为有统计学差异。
2 结果
2.1 小鼠13.5 天胚肝细胞的鉴定
原代胚肝细胞分离培养后,用免疫荧光法检测肝细胞标记分子ALB 蛋白的分布。结果显示,91.84%的ALB 荧光染色阳性,见图1。
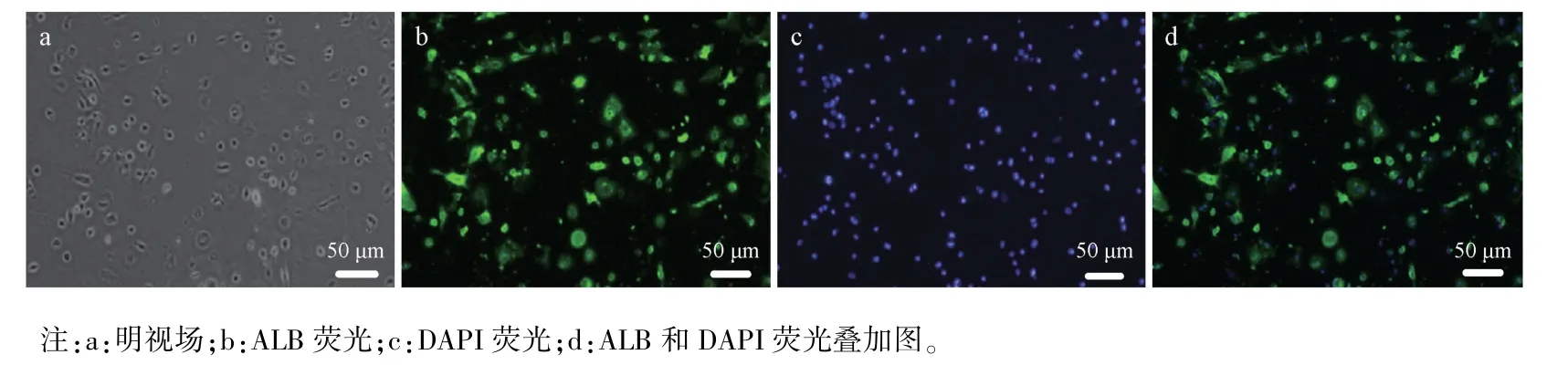
图1 小鼠第13.5 天胚肝细胞鉴定Note.a,Bright field.b,ALB fluorescence.c,DAPI fluorescence.d,ALB and DAPI fluorescence merge.Figure 1 Identification of 13.5 day mouse embryo hepatocytes
2.2 qRT-PCR 检测相关基因的mRNA 表达水平
与对照组相比,共培养HepG2 细胞株中AFP相对mRNA 表达量在24 h 和48 h 均显著降低(P<0.05,P<0.01),HNF-4α相对mRNA 表达量在24 h和48 h 均显著升高(P<0.05,P<0.01),CYP1B1 mRNA 的相对表达量在24 h 无明显差异,48 h 显著升高(P<0.01),ADH1CmRNA 的相对表达量在24 h 无明显差异,48 h 显著升高(P<0.01),见图2。

图2 共培养后相关基因mRNA 表达水平Note.Compared with the control group,*P<0.05,**P<0.01.Figure 2 mRNA expression levels of related genes after co-culture
2.3 显微镜下观察细胞形态变化
对照组HepG2 细胞株生长旺盛、密度大,形态呈多角形或梭形,胞浆透亮,细胞核多且形状不规则。与小鼠第13.5 天胚肝细胞共培养48 h 后,HepG2 细胞株生长受到明显抑制,形态多为六边形,接近正常成熟肝细胞,胞浆透亮度下降,细胞核多为单核,见图3。
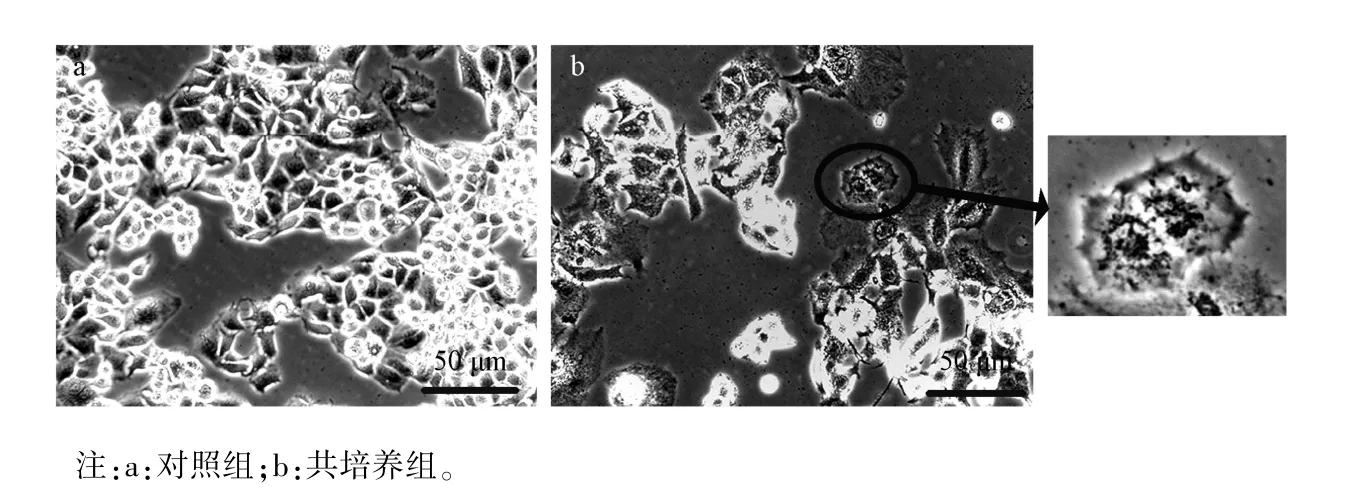
图3 对照组和共培养组HepG2 细胞株的形态Note.a,Control group.b,Co-culture group.Figure 3 Morphology of HepG2 cells in the control group and co-culture group
2.4 Western blot 法检测 AFP、HNF-4α、β-Catenin 的蛋白含量
与小鼠第13.5 天胚肝细胞共培养48 h 后,提取总蛋白,Western blot 法检测HepG2 细胞株中,AFP、HNF-4α、β-Catenin 的蛋白含量。计算Western blot 条带灰度值并统计,发现与对照组相比,AFP 蛋白含量在共培养组(P<0.05)显著降低,HNF-4α 蛋白含量在共培养组显著升高(P<0.05)。同时,与对照组相比,β-Catenin 蛋白含量在共培养组显著下降(P<0.05),见图4。

图4 共培养HepG2 细胞株中AFP、HNF-4α 和β-Catenin 的蛋白表达Note.Compared with the control group,*P<0.05.Figure 4 Protein expression levels of AFP、HNF-4 and β-Catenin in co-culture group
2.5 免疫荧光检测β-Catenin 的分布
与小鼠第13.5 天胚肝细胞共培养48 h 后,免疫荧光法检测HepG2 细胞株中β-Catenin 的分布。结果可见,对照组HepG2 细胞株增殖旺盛,β-Catenin 的荧光染色明显,提示其高含量;相比于对照组,共培养组HepG2 细胞株数量明显减少,β-Catenin 的荧光强度显著减弱。结果验证了,与小鼠第13.5 天胚肝共培养后,HepG2 细胞株中β-Catenin 的含量减少,见图5。
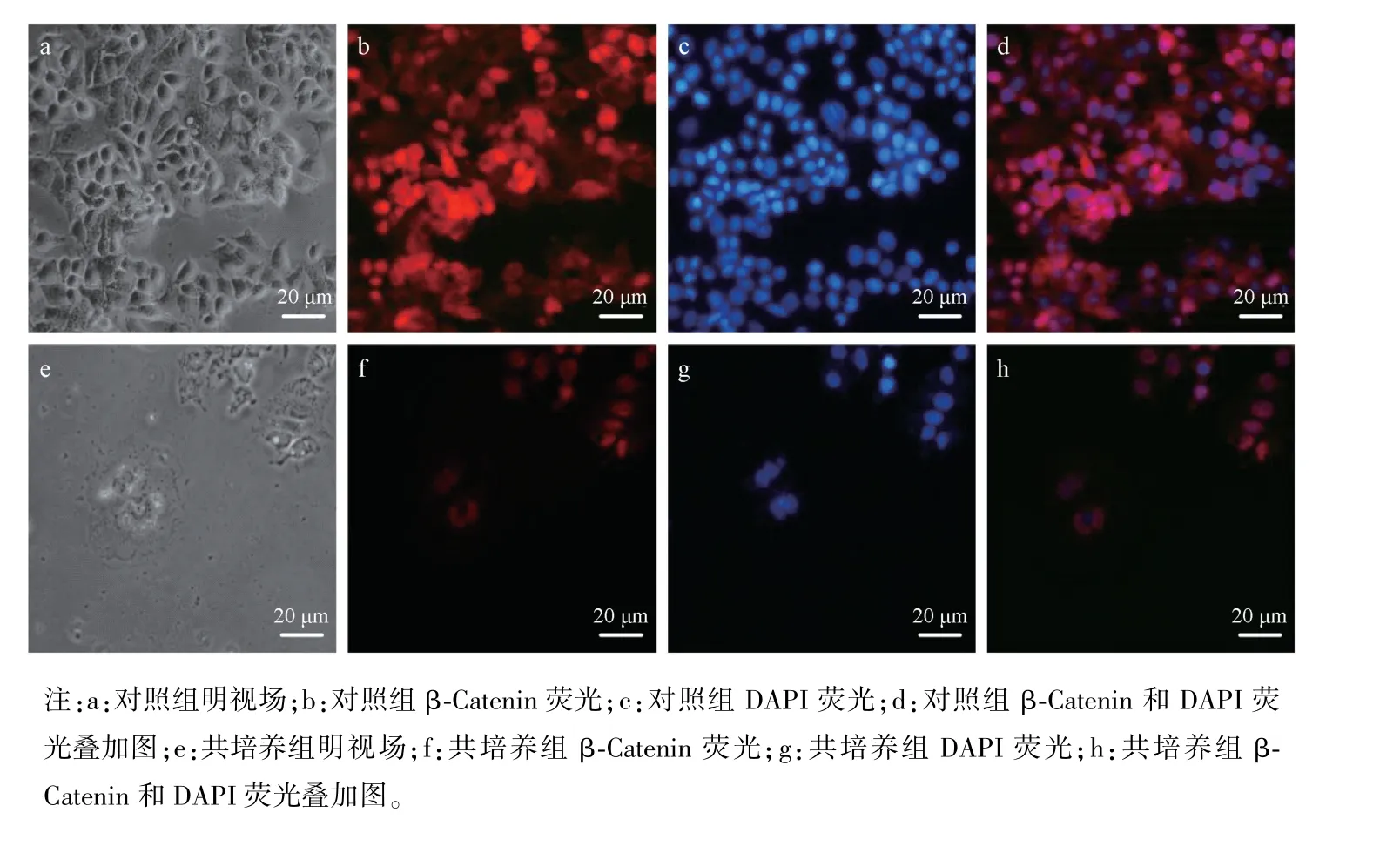
图5 HepG2 细胞株中β-Catenin 的分布Note.a,Bright field in the control group.b,β-Catenin fluorescence in the control group.c,DAPI fluorescence in the control group.d,β-Catenin and DAPI fluorescence merge in the control group.e,Bright field in the co-culture group.f,β-Catenin fluorescence in the co-culture group.g,DAPI fluorescence in the co-culture group.h,β-Catenin and DAPI fluorescence merge in the co-culture group.Figure 5 Distribution of β-Catenin in HepG2 cells
2.6 抑制β-Catenin 引起HepG2 细胞株形态变化
与对照组HepG2 细胞株相比,β-Catenin 抑制剂XAV-939 处理后,细胞生长受到抑制,胞浆透亮度下降,细胞形态不规则,趋于死亡。而相对于共培养组,β-Catenin 抑制剂XAV-939 处理后,细胞形态变化的基础上,接近崩解,见图6。

图6 抑制β-Catenin 引起HepG2 细胞株的形态变化Note.a,Control group.b,XAV-939 group.c,Co-culture group.d,Co-culture+XAV-939 group.Figure 6 Morphology of HepG2 cells induced by inhibition β-Catenin
2.7 抑制β-Catenin 减少AFP 的蛋白含量
对照及共培养HepG2 细胞株,β-Catenin 抑制剂XAV-939 处理48 h 后,Western blot 法检测AFP 和β-Catenin 的蛋白含量。与对照组相比,AFP 蛋白含量和β-Catenin 蛋白含量在XAV-939 组显著降低(P<0.01);同时,与共培养组相比,AFP 蛋白含量和β-Catenin 蛋白含量在共培养+XAV-939 组显著降低(P<0.01),见图7。
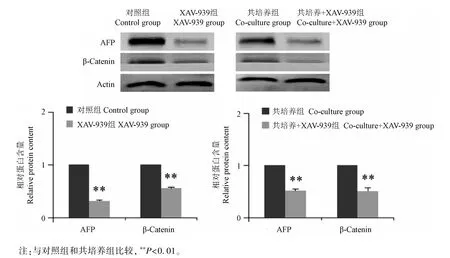
图7 抑制β-Catenin 减少AFP 的蛋白含量Note.Compared with the control group and the co-culture group,**P<0.01.Figure 7 Reduced AFP protein content induced by inhibition β-Catenin
3 讨论
目前,针对杀死肿瘤细胞的治疗策略,不能达到完全治愈肿瘤的目的,反而会产生严重的毒副作用。因此,我们必须改变思路。胚胎微环境是诱导肿瘤细胞分化的天然而有效的治疗良方[4,9],然而,并不是所有的胚胎诱导肿瘤细胞分化的实验都能取得成功[10],因此有必要探寻其内在的诱导机制。
根据肿瘤细胞和胚胎干细胞之间的相似性[11-12],齐锦生教授提出“同源同步诱导分化”理论[5-6]。有证据表明,HCC 细胞表达胚胎抗原、具有无限增殖等胚肝细胞的特性[12-13]。在“同源同步诱导分化”理论的指导下,我们前期的实验证实,特定发育阶段的鸡胚或小鼠胚肝细胞可诱导HepG2 细胞株分化[6]。
鉴于小鼠胚肝细胞是在胚胎发育第12~15 天分化成熟[14],我们用小鼠第13.5~14.5 天胚肝细胞与HepG2 细胞株共培养,能抑制HepG2 细胞株增殖,促进其分化成熟[5-6]。HNF-4α 在肝发育和肝细胞功能形成中,发挥着不可或缺的关键作用,也是控制肝细胞分化的关键因子[15-16]。
本实验用免疫荧光法检测小鼠第13.5 天胚肝细胞中肝细胞标记分子ALB 蛋白表达,结果显示绝大部分细胞的ALB 荧光染色阳性,说明小鼠第13.5天胚肝细胞成功分离培养。HepG2 细胞株与小鼠第13.5 天胚肝细胞共培养后,肝癌标记分子AFP相对mRNA 表达量降低,而肝细胞分化调控因子HNF-4α,成熟肝细胞标记分子CYP1B1、ADH1C基因相对mRNA 表达量升高。并且与小鼠13.5 天胚肝细胞共培养可诱导HepG2 细胞株的形态趋于正常肝细胞样。Western blot 结果显示HepG2 细胞株中AFP、HNF-4α 蛋白在共培养后表达变化与相对mRNA 表达变化相一致。这表明,小鼠第13.5 天胚肝细胞共培养可抑制HepG2 细胞株中AFP 表达,上调HNF-4α 表达,诱导HepG2 细胞株分化。而HNF-4α 还调控很多成熟肝细胞特异酶的表达,如CYP1B1和ADH1C等。本实验也证实,与小鼠第13.5 天胚肝细胞共培养,可上调HepG2 细胞株中CYP1B1和ADH1C的表达。然而,小鼠第13.5 天胚肝细胞是通过什么信号通路,诱导HepG2 细胞株分化成熟呢?
已知Wnt/β-Catenin 信号通路是一个高度保守的,调控胚胎发育、细胞增殖和分化的重要信号通路[17]。肝细胞分化过程中,Wnt/β-Catenin 信号通路起关键调控作用,而其紊乱或过度激活,则导致HCC 的发生发展[7-8]。Western blot 和免疫荧光结果均显示与小鼠13.5 天胚肝共培养后,HepG2 细胞株中β-Catenin 蛋白含量下降。这说明与小鼠第13.5 天胚肝细胞共培养可显著抑制HepG2 细胞株中β-Catenin 的含量和分布。加入β-Catenin 抑制剂后,HepG2 细胞株出现明显的形态变化,细胞趋于死亡,采用Western blot 方法检测蛋白表达,发现抑制β-Catenin 可减少HepG2 细胞株以及共培养的HepG2 细胞株中AFP 蛋白含量。这说明抑制β-Catenin 可引起对照组及共培养组HepG2 细胞株明显的形态变化,减少AFP 蛋白含量。但是,抑制β-Catenin 并不能完全模拟小鼠第13.5 天胚肝细胞共培养的效果。总之,这说明,小鼠第13.5 天胚肝细胞共培养很可能是主要通过抑制Wnt/β-Catenin 信号通路,促使HepG2 细胞株分化成熟的。
然而,小鼠第13.5 天胚肝细胞还通过哪些信号通路,及怎样抑制β-Catenin,诱导HepG2 细胞株分化成熟,还需进一步的深入探讨。此外,胚胎发育和免疫形成之间亦是存在紧密的联系[10]。因此,胚胎诱导分化与免疫治疗之间内在的联系和机制,也需不断探讨揭示[18]。
总之,本研究揭示,小鼠第13.5 天胚肝细胞共培养可能主要通过抑制β-Catenin,诱导HepG2 细胞株分化成熟。
