中国对虾Gs基因克隆及其在急性低盐胁迫下功能分析
2022-05-27周雨欣何玉英谢拥军
周雨欣 何玉英, 李 健, 魏 威, 王 琼, 谢拥军
(1. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306; 2. 中国水产科学研究院黄海水产研究所, 农业农村部海洋渔业可持续发展重点实验室, 青岛 266071; 3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室, 青岛 266235; 4. 青岛农业大学海洋科学与工程学院, 青岛 266237;5. 河北省水产良种与渔业环境监测保护总站, 石家庄 050000)
盐度的变化能影响生物体的正常活动, 是能影响水生甲壳动物正常发育的一种非常重要的生态因子[1—3]。大量降水导致池塘水盐度改变造成水生甲壳动物体内渗透压失衡, 引起一系列生理适应性反应[4,5]。暴雨造成的池塘盐度急剧变化往往会导致中国对虾(Fenneropenaeus chinensis)机体免疫力下降[6]。Spanings-Pierrot等[7]研究发现多巴胺在维持渗透压平衡中发挥一定作用; 潘鲁青等[8]发现低盐对凡纳滨对虾(Litopenaeus vannamei)鳃丝Na+-K+-ATPase活力有一定影响, 盐度越低酶活力越大;高盐胁迫对中国对虾的生长存活无显著影响[9—11];马金武等[12]发现三疣梭子蟹(Portunus trituberculatus)在急性盐度胁迫下具有较强的渗透调节能力,但未见有关中国对虾在急性低盐胁迫下渗透调节变化的研究。
鸟嘌呤核苷酸结合蛋白(Guanine nucleotide binding protein, Gs)是一种重要的信号传导分子, 可通过直接调节离子通道、激活第二信使等方式参与细胞信号传导。多巴胺(DA)属于生物胺的一种,是一种信号分子, 能够参与甲壳动物体内的离子转运过程[7]。Na+-K+-ATPase是一种调节渗透压的非常重要的酶[13,14]。当水生甲壳动物受到急性低盐胁迫时, Na+-K+-ATPase能通过调节离子转运对渗透压调节过程发挥重要作用[15—18]。Neufeld等[19]和Savage等[20]认为生物胺能够短期调节Na+-K+-ATPase活力。环境盐度急剧变化时, 生物胺合成酶产生DA, 通过Gs传导信号, 激活AC将ATP转化成cAMP, cAMP与PKA相耦联, 通过PKA激活Na+-K+-ATPase, 进行渗透调节[21,22]。Lucu等[23]在对杂色瘦方蟹(Leptograpsus variegatus)的研究中发现将DA或cAMP注射到体内能激活Na+-K+-ATPase。在三疣梭子蟹中研究发现低盐胁迫下DA与 Na+-K+-ATPase变化趋势一致[5]。
本文通过探究急性低盐胁迫下Gs基因在中国对虾中的表达情况以及cAMP信号通路内多个指标的变化情况, 探讨低盐胁迫下Gs基因参与中国对虾渗透压调节机制, 为解析中国对虾在低盐胁迫下的环境适应性提供基础数据。
1 材料与方法
1.1 实验材料
实验动物均取自日照开航水产养殖有限公司,随机选用平均体长为(11.59±0.96) cm, 平均体重为(21.29±2.47) g的活力好且规格整齐的中国对虾, 在实验用水泥池中暂养7d, 暂养期间保证每天换水清污, 24h充氧泵连续充氧, 按时投喂。实验用水为净化后的海水, 水温为(20—22)℃, 盐度为26—28,pH为8.14—8.20。
1.2 实验方法
总RNA的提取及cDNA的合成挑选活力好的中国对虾, 每3尾为一组, 分别取鳃、肝胰腺、眼柄、肌肉、胃、心脏和肠道样品, 共取3组, 迅速放入液氮中保存。组织处理使用全自动样品快速研磨仪(净信, 上海), 样品总RNA的提取使用TRI-zol up试剂, 检测RNA的质量和浓度使用NanoDrop 2000核酸定量仪(Tnermo, 美国), 通过琼脂糖凝胶电泳检测RNA的完整性, 使用反转录试剂盒(诺唯赞, 南京)将RNA反转录为cDNA, 5′和3′端RACE模板使用SMARTer®RACE 5′/3′ Kit(宝生物, 大连)合成。
FcGs基因全长克隆Gs基因序列从本实验室前期测得的中国对虾转录组中获得。Gs基因的全长序列的获得利用RACE扩增技术。本实验所有引物均由生工生物工程(上海)股份有限公司合成(表 1)。
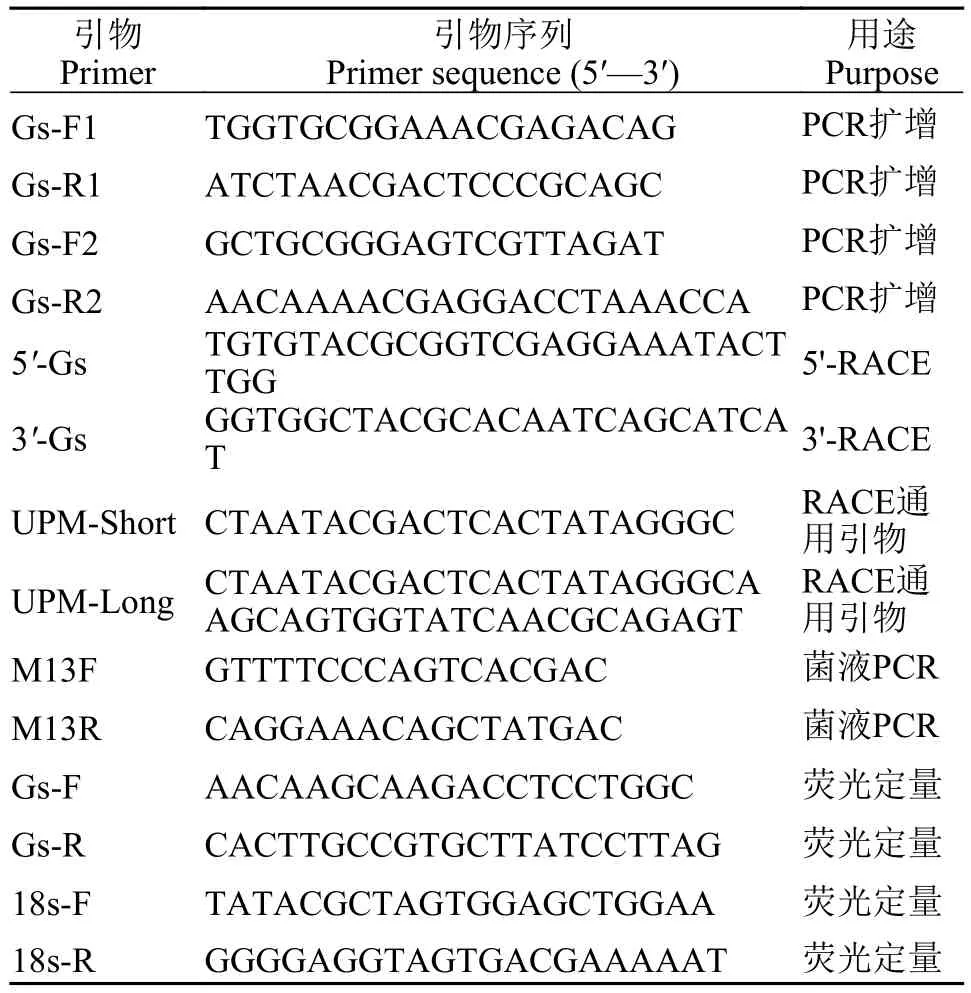
表1 本研究所用引物Tab. 1 Primers used in the study
基因序列生物信息学分析5′和3′端扩增序列与转录组序列的拼接使用Contig Express; 查找基因的开放阅读框使用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/); 分析物种间的同源性使用NCBI BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi); 对多个物种该基因编码氨基酸序列进行多序列比对使用DNAMAN软件; 构建N-J进化树使用MEGA 6软件; 预测信号肽使用SignalP-5.0 Server (http://www.cbs.dtu.dk/services/SignalP/), 预测蛋白质结构域和蛋白质特性使用SMART(http://smart.emblheidelberg.de/)和ExPASy ProtParam(http://web.ex-pasy.org/protparam/)。
FcGs基因组织表达及处理组实时定量分析由FcGs基因cDNA全长序列设计qRT-PCR引物Gs-F和Gs-R, 内参基因选择18S-F和18S-R(表 1)。FcGs基因的组织表达、处理组表达变化及筛选干扰靶点所用试剂为ChamQTMSYBR®Color qPCR Master Mix(诺唯赞, 南京), 所用仪器设备为7500 Fast Real Time PCR System(ABI, 美国)。
急性低盐胁迫实验及DA、cAMP、PKA、Gs含量和AC、Na+-K+-ATPase活力测定随机选150尾规格整齐活力好的中国对虾, 放在120 L的养殖箱。本实验分别设置对照组和急性低盐胁迫组, 盐度分别为26和10, 设置25尾/平行, 每组3个平行。每6h用淡盐水进行一次盐度校正。
取样时间分别是实验开始后6h、12h、24h、48h和72h, 取0.2 g鳃组织样品, 加入1∶9的预冷生理盐水, 超声波冰浴破碎组织, 4℃ 4000×g离心20min后取上清液放在-80℃冰箱保存。使用南京建成生物工程研究所和上海酶联生物科技有限公司生产的试剂盒进行检测, 检测方法参照试剂盒附带说明书。
siRNA干扰实验基于FcGs基因cDNA全长序列, 设计G1、G2和G3共3个干扰靶点(表 2)。设置预实验, 选出干扰效果最佳的siRNA靶点。正式实验设置干扰组和对照组(NC), 在第二腹节肌肉进行注射, 标准为1 μg/g。统计实验开始后48h内中国对虾的累计死亡率。在注射12h、24h和48h时每组随机选取3尾虾取鳃组织样品, 放于液氮中。
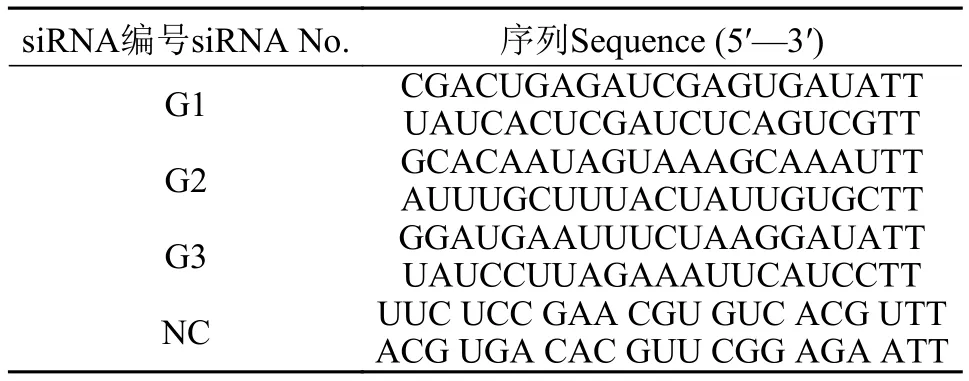
表2 本研究所用siRNA序列与NC序列Tab. 2 The sequences of siRNA and NC
2 结果
2.1 FcGs基因序列分析
FcGs基因全长1692 bp, 开放阅读框(ORF)长度为1140 bp, 5′非编码区(5′-UTR)和3′非编码区(3′-UTR)长度分别为256和296 bp, 编码379个氨基酸。FcGs基因编码的蛋白分子量约为44 kD, 不稳定系数为46.86, 亲水性平均值为-0.583, 脂肪系数为80.53, 理论等电点(pI)为7.12, 包括一个功能结构域,为无信号肽的非分泌蛋白, 蛋白结构为不稳定亲水蛋白。
2.2 FcGs基因同源性分析
将中国对虾与其他物种FcGs基因的氨基酸序列进行多序列比对并构建进化树。分析得出中国对虾FcGs基因与凡纳滨对虾(Litopenaeus vannamei)和日本囊对虾(Marsupenaeus japonicus)同源性较高, 分别为99%和97%。进化树分为脊椎动物和无脊椎动物两大支, 中国对虾归于无脊椎动物节肢动物门甲壳纲, 与凡纳滨对虾首先聚为一支, 其次为日本囊对虾(图 1)。
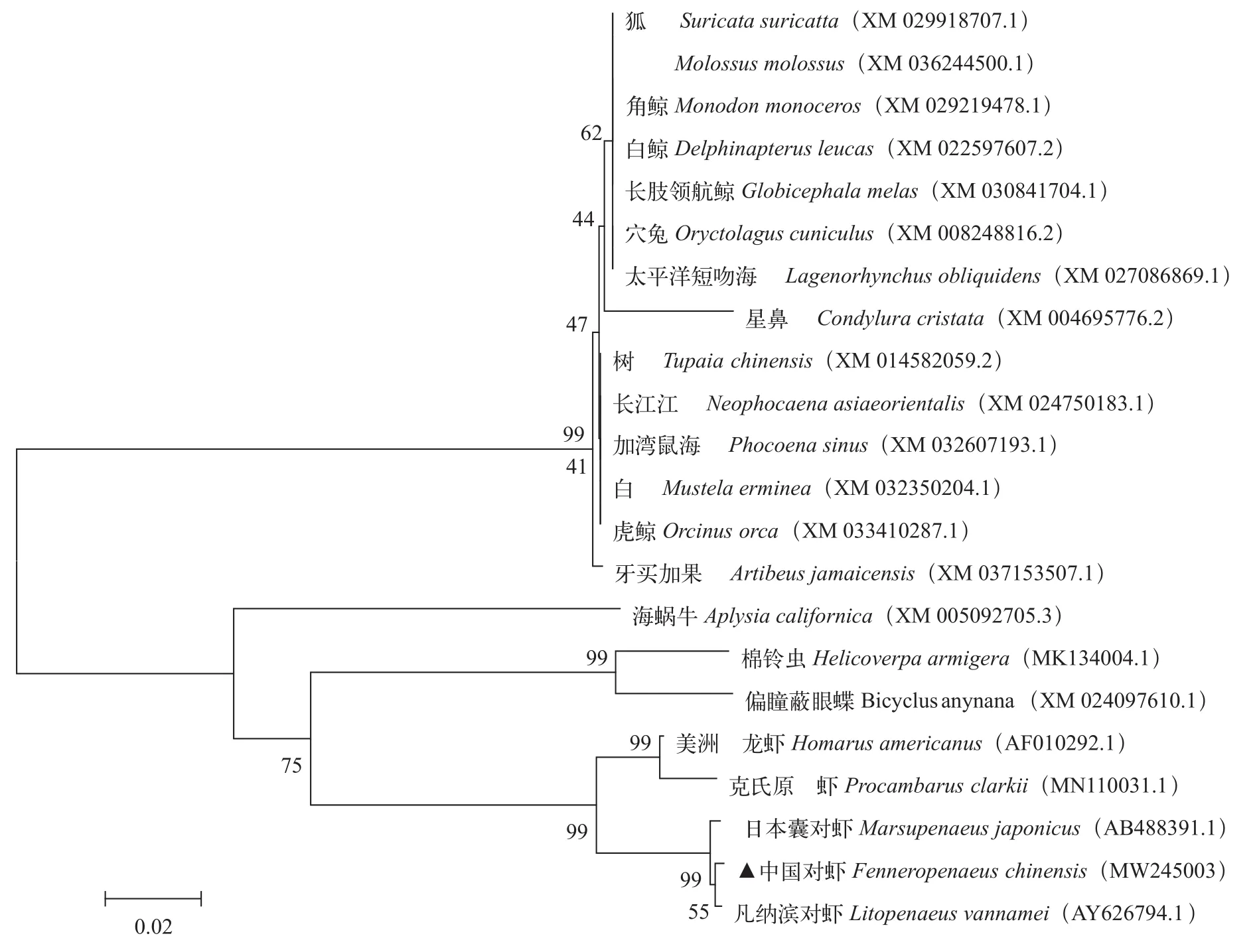
图1 基于FcGs基因氨基酸序列构建的NJ进化树Fig. 1 NJ tree based on FcGs amino acid sequences
2.3 FcGs基因在不同组织表达分析
利用RT-PCR分析FcGs基因在中国对虾7个组织中的表达(图 2)。结果显示鳃表达量显著高于其他组织(P<0.05)。
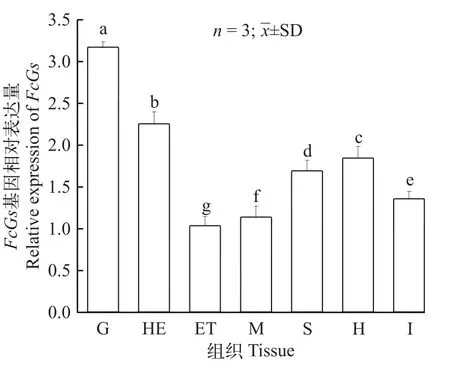
图2 FcGs基因在中国对虾不同组织中的表达Fig. 2 The relative expression of FcGs in different tissues of Fenneropenaeus chinensis
2.4 FcGs基因在急性低盐胁迫下鳃组织中的表达分析
分析FcGs基因在急性低盐胁迫后鳃组织中的表达 (图 3)。与对照组相比, 实验72h内FcGs基因整体呈上调表达, 并显著高于对照组(P<0.05)。在12h时表达量达到最高值, 为对照组的2.019倍。
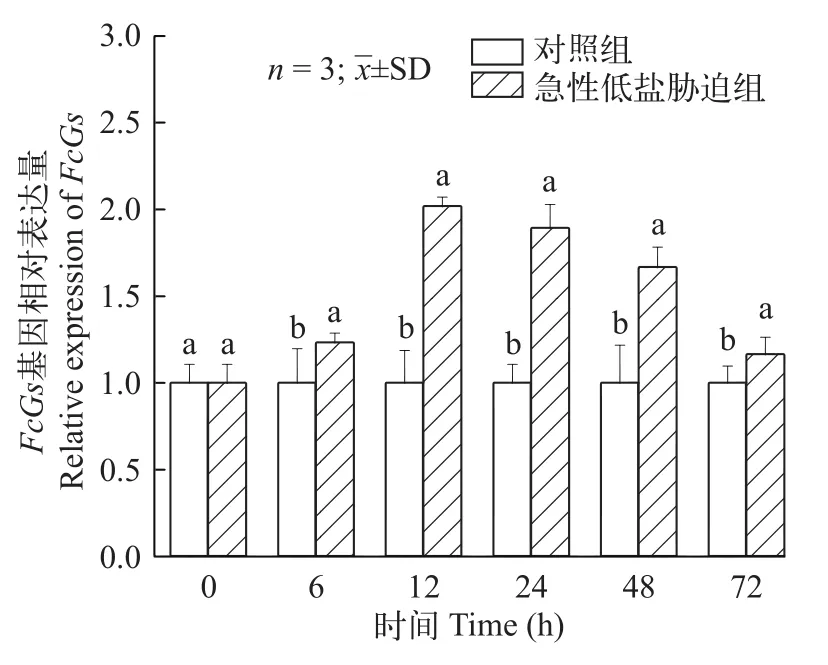
图3 FcGs基因在中国对虾鳃组织中表达情况Fig. 3 The relative expression of FcGs in gill tissues of Fenneropenaeus chinensis
2.5 急性低盐胁迫对中国对虾DA、Gs、cAMP和PKA含量的影响
在急性低盐胁迫下中国对虾鳃组织中DA、Gs、cAMP和PKA含量与对照组相比整体呈现上调表达趋势(图 4), 并显著高于对照组(P<0.05)。在实验12h时达到最高值, 分别为对照组的1.256倍、1.449倍、1.359倍和1.202倍。
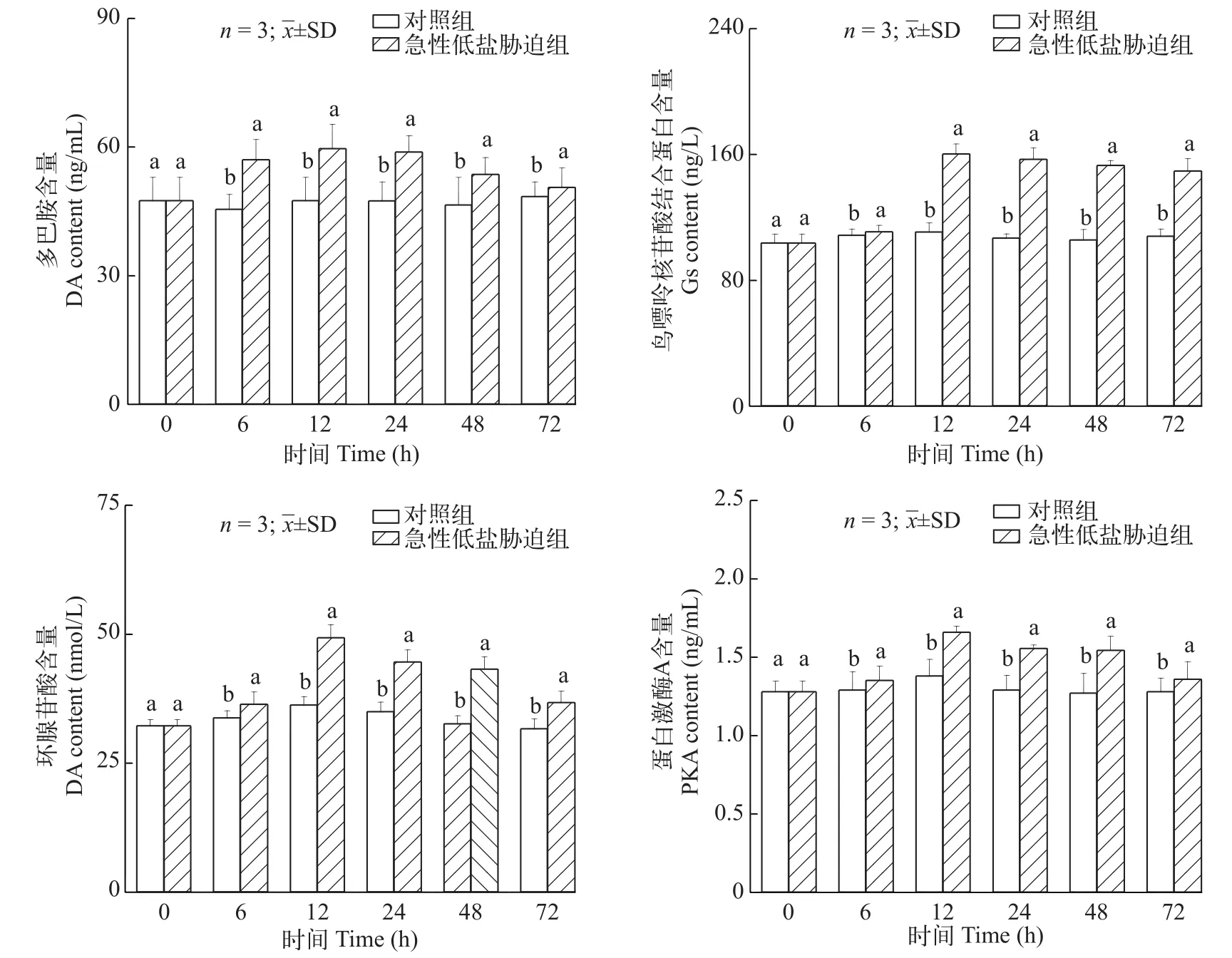
图4 急性低盐胁迫对中国对虾cAMP信号通路内DA含量、Gs含量、cAMP含量和PKA含量的影响Fig. 4 Effects of acute low-salinity stress on DA, Gs, cAMP and PKA content of cAMP signaling pathway in Fenneropenaeus chinensis
2.6 急性低盐胁迫对中国对虾AC和Na+-K+-ATPase活力的影响
在急性低盐胁迫下中国对虾鳃组织中AC和Na+-K+-ATPase活力与对照组相比整体呈现上调表达趋势(图 5), 并显著高于对照组(P<0.05)。在12h时达到最高值, 分别为对照组的1.488倍和1.507倍。
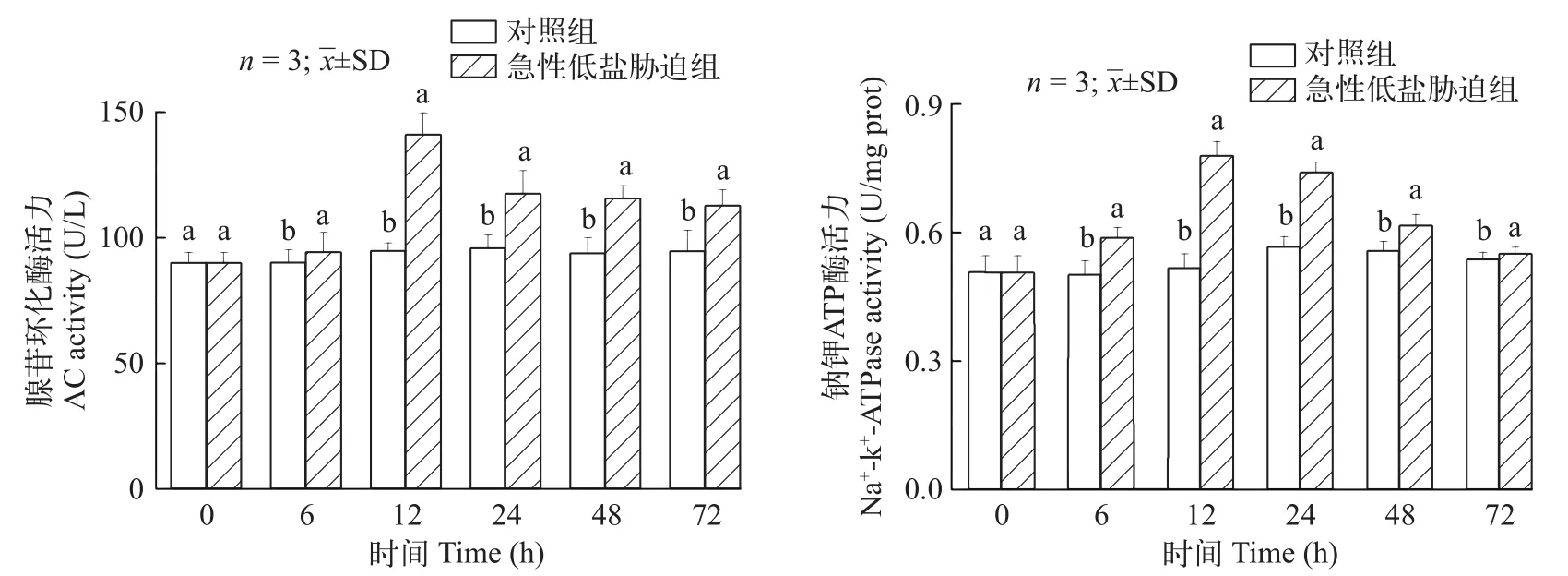
图5 急性低盐胁迫对中国对虾cAMP信号通路内AC活力和Na+-K+-ATPase活力的影响Fig. 5 Effects of acute low-salinity stress on AC and Na+-K+-ATPase activities of cAMP signaling pathway in Fenneropenaeus chinensis
2.7 FcGs基因干扰实验
筛选干扰靶点利用RT-PCR分析干扰FcGs基因后该基因在鳃组织的相对表达量, 不同靶点的干扰效果有所差异(图 6)。与对照组相比注射G1靶点后在12h、24h和48h后基因表达量分别为对照组的0.747、0.732和0.822倍, 而注射G2和G3后则分别是0.701、0.938和0.684倍, 以及0.599、0.559和0.720倍。在3个靶点中G3干扰效果最好, 选择G3干扰靶点进行后续实验。
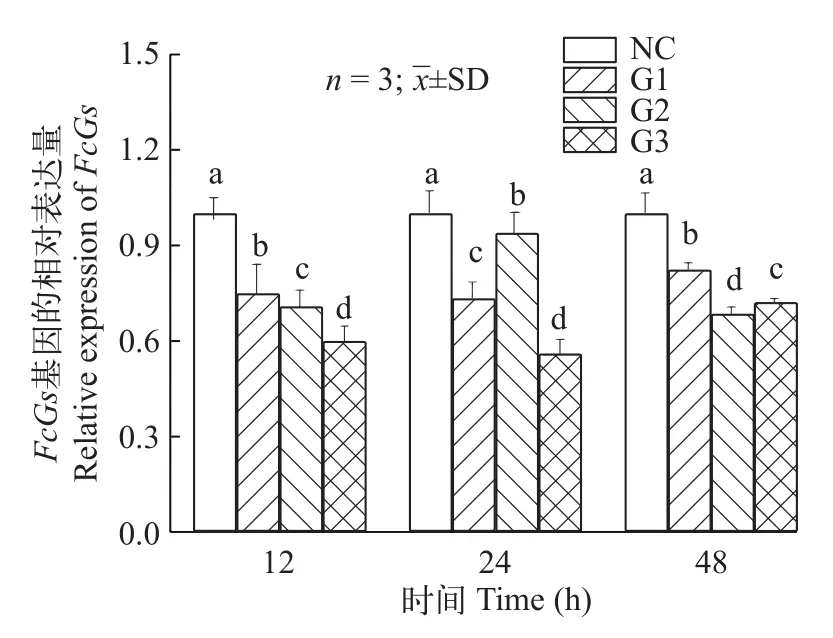
图6 注射G1、G2和G3后FcGs基因在中国对虾鳃组织中的表达Fig. 6 Expression of FcGs gene in gill after G1, G2 and G3 injection
siRNA干扰FcGs后死亡率对中国对虾的FcGs基因进行干扰并进行急性低盐胁迫, 统计胁迫48h内的死亡率(图 7)。干扰组48h内累积死亡率(32%)显著高于对照组(16%)(P<0.05)。
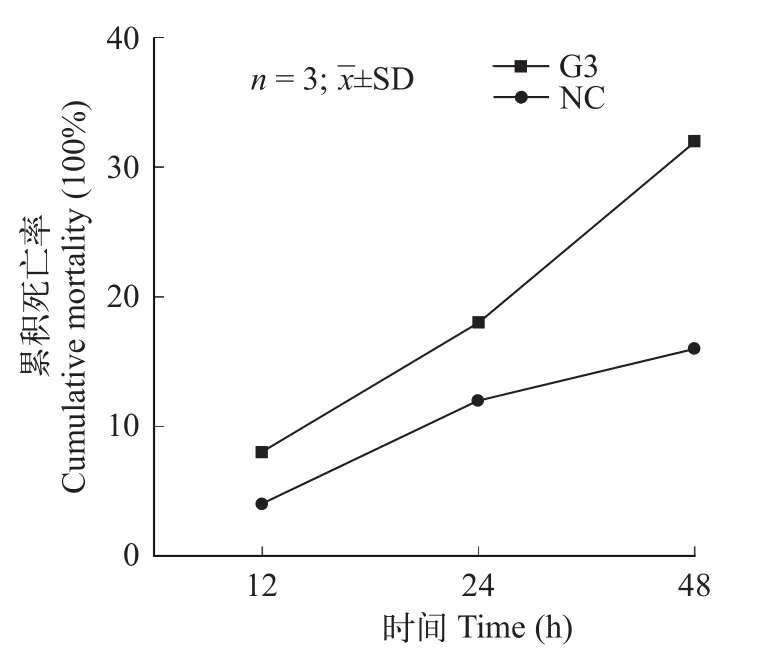
图7 急性低盐胁迫下注射siRNA干扰的中国对虾的累计死亡率Fig. 7 Mortality stress of Fenneropenaeus chinensis after acute low-salinity and siRNA interference
3 讨论
Gs基因与调节离子通道和渗透压调节有关, 本次实验通过RACE扩增技术得到中国对虾FcGs基因cDNA全长序列, 同源性分析发现该基因编码的氨基酸序列在物种间同源性较高, 具有Gs基因的典型序列结构和特征, 表明该蛋白在物种间具有较高的保守性。FcGs基因在中国对虾鳃和肝胰腺中表达量较高, 鳃在调节渗透压和离子转运方面起重要作用[24,25], 是水环境发生变化后主要的调节器官[26];肝胰腺具有排毒与解毒的作用, 是重要的免疫防御器官[27,28]。由此推测FcGs基因参与中国对虾渗透压调节以及免疫防御过程。
盐度是中国对虾养殖中重要的环境因子[29—31],为进一步了解FcGs基因及其所在的cAMP信号通路是否在中国对虾渗透压调节过程发挥作用开展本次实验。通过实验发现在鳃组织中各项酶活和含量基本都在12h达到最高值, 说明鳃组织在实验12h时渗透压调节能力达到最大, 与在三疣梭子蟹中[5]的研究结果和在克氏原螯虾(Procambarus clarkii)中[32]的研究结果一致。在本实验中, 急性低盐胁迫后中国对虾体内Gs基因表达与Gs含量显著上调, 上游DA含量上升, 下游cAMP和PKA含量及AC和Na+-K+-ATPase活力上升, 与三疣梭子蟹[5]的研究结果一致。在推测急性低盐胁迫下cAMP信号通路在渗透压调节过程中调控路径为DA→Gs→AC→cAMP→PKA, 通过调控下游Na+-K+-ATPase活力, 参与中国对虾渗透调节过程。
通过对急性低盐胁迫下FcGs基因进行干扰, 统计其48h内累积死亡率发现中国对虾干扰组死亡率显著高于NC组(P<0.05), 说明FcGs基因的表达影响了中国对虾的存活, 急性低盐胁迫下中国对虾FcGs基因的表达有利于中国对虾的存活。干扰中国对虾FcGs基因后基因表达量降低, 死亡率升高,推测FcGs基因在急性低盐胁迫下的渗透压调节过程中发挥重要作用。
Gs是cAMP信号通路中的一个重要的结合蛋白, 对于调控下游基因具有重要的作用。通过对中国对虾FcGs基因的克隆, 并对该基因的功能进行了初步的推测。初步明确了Gs基因在中国对虾盐度适应过程中的作用, 为水生甲壳动物的在受到盐度胁迫后的环境适应性调控机制提供基础数据, 有助于解析中国对虾盐度适应机制, 也为选育抗逆新品种提供一定的理论依据和数据支撑。
