鲤Pdcd6ip蛋白真核表达载体的构建及抗病毒功能研究
2022-05-27张明辉彭军辉
邵 玲 张明辉 彭军辉
(上海市水产研究所, 上海市水产技术推广站, 上海, 200433)
鲤春病毒血症病毒 (Spring viraemia of carp virus,SVCV)可以引起多种鲤科鱼类, 如鲤(Cyprinus carpioLinnaeus)、锦鲤 (Cyprinus carpio haematopterus)和草鱼 (Ctenopharyngodon idellusCuvier et Valenciennes)等发生急性、暴发性出血症—鲤春病毒血症 (Spring viraemia of carp, SVC)[1,2]。SVC常在春季水温较低时暴发, 死亡率可高达90%以上,被世界动物卫生组织列为必须申报的疫病, 也是《中华人民共和国进境动物一、二类传染病、寄生虫病名录》中的一类鱼类疫病, 该病严重影响了渔业生产并造成了重大的经济损失, 对我国水产养殖业的可持续发展构成了巨大威胁[3]。因此加强SVCV抗病毒机制的研究, 寻求有效的预防和治疗方法具有重要的理论和实践意义。
SVCV隶属于弹状病毒科Sprivivirus病毒属, 病毒基因组为不分节段的单股负链RNA, 共编码5个主要结构蛋白, 分别为核蛋白 (N)、磷蛋白 (P)、基质蛋白 (M)、糖蛋白 (G)和RNA聚合酶 (L)。N、P和M蛋白作为SVCV的主要结构蛋白, 在病毒的转录、复制及装配中发挥了重要作用[1,2]。前期, 我们对SVCV感染的鲤鱼上皮瘤细胞EPC (Epithelioma papulosum cyprinid)进行了蛋白质组学研究,结果发现, 相较于未感染细胞, 感染细胞中程序性细胞死亡6互作蛋白Pdcd6ip (Programmed cell death 6-interacting protein)的表达水平显著上调。Pdcd6ip也称为Alix或Aip1, 由pdcd6ip基因编码。然而, 目前鱼类中pdcd6ip基因的确定编码序列及其在SVCV感染中的功能均还未知。哺乳动物中的研究表明,Pdcd6ip是内吞体分选转运复合体Ⅲ (Endosomal sorting complexes required for transport Ⅲ, ESCRT-Ⅲ)的组成部分, 并在调控细胞程序性死亡中起到了重要作用[4]。Pdcd6ip可以结合ESCRT-Ⅲ中的CIN85、endophilins、CHMP4B和Tsg101等蛋白,还可以结合细胞凋亡相关蛋白ALG-2, 并参与ALG-2介导的细胞凋亡途径[5,6]。Pdcd6ip在哺乳动物病毒复制循环中的作用已有初步研究, 结果显示其在多种分子机制中发挥了不可或缺的桥梁作用。例如, Pdcd6ip可以结合病毒的晚期结构域, 如P(S/T)AP、YxxL和PPxY等, 进而参与有包膜病毒如人类免疫缺陷病毒 (HIV)和马传染性贫血病毒(EIAV)等的出芽及水泡性口炎病毒 (VSV)复制过程中核衣壳从内体到细胞质的转运[7]。此外, HIV-1中的研究表明, 在病毒感染宿主细胞后, 子代病毒粒子需要在宿主Pdcd6ip的帮助下才能完成其出芽和释放过程[8—10]。登革病毒 (DENV)中的研究表明, Pdcd6ip可以与其NS3蛋白发生相互作用, 在病毒感染晚期阶段及病毒释放过程中发挥了重要作用[11]。病毒成分在细胞内的转运及完整病毒的出芽为病毒正常复制所必不可少, Pdcd6ip在调节病毒感染和复制中具有重要功能。因此, 其表达与否及表达水平的高低将影响病毒的感染和复制水平。然而, Pdcd6ip在不同病毒中所起的作用不同,例如, EIAV中的研究表明, Pdcd6ip的过表达抑制了其复制[12], 而HIV-1中的研究表明, Pdcd6ip的过表达促进了其复制[6]。目前, 鱼类中Pdcd6ip的确定序列鲜有报道, 对鱼类病毒如SVCV等增殖的影响也尚未揭示。
为了探讨Pdcd6ip在SVCV感染中的功能, 本研究通过构建Pdcd6ip真核表达载体并转染EPC细胞,检测其过表达对病毒复制的影响。本研究将为SVCV抗病毒药物的研发奠定科学基础。
1 材料与方法
1.1 主要材料、试剂及实验仪器
主要材料和试剂: 鲤上皮瘤细胞系EPC购于中国检验检疫科学研究院, 用含10% FBS (胎牛血清)、1%双抗 (100 μg/mL青霉素-链霉素)的M199培养基置于25℃恒温培养。SVCV-265毒株由本实验分离和保存[13], 采用50%组织培养感染剂量法(TCID50)和Reed-Müench法[14]进行病毒滴度的测定和计算。M199细胞培养基、0.25% Trypsin-EDTA、FBS和青霉素-链霉素溶液购自Gibco公司;甲基纤维素 (4000 cP)购自Sigma-Aldrich公司; 病毒RNA提取试剂盒购自Qiagen公司; cDNA合成试剂盒RevertAid First Strand cDNA Synthesis Kit购自Thermo公司; LATaq、DNA marker、T4 DNA连接酶、TB Green Premix ExTaqⅡ等均购自TaKaRa公司; pCI-neo载体购自Promega公司; 限制性内切酶购自NEB公司; 质粒提取试剂盒、凝胶回收试剂盒、ProBond Purification System蛋白纯化试剂盒、转染脂质体Lipofectamine 2000、Alexa flour 488标记的羊抗兔IgG均购自Invitrogen公司; 细胞增殖/毒性检测试剂CCK-8购自Dojindo公司。
实验仪器: 台式冷冻离心机 (Eppendorf)、恒温水浴锅及恒温摇床 (上海一恒)、-80℃立式超低温冰箱 (Thermo)、核酸电泳仪、蛋白电泳仪及半干转膜仪 (Bio-Rad)、凝胶成像仪(上海复日)、恒温培养箱 (SANYO)、PCR仪及实时荧光定量荧光PCR仪 (Applied Biosystems)、化学发光仪 (Bio-Rad)、荧光倒置显微镜 (Olympus-IX73)、酶标仪(BioTek)。
1.2 鲤pdcd6ip基因cDNA的扩增
提取鲤组织总RNA, 并立即进行反转录获得cDNA。根据NCBI中斑马鱼 (Danio rerio)pdcd6ip基因序列及鲤、鲫、黑头软口鲦 (Pimephales promelas)、金线鲃 (Sinocyclocheilus anshuiensisFang)等预测的pdcd6ip基因序列保守区设计引物pMD18-pdcd6ip-F和pMD18-pdcd6ip-R (表 1), PCR扩增鲤pdcd6ip基因cDNA, 将PCR产物纯化回收后克隆至pMD18-T载体并进行序列测定。

表1 本研究所用引物Tab. 1 Primers used in this study
1.3 序列分析
用Bioedit 7.0、ContigExpress软件进行序列拼接、多重比对和氨基酸同源性分析。利用MEGA 5.0软件进行进化分析, 采用邻接法 (Neighbor-joining, NJ)基于Pdcd6ip氨基酸序列构建系统进化树。
1.4 Pdcd6ip蛋白真核表达载体的构建
根据pdcd6ip基因序列设计ORF区引物: pCI-pdcd6ip-F和pCI-pdcd6ip-R,以cDNA为模板进行PCR扩增。分别将回收的PCR片段和pCI-neo空载体在37℃用NheI和EcoR I双酶切3h。将酶切片段和载体进行胶回收, 回收产物在T4连接酶的作用下进行连接反应, 16℃连接过夜。将连接产物转化大肠杆菌DH5α感受态细胞, 挑取单克隆并通过菌液PCR进行鉴定。阳性克隆进行扩大培养, 提取质粒并进行测序验证, 将序列正确的重组质粒命名为pCI-pdcd6ip。
1.5 Pdcd6ip蛋白多克隆抗体的制备
设计正向引物pRSET-pdcd6ip-F和反向引物pRSET-pdcd6ip-R, 扩增pdcd6ip基因ORF区并将其插入pRSET-A载体中, 菌液PCR筛选阳性克隆, 并进行测序验证。提取重组质粒pRSET-pdcd6ip转化大肠杆菌感受态细胞BL21(DE3)pLysS。阳性克隆在37℃条件下, 加入1 mmol/L IPTG (异丙基-β-D-硫代半乳糖苷)进行蛋白诱导表达, 诱导后不同时间收取菌体, 破碎后进行SDS-PAGE电泳分析。表达蛋白进一步利用纯化试剂盒进行纯化, 纯化后的蛋白免疫新西兰白兔获得特异性的抗血清, 抗血清进一步纯化获得特异性抗体, 抗体效价用ELISA方法进行测定。
1.6 细胞转染
将EPC细胞接于24孔细胞培养板中, 第2天待形成单层细胞后进行转染。以24孔板1孔为例: 将800 ng 质粒加入到50 μL Opti-MEM培养基中; 同时将2 μL脂质体Lipofectamine 2000加入到50 μL Opti-MEM中, 室温静置5min; 然后将两者充分混匀, 室温静置20min; 用Opti-MEM轻轻洗细胞两次, 将混合物加入对应孔中, 培养4—6h后换成含10%FBS的M199培养基。转染后24h, 收取细胞样品或进行感染实验。对于感染实验, 吸除细胞上清, 细胞用无血清M199轻轻洗一次, 加入MOI=0.5的SVCV病毒液, 20℃孵育1h后, 换成含2%FBS的M199培养基,分别收取感染后12h、24h和36h样品进行病毒滴度测定、RT-qPCR检测及蛋白免疫印迹。
1.7 Pdcd6ip蛋白过表达对细胞活性的影响测定
利用细胞增殖/毒性检测试剂CCK-8 (cell counting kit-8)检测Pdcd6ip过表达对细胞活性影响,具体操作步骤如下: 转染前一天, 铺104个EPC细胞至96孔细胞培养板中, 第2天待形成单层细胞时转染重组质粒pCI-pdcd6ip和空载体pCI-neo, 每组3个复孔, 重复3次; 在转染后24h、48h和72h分别向每孔加入10 μL的CCK-8试剂, 孵育1h时后利用酶标仪测定450 nm处的吸光度。
1.8 蛋白免疫印迹 (Western blot)
细胞用PBS洗2次, 每次3min, 加入RIPA细胞裂解液, 用枪吹打数下, 使裂解液和细胞充分接触, 冰上孵育10min, 将裂解液转移到1.5 mL EP管中,12000×g, 离心5min, 收集离心上清进行SDS-PAGE,并转印至PVDF膜上。用5% PBST-BSA封闭液37℃封闭2h后加入对应的一抗 (1∶1000稀释), 37℃孵育2h; PBST洗3次, 每次5min; 加入辣根过氧化物酶 (HRP)标记的二抗 (1∶5000稀释), 37℃孵育1h;PBST洗3次, 每次5min; 使用ECL发光底物进行化学发光。
1.9 间接免疫荧光 (IF)
细胞用PBS洗2次, 然后加入4%的多聚甲醛室温固定30min; 吸除固定液, 用PBS洗细胞3次, 加入含0.2% Triton X-100的PBS透化15min; PBS洗3次,加入含4% BSA的封闭液37℃孵育2h; 吸除封闭液,加入用封闭液稀释的一抗 (兔抗SVCV M蛋白抗体,本实验室制备[15], 以体积比1∶1000稀释), 37℃孵育2h; PBS洗3次, 加入Alexa Fluor 488荧光标记的驴抗兔二抗 (体积比1∶2000稀释), 37℃孵育1h; PBS洗3次, 每次3min, 加入PBS稀释的染核液DAPI(1∶2000)染色液, 室温染色10min, PBS洗3次, 每次3min; 最后置于Olympus-IX73荧光倒置显微镜下观察和拍照。
1.10 荧光定量PCR (RT-qPCR)
重组质粒pCI-pdcd6ip和空载体pCI-neo转染EPC细胞24h后, 用无血清M199洗细胞两次, 以MOI=0.5接种SVCV, 20℃吸附1h, 换成含2%FBS的M199培养基; 于感染后12h、24h和36h分别收取实验组和对照组样品, 提取RNA并反转录合成cDNA; 利用荧光定量PCR方法进行病毒拷贝数测定[16]。在200 μL荧光PCR反应管中依次加入10 μL TB Green Premix ExTaqII, 浓度10 μmol/L正向引物、反向引物各0.4 μL, 0.4 μL ROX reference dye II和待测样品cDNA 2 μL, 补充双蒸水至20 μL, 置于7500Fast荧光定量PCR仪中进行反应, 反应条件为95℃ 30s; 之后95℃ 3s、60℃ 30s、72℃ 30s 40个循环, 在结束后, 立即由仪器进行熔解曲线分析, 最后通过ABI 7500 2.0.6软件计算扩增产物Tm值[17]; 将转染空载体pCI-neo的细胞12h M基因拷贝数设为1进行统计分析。
1.11 空斑实验
将EPC细胞接于12孔细胞培养板中, 第2天形成细胞单层后用无血清的M199洗2次, 将病毒加入各孔 (500 μL每孔), 每种做3个重复。20℃吸附1h后, 吸除病毒液, 用含5%FBS和1.5%甲基纤维素的M199培养基轻轻覆盖。培养72h后, 弃去培养基,细胞用4%多聚甲醛固定30min, 并用0.5%结晶紫染液室温静置染色30min, 吸除染液冲洗干净, 待晾干后观察结果。
2 结果
2.1 鲤pdcd6ip基因的克隆
目前, 公共数据库中尚无确定的鲤pdcd6ip基因序列, 仅有斑马鱼pdcd6ip基因序列和其他鱼类该基因的预测序列。本研究根据GenBank数据库中斑马鱼pdcd6ip基因序列以及鲤、鲫、金线鲃、黑头软口鲦等预测的pdcd6ip基因序列的保守区设计了pdcd6ip基因特异性引物, 以鲤组织cDNA为模板进行PCR扩增, 扩增出了与目的条带大小一致的约2610 bp的特异性基因片段。将该基因片段进行克隆、测序和序列比对, 结果显示该片段确属于鲤pdcd6ip基因。进一步序列比对显示鲤pdcd6ip基因与预测的黑头软口鲦基因相似性最高, 为99.05%,其ORF区编码869个氨基酸。蛋白质同源分析(图 1)显示, Pdcd6ip在鱼类和哺乳动物中各自聚为一支,但相对保守, 具有较高的同源性。鲤Pdcd6ip与人和小鼠Pdcd6ip氨基酸序列相似性分别为71.07%和69.82%。

图1 基于Pdcd6ip氨基酸序列构建的系统进化树Fig. 1 The phylogenetic tree based on Pdcd6ip amino acid sequences
2.2 真核表达载体pCI-pdcd6ip的构建
将pdcd6ip基因ORF区克隆至真核表达载体pCI-neo, 构建pCI-pdcd6ip重组质粒。将重组质粒进行NheI和EcoR I双酶切鉴定, 凝胶电泳结果显示,重组质粒经双酶切后获得约5460和2610 bp的两条特异性条带, 与预期大小相符。进一步, 双向测序结果表明构建的重组质粒序列正确无误。
2.3 Pdcd6ip蛋白多克隆抗体的制备及其过表达的western blot验证
目前, 针对鱼类Pdcd6ip蛋白尚无特异性的商业化抗体, 因此, 本研究首先通过PCR扩增了pdcd6ip基因的ORF区, 并将其克隆至pRSET-A原核表达载体中, 构建了原核表达质粒pRSET-pdcd6ip, 重组质粒转化大肠杆菌BL21(DE3)pLysS感受态细胞, 并在37℃, 1 mmol/L IPTG条件下进行Pdcd6ip蛋白的诱导表达(图 2a), 纯化蛋白并免疫实验动物, 获得了Pdcd6ip蛋白的多克隆抗体。如图 2b所示, western blot检测显示在分子量约95 kD处出现特异性条带, 与pdcd6ip基因编码蛋白预测分子量大小一致, 说明制备的抗体能特异性的识别Pdcd6ip蛋白。接下来, 利用western blot检测pCI-pdcd6ip质粒转染EPC细胞后24h Pdcd6ip蛋白的表达情况(图 2c), EPC细胞中存在较低水平的Pdcd6ip蛋白本底表达, 与转染空载体pCI-neo的对照组相比, pCI-pdcd6ip转染细胞中Pdcd6ip表达水平显著上调, 表明该质粒能够在转染细胞中正确表达。

图2 Pdcd6ip蛋白过表达的western blot验证Fig. 2 Verification of the expression of Pdcd6ip in transfected EPC cells
2.4 Pdcd6ip蛋白过表达对细胞活性影响的测定
已有的研究报道表明, Pdcd6ip蛋白在调控细胞程序化死亡中起重要作用[4]。为明确其过表达对细胞活性的影响, 本研究首先利用RT-qPCR方法测定了过表达载体pCI-pdcd6ip在EPC细胞中的转染效率, 结果表明, 转染后24h, EPC细胞中pdcd6ipmRNA相对表达水平提高了约326倍 (图 3a)。此外,在转染后不同时间, 我们还利用CCK-8试剂测定了Pdcd6ip过表达对EPC细胞活性的影响。结果显示, 与对照组相比, 在转染后24h、48h和72h Pdcd6ip过表达组细胞活性均与对照组无显著差异(图 3b)。
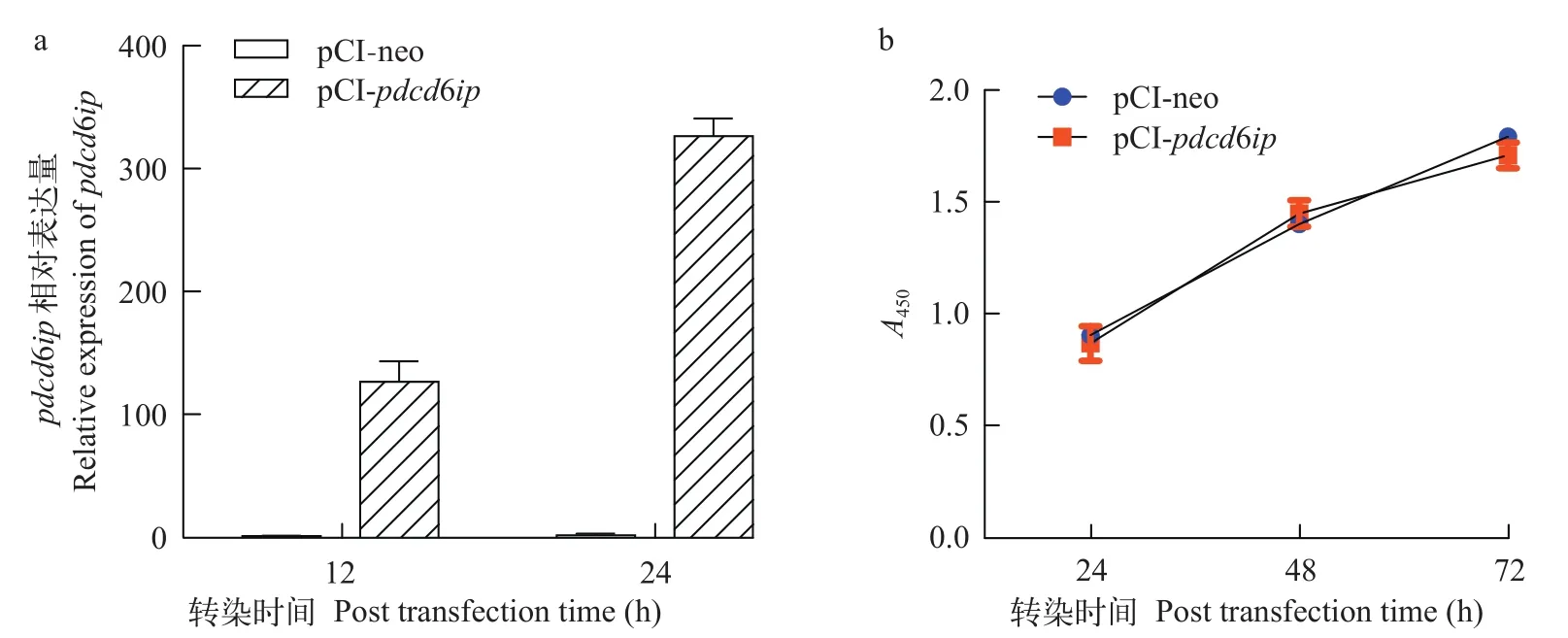
图3 转染EPC细胞中pdcd6ip mRNA相对表达水平及Pdcd6ip过表达对EPC细胞活性影响的测定Fig. 3 The mRNA expression of pdcd6ip in EPC transfected cells and the effect of its overexpression on the viability of EPC cells
2.5 Pdcd6ip过表达对SVCV增殖的影响
为进一步研究Pdcd6ip蛋白对SVCV感染的影响, 我们利用本实验室已制备的针对SVCV M蛋白的抗体[15], 对转染后感染EPC细胞进行免疫荧光检测。结果表明, 与对照组相比, Pdcd6ip过表达后SVCV感染细胞 (绿色)的数量显著减少 (图 4a)。我们对转染后感染的细胞进行western blot检测(图 4b),pCI-pdcd6ip转染细胞中Pdcd6ip蛋白表达水平升高,但M蛋白的表达水平明显降低。我们还利用RT-qPCR检测了M基因拷贝数, Pdcd6ip过表达后, M基因的拷贝数下降约70% (图 4c)。此外, 我们还用空斑实验检测了转染后SVCV感染12h、24h和36h病毒增殖滴度, 结果同样表明, Pdcd6ip的过表达对病毒滴度有明显抑制作用 (图 4d)。综合以上结果表明, Pdcd6ip过表达显著抑制了SVCV的增殖。
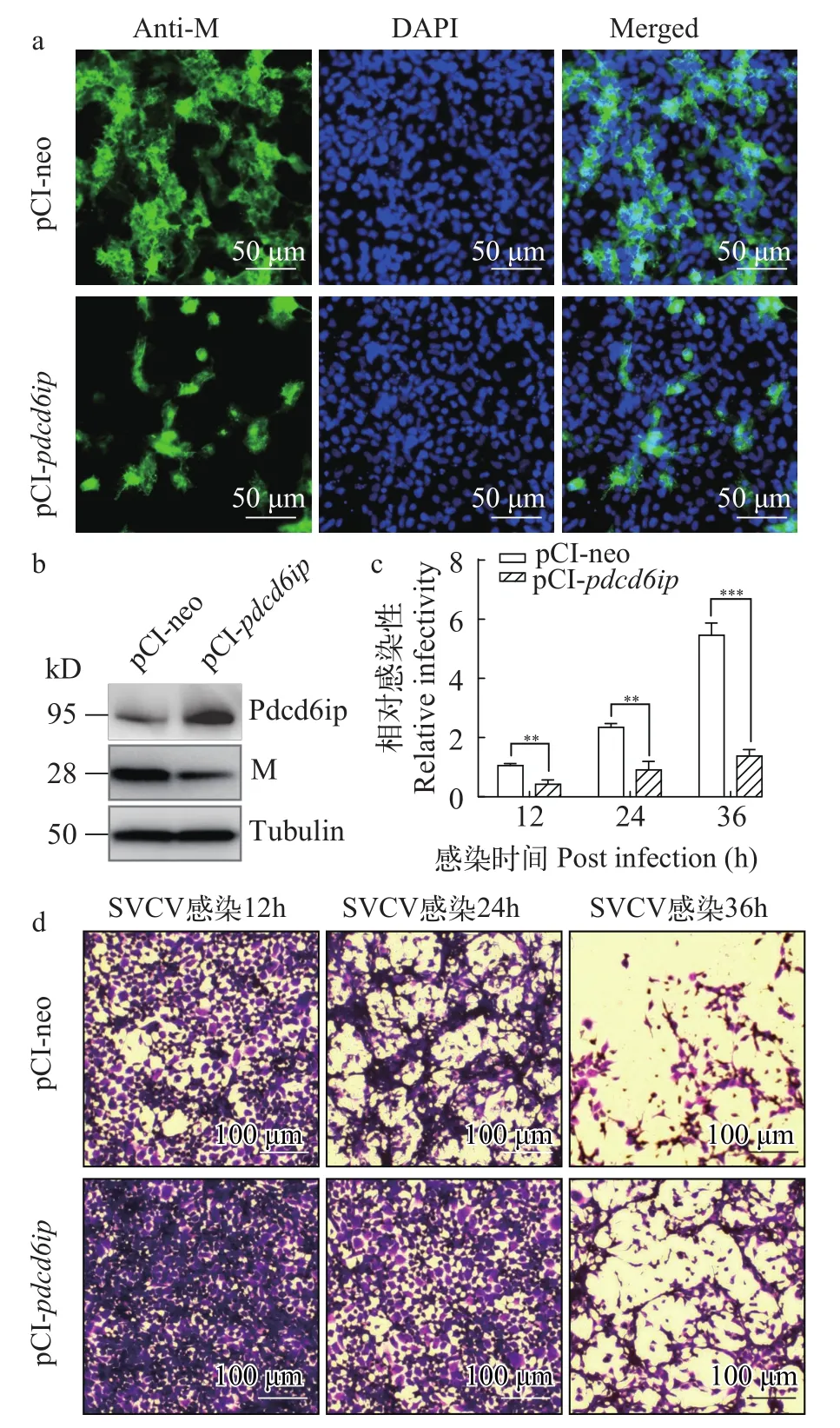
图4 Pdcd6ip过表达抑制SVCV的增殖Fig. 4 Pdcd6ip overexpression inhibited SVCV infection
3 讨论
SVCV宿主范围十分广泛, 可以感染多种淡水鱼类并引起暴发性鲤春病毒血症, 是淡水鱼养殖场重点防控的疫病病原。自首次分离报道以来[18], 其流行范围不断扩展, 目前全世界几十个国家和地区都有SVCV的分离报道[19]。自1998年英国从我国进口的观赏鱼中检测到SVCV以来, 其在我国多个省市均有检出[20—23]。根据农业部《2019年我国水生动物重要疫病状况分析》的数据, 我国2004、2016和2017—2018年都发生过SVC疫情[24], 造成了巨大的经济损失。然而, 目前, 针对SVC尚无有效的疫苗或药物, 唯一有效的措施即开展病原的密切监测,并对阳性样品进行隔离或扑杀。因此, 对宿主抵抗SVCV感染机制的研究并开发出特异的抗病毒药物对于SVCV的防治具有十分重要的意义。
Pdcd6ip蛋白是细胞内多泡体转运系统的重要因子, 在细胞膜受体内吞和再循环中起到了关键作用[25]。然而, 迄今为止, 尚未见其在水生病毒感染中功能的研究报道。我们首次克隆了鱼类pdcd6ip基因, 制备了其特异性的多克隆抗体, 并进一步研究发现Pdcd6ip过表达能显著抑制SVCV的复制, 但其作用机制还尚不明确。利用生物信息学手段, 我们预测发现SVCV M蛋白含有可以与Pdcd6ip直接互作的PPxY结构域, 推测Pdcd6ip 也可以与M蛋白直接互作, 进而影响病毒的出芽过程。多种有包膜病毒中的研究表明病毒粒子的装配及释放需要特定ESCRT体系的参与, ESCRT体系包括5种复合体(ESCRT-0、 -Ⅰ、 -Ⅱ、 -Ⅲ 和 Vps4 复合体)及多种附属蛋白。病毒蛋白通过晚期结构域PT/SAP、PPXY或LYPXnL与Pdcd6ip直接结合, 招募ESCRT蛋白, 进而转运入多囊泡体(Multivesicular bodies, MVB)。然而, 病毒复制过程本身并不需要Pdcd6ip的参与[11]。我们研究发现Pdcd6ip抑制SVCV的复制, 这与多数有包膜病毒中研究发现并不一致, 提示Pdcd6ip在SVCV复制循环中的作用机制与HIV、DENV等病毒中的机制并不相同。最新研究表明Pdcd6ip为多功能蛋白, 除可以与ESCRT-Ⅰ和ESCRT-Ⅲ成员互作参与病毒出芽及MVB分选外, 还参与了一系列重要细胞过程, 包括MVB的分裂和融合、细胞内吞、细胞表面信号的转导、内吞复合体的重分布、细胞运动和细胞黏附、细胞凋亡和JNK信号通路的调控等[9]。我们前期研究发现SVCV复制受到细胞骨架和酪氨酸激酶的调控[26], 而Pdcd6ip能够显著影响这些生物过程[9]。因此, 我们推测Pdcd6ip可能通过影响细胞骨架的时空分布或酪氨酸激酶的活性从而抑制SVCV的复制。此前, EIAV中同样观察到Pdcd6ip的过表达抑制其复制, 且EIAV晚期蛋白可以与Pdcd6ip及AP-2(早期内吞体关键蛋白)互作[12]。因此, 不排除Pdcd6ip过表达竞争性抑制了SVCV晚期蛋白与其他关键宿主蛋白的互作, 从而抑制了病毒的复制。
目前, 通过养殖鱼类机体自身来防控病毒病的方法主要有以下两种方式: 针对性的疫苗和生物制剂。水产疫苗是防治水生动物病毒性疾病比较有效的方法, 但目前仅开发了少数鱼类病毒性疾病的疫苗。我国鱼用疫苗研究更加相对滞后, 仅2011年草鱼出血病活疫苗 [兽药生字(2011)190986021]等投入了生产和使用。目前尚无商业化SVCV疫苗,且SVCV基因变异较为迅速、毒株间序列差异较大, 大大限制了SVCV疫苗在生产实践中的应用前景。多肽类生物制剂具有较高的特异性, 且容易降解无残留、不会产生耐药性, 在绿色农业发展中具有良好的技术优势, 但已有的产品比较局限, 实际水产生产中应用还较少。我们发现Pdcd6ip并不显著影响细胞的增殖活性, 提示其可以作为功能性生物制剂开发的作用靶点。当然, 相关制品的开发有待进一步的体内实验证据。
总之, Pdcd6ip在多种病毒的感染复制过程中发挥了重要的作用, 本研究构建了鲤Pdcd6ip真核表达载体并在EPC细胞中获得了高水平表达, 并且发现其过表达对SVCV的感染具有显著的抑制作用, 同时不影响细胞的正常活性。本研究结果为深入研究鲤Pdcd6ip蛋白的抗病毒机制提供了实验依据, 并为水生病毒性疾病的预防和治疗提供了新的研究思路。
