草鱼感染GCRV后血液中淋巴细胞变化及BCL10表达分析
2022-05-27姜祝祥郭早枣郑国栋邹曙明
姜祝祥 郭早枣 郑国栋 , 邹曙明 ,
(1. 上海海洋大学农业农村部团头鲂遗传育种中心, 上海 201306; 2. 农业农村部淡水水产种质资源重点实验室, 上海 201306;3. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306)
草鱼(Ctenopharyngodon idellus)是世界上重要的淡水养殖品种之一, 但草鱼易患多种疾病, 其中影响很大的是草鱼出血病[1]。草鱼出血病目前还没有有效的治疗方法[2], 因此给草鱼养殖业造成了巨大的经济损失[3]。
先天性免疫反应作为鱼类抵御病原体入侵的重要屏障, 在抵御草鱼出血病中起到了重要作用[4]。先天性免疫反应的组成成分之一是淋巴细胞, 当环境中存在病原体时, 淋巴细胞会给通过先天性免疫反应给宿主发送危险信号[5]。草鱼出血病的主要特征是各个组织的充血状态, 病毒的攻击会导致血液免疫力的变化, 血液作为免疫反应的一道重要屏障,可以将免疫细胞从一个部位输送至另一个部位, 充当了免疫系统的管道[6], 血液中产生抗体的B淋巴细胞(浆细胞)更是免疫应答的效应子[7], 可以增强淋巴细胞对GCRV病毒的抵抗能力。
作为先天性免疫反应中重要的调控因子, NF-κB信号通路的激活可以抑制GCRV病毒的感染,BCL10(B-cell lymphoma)基因作为NF-κB通路的上游调节剂, 可以激活NF-κB的信号传导来抑制病毒复制。目前关于BCL10基因的研究主要集中在人类上[12],BCL10基因最初是从与黏膜相关淋巴样组织克隆出来的, 它通过将含有CARD的支架蛋白与MALT1对半胱氨酸酶桥接来充当NF-κB信号的诱导剂。而BCL10在鱼类抗病研究中鲜有报道, 有研究表明BCL10可以促进淋巴细胞的存活[13], 而BCL10表达的缺乏还会导致适应性免疫反应的缺乏[14], 说明BCL10在免疫反应方面起着重要作用。
在本研究中, 我们观察到草鱼感染GCRV后血液中淋巴细胞的形态和数量均发生了显著变化, 并且克隆了与之相关的BCL10基因。此外, 还研究了BCL10基因在草鱼各个组织中表达情况, 为今后研究BCL10基因在鱼类先天性免疫反应中的机理提供了参考依据。
1 材料与方法
1.1 实验材料
实验用草鱼来自上海海洋大学团头鲂遗传与育种中心, 所有的实验都是按照上海海洋大学动物实验伦理委员会批准的指导方针进行的。总共使用了60尾草鱼, 平均重量为4.4—6.0 g。本实验中所有草鱼取组织前都先用100 mg/L的MS222(三卡因甲磺酸盐, Sigma)处理。快速取草鱼组织储存在-80℃冰箱中。
1.2 草鱼出血病攻毒实验
实验在2个盛有100 L水的充气玻璃缸(120 cm×40 cm×30 cm)中进行, 对照组和实验组每组30条草鱼, 在病毒注射之前, 将草鱼置于(28±1)℃的水温中暂养1周, 每天投喂2次, 确认无任何疾病后进行攻毒实验。采用腹腔注射的方式, 对照组按20 μL/g的剂量注射无菌PBS溶液, 实验组按20 μL/g剂量注射GCRV-II型病毒。该病毒由中国科学院水生生物研究所汪亚平团队赠送, 毒株S2片段与典型的II型菌株GCRV-HZ08高度相似(98.4%), 被归为II型GCRV, 命名为GCRV-II, 病毒滴度为2.97×103copy/μL[15]。在注射完GCRV后, 对照组24h后随机抽取10条草鱼, 而实验组在1d、4d和7d随机选择10条鱼麻醉后尾静脉采血方式收集血液, 并进制备血涂片。同时收集鳃、肝胰腺和中肾组织放入-80℃冰箱储存。
1.3 细胞计数及石蜡切片
将收集到的血液样本立即滴上载玻片, 随机轻轻推开。用瑞士-姬姆萨染色液(Baso, 珠海)进行细胞染色。将Wright-Giemsa溶液A(约0.5 mL)添加到涂片中染色1min, 再将Wright-Giemsa溶液B(溶液A的2—3倍)添加到溶液A上, 用胶头滴管混匀, 静置10min, 之后用水轻轻冲洗, 晾干。最后放入光学显微镜(徕卡, 德国, RM2125RT)中观察。每尾选取细胞分布均匀的涂片20片, 在Neubauer计算版上进行细胞计数, 并用以下公式计算:
血液中淋巴细胞数(mm3)=N×25/5×10×200×106式中,N表示5个中方格淋巴细胞总数, 25/5代表5个中方格淋巴细胞数换算为一个大格的淋巴细胞数,10为一个大格的淋巴细胞数换算为1 mL稀释血液中淋巴细胞数, 200为血液稀释倍数, 106则表示1 L=106mL。
从每条鱼上取中肾放入波恩氏溶液中固定20—24h。固定好的组织经过酒精梯度脱水, 二甲苯梯度透明, 石蜡梯度透蜡, 最后放入正方形盒子中包埋。用组织切片机将组织切成5 μm的薄片贴于载玻片之上。采用HE染色法(苏木精与伊红对比染色法)染色, 最后用中性树脂封片。干燥过后用徕卡光学显微镜观察, 并保存观察到的图片。
1.4 cDNA合成及BCL10基因克隆、鉴定
根据试剂盒说明书要求, 将收集的草鱼的血液、鳃、肝胰腺和中肾用TRIzol试剂(TaKaRa, 日本)提取总RNA, 使用1%琼脂糖凝胶电泳和Nano300微量分光光度计(奥盛, 中国, Nano-300)检测RNA质量, 反转录试剂盒(Prime ScriptTMRT regent Kit with gDNA Eraser)用于合成基因全长 CDS序列克隆的第一链 cDNA。
利用本实验室基因组测序结果搜索到了BCL10基因的Scaffold序列, 在草鱼全基因组数据库中找到了CDS编码区, 再将得到的CDS序列放在NCBI上Blast比对, 验证其正确性, 用PCR (reverse transcription PCR, RT-PCR) 的方法对BCL10基因进行克隆, 根据Seamless Cloning Kit无缝克隆试剂盒说明书(碧云天, 中国)设计包含同源臂的引物pEGFP-BCL10-F/ pEGFP-BCL10-R(表 1), PCR扩增BCL10全长, 经 1.2% 琼脂糖凝胶电泳检测阳性后, PCR产物用胶回收试剂盒 (天根, 中国) 进行纯化。送至上海生工有限公司测序, 验证序列。
1.5 进化树分析
通过BLASP和Search对不同物种的BCL10蛋白推测序列进行比较。Compute pI/Mw(http://web.expasy.org/compute_pi)预测蛋白分子量和等电点。https://swissmodel.expasy.org/interactive 在线生物信息学网站预测BCL10蛋白的二级结构。MEGA 6.06构建BCL10系统发育树。
1.6 实时定量PCR(qRT-PCR)分析
运用实时荧光定量PCR技术检测感染草鱼出血病后不同时间段BCL10基因的表达变化, 在CFX96 TouchTMReal-time PCR检测系统 (Bio-Rad)中进行, 使用primer5.0设计荧光定量引物BCL10-F/R (表 1), 以草鱼18S rRNA作为内参基因(18SF/R)[16], 目的基因相对表达量用 2-ΔΔCt方法计算, 用SPSS Statistics 17.0软件进行单因素方差法分析。
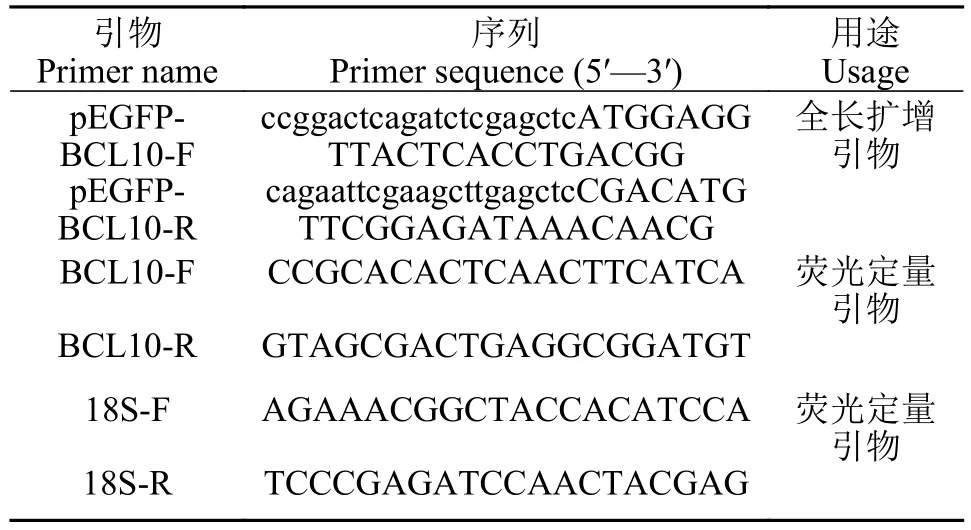
表1 所用引物序列Tab. 1 Primers used in this study
1.7 统计分析
统计结果(表示为平均值±标准偏差)是通过单向方差分析获得的, 然后使用IBM SPSS Statistics 22软件进行Dunnett检验进行多次比较。P值<0.01和<0.05被认为具有统计学意义。所有实验至少重复3遍。
2 结果
2.1 感染期间血液及肾组织变化
注射GCRV病毒以后, 草鱼血液中的淋巴细胞的变化如图 1所示, 在对照组中淋巴细胞的数量为(12.13±1.52)×106ind./mL, 与对照组相比, 第1天淋巴细胞数目下降, 第4天显著下降, 达到最小值。第7天淋巴细胞数目与对照组相比显著下降, 与第4天相比数目上升。对照组中草鱼的中肾组织排列整齐, 第1天基膜间隙开始出现, 第4天时出现了空泡化现象, 第7天时出现了严重的空泡变性, 脱落坏死的现象, 大量的炎性细胞浸润了肾组织(图 2)。
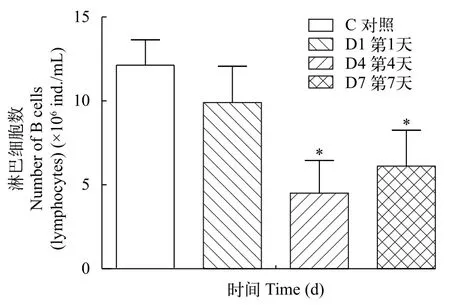
图1 感染GCRV以后淋巴细胞的数量变化Fig. 1 Changes in the number of lymphocytes after infection with GCRV
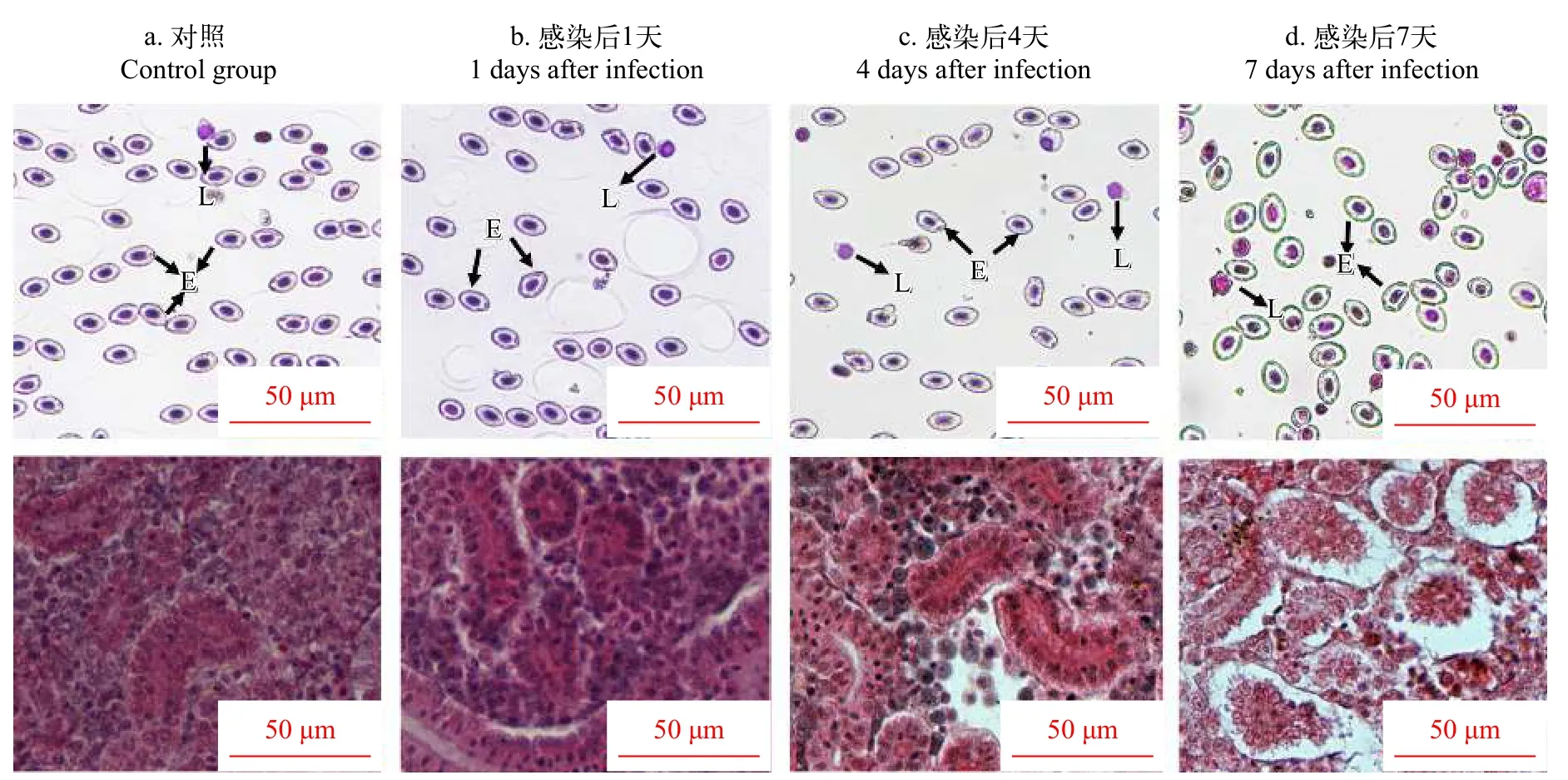
图2 感染GCRV以后血液及肾组织病理学变化Fig. 2 Pathological changes of blood and kidney after GCRV infection
2.2 草鱼BCL10 cDNA序列
本文克隆的草鱼BCL10基因序列开放阅读框为738 bp, 编码245个氨基酸。经预测其蛋白分子量为 26644.73 ku, 等电点 (pI) 为5.28。通过NCBI BLASP发现,BCL10基因广泛存在于硬骨鱼中,包括鲤科、脂鲤科和遮目鱼科。通过在线生物信息学网站https://swissmodel.expasy.org/interactive 预测了草鱼BCL10基因的二级结构(图 3), 发现人类、斑马鱼与草鱼BCL10二级结构都以α螺旋为主, 而且结果相似。系统发育树分析也表明草鱼BCL10与其他硬骨鱼种的直系同源体均有良好的聚类关系(图 4), 并且由于物种的巨大进化分离, 鱼类BCL10序列分为不同的进化枝。
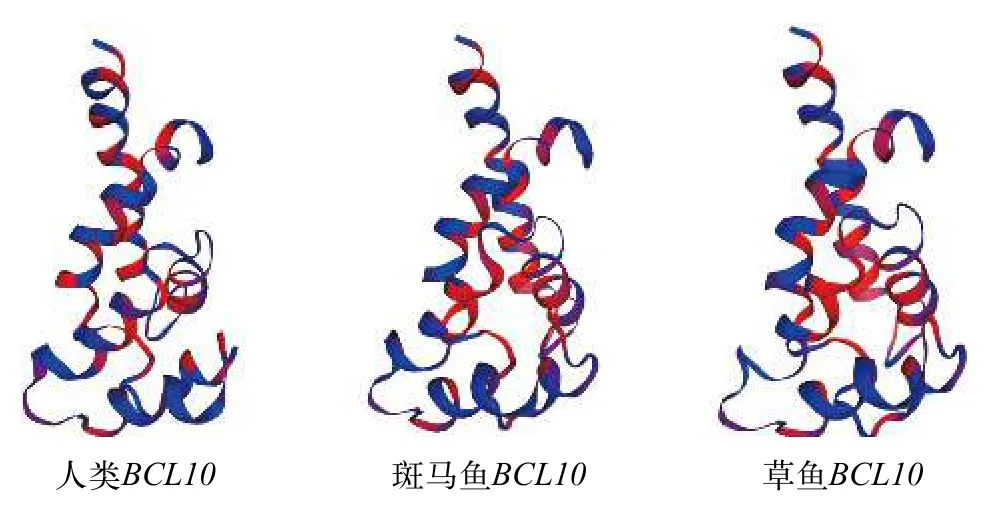
图3 预测人类、斑马鱼及草鱼BCL10二级结构Fig. 3 The predicted the secondary structure of BCL10 in human,zebrafish and grass carp

图4 草鱼BCL10基因序列构建的系统进化树Fig. 4 Phylogenetic tree of grass carp BCL10 sequences in vertebrates
2.3 感染GCRV后BCL10基因表达变化
为了研究草鱼在感染GCRV以后BCL10基因在各组中的表达情况, 按20 μL/g注射含GCRV的组织匀浆液以后, 荧光定量 qRT-PCR检测发现, 与对照组0天相比, 第1天草鱼BCL10基因在鳃和肝胰腺中表达量增加, 在血细胞和中肾中表达量显著增加,第4天BCL10在血细胞、鳃、肝胰腺和中肾中表达量均显著增加, 第7天BCL10在血细胞和鳃中表达量显著下降, 肝胰腺和中肾中表达量下降(图 5)。
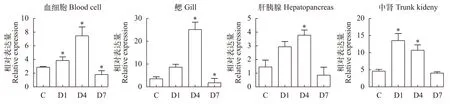
图5 感染GCRV后BCL10在血细胞、鳃、肝胰腺和中肾中的表达情况Fig. 5 The effect of GCRV on the expression of BCL10 in blood cells, gills, hepatopancreas and trunk kidney
3 讨论
3.1 感染GCRV后肾组织及淋巴细胞变化分析
鱼类肾脏可以通过血液循环清除代谢废物和调节离子平衡来维持机体的稳定, 是鱼体重要的免疫器官之一, 随着GCRV病毒的入侵, 肾脏中细胞逐渐空泡变性及脱落坏死, 而坏死的肾脏最终会破坏机体的血液循环系统。
转录组学分析表明GCRV入侵鱼体后会引起一系列凝血[18,19]及炎症反应, 表明了病毒会入侵了血液的免疫系统。淋巴细胞是先天性免疫反应的一道重要屏障, 在抵御病毒入侵的过程中起着重要作用[18]。淋巴细胞可以分泌多特异性抗体, 它是一种有效的天然抗体, 可以限制病原体的传播[20]。在病毒入侵鱼体后, 血液中的淋巴细胞数量第7天时的增加, 表明GCRV的诱导激活了血液中淋巴细胞的免疫反应。与GCRV相似的是, 尼罗罗非鱼感染西尼罗河病毒后, 早期淋巴细胞也会广泛活化, 第7天后会产生特异性淋巴细胞[21], 说明了淋巴细胞在抵御病毒的重要作用。
3.2 BCL10序列及功能分析
预测的草鱼BCL10二级结构图与人类、斑马鱼和草鱼BCL20相似, 说明草鱼BCL10基因在长期进化中高度保守。系统发育树分析表明, 草鱼BCL10与其他硬骨鱼种的直系同源体均有良好的聚类关系, 这表明它们是硬骨鱼特异性基因组复制的结果。
作为控制细胞凋亡的基因[21]和NF-κB炎症反应通路上的重要调控因子[23,24], 病毒入侵先天性免疫反应系统后,BCL10起到了重要的调控作用[4]。它可以激活和终止免疫细胞信号, 在GCRV入侵鱼体后,BCL10首先激活免疫细胞, 接着免疫细胞会调节鱼体中由病毒引起的凝血[25,26]和炎症反应, 在先天性免疫反应[23]中起着重要的作用。
3.3 感染GCRV后各组织BCL10表达分析
本研究首次检测了GCRV入侵鱼体后BCL10基因的表达情况。结果显示, 随着GCRV的入侵,BCL10基因表达量在第1和第4天增加, 血细胞和中肾中最为显著, 第4天血细胞、鳃、肝胰腺和中肾中都显著增加, 说明血液和肾作为先天性免疫系统的关键性组成成分[6,27], 会第一时间响应病毒的入侵。研究表明用强毒性GCRV-CL毒株感染后草鱼后, 在鳃、血液和肾脏等组织中病毒拷贝数更高[28],肾脏会启动自噬机制来抑制病毒复制并减轻炎症反应[29]。此外, 肝胰腺也会因为GCRV的感染从而释放储存的铁, 铁超载不利于宿主细胞抵抗病毒感染并对于病原体感染有益[30]。第7天时血液中的淋巴细胞数量升, 说明了体内炎症反应的发生。BCL10基因会起到激活炎症反应的作用, 与其在人体内的功能一致[31]。而第7天表达量的下降可能是由于病毒的大量复制直接加剧了机体的炎症反应, 使得BCL10基因失去了调控炎症的作用。
综上所述, 我们首次观察到了草鱼感染GCRV以后血液中淋巴细胞数量及形态变化, 并且研究了中肾组织的病理学特征及淋巴细胞凋亡相关基因BCL10的表达变化。实验结果表明, 病毒入侵鱼体后BCL10表达量先是升高, 到第7天时又下降到正常水平以下。然而现在关于BCL10在草鱼出血病中的研究还相对缺乏, 本研究为后续BCL10基因功能方面的研究提供了重要的依据, 为BCL10在先天性免疫反应中的相关作用机制提供了线索。
