饥饿再投喂对大鳞副泥鳅生长性能、肝脏抗氧化能力和肠道消化酶的影响
2022-05-27蔡明成孙翰昌谢明地李淳鸿添赵胤年樊汶樵
蔡明成 孙翰昌 谢明地 李淳鸿添 赵胤年 樊汶樵 杨 帆
(1. 重庆文理学院, 园林与生命科学学院, 永川 402160; 2. 西南大学水产学院, 荣昌 402460)
水生动物可能因食物缺乏遭受阶段性饥饿, 将影响动物正常生长、发育、繁殖和存活等[1,2]。饥饿引起水生动物重新分配能量资源, 维持组织器官代谢和生存基本需求, 不同水生动物表现出不同程度耐受性, 如金鱼(Carassius auratus)最长可耐受12d, 草鱼(Ctenopharyngodon idella)最长可耐受约28d[3]。然而, 在恢复正常摄食后, 部分水生动物可表现出超过正常生长的速度, 该现象被称为补偿生长, 受品种、年龄和饥饿-摄食间隔时间等因素影响[4]。郑小东等[5]研究表明, 采用S1F5投喂模式可显著提高长蛸(Octopus minor)末体重。周歧存等[6]采用S1F6和S2F5投喂模式, 发现可激活虎斑乌贼(Sepia pharaonis)补偿生长, 但不影响肌肉营养成分。此外, 饥饿再投喂模式可激活黄鳍鲽(Pleucronectes aspeer)[7]、大西洋鳕(Gudus morrhua)[8]、西伯利亚鲟(Acipenser baerii)[9]、幼鲈(Lateolabrax japonicus)[10]、星斑川鲽(Platichthys stellatus)[11]和条石鲷(Oplegnathus fasciatus)[12]等鱼类补偿机制。因此, 制定合理有效的饥饿再投喂制度, 可有效提高水生动物生产性能, 降低饲料以及劳动成本, 对推动水生动物科学养殖、提高养殖效益具有重要意义。
研究表明, 动物机体在食物匮乏时产生活性氧(Reactive oxygen species, ROS), 当ROS生成速率超过去除速率时, 机体出现氧化应激反应[13]。其产生的自由基可导致细胞DNA、蛋白质及脂质等分子损伤, 最终造成细胞死亡[14]。鱼类属于异温脊椎动物, 其特异性免疫反应能力相对较低, 但具有抗氧化剂清除系统将ROS维持在相对较低水平, 减轻相关的损害[15]。在抗氧化防御系统中, 主要包括过氧化物歧化酶(Hepatic superoxide dismutase, SOD)、过氧化氢酶(Catalse, CAT)和谷胱甘肽过氧化物酶(Hepatic glutathione peroxidase, GSH-PX)等, 还广泛存在非酶抗氧化剂如谷胱甘肽的细胞内水平影响酶类抗氧化剂活性, 且会受到饥饿、缺氧、重金属及温度等不利因素的影响[1,16]。此外, 在饥饿条件下鱼类不仅可以调节消化酶活性, 而且可以改变其消化环境的组成[17,18]。例如, 当卡特拉魮(Gibelion catla)处于饥饿时, 所有的肠道消化酶活性均呈显著降低, 但当重新获得食物后其活性逐渐恢复[19]。另外, 有研究表明, 鱼类肠道消化酶的活性随饥饿时间的延长而发生改变[20]。因此, 研究不同饥饿再投喂模式下抗氧化酶和肠道消化酶活性的变化, 为科学制定投喂模式提供基础数据支撑。
大鳞副泥鳅(Paramisgurnus dabryanus)属于鲤形目(Cypriniformes)、鳅科(Cobitidae), 花鳅亚科(Cobitinae), 副泥鳅属(Paramisgurnus), 除青藏高原外, 我国各地区均有分布[21]。大鳞副泥鳅具有生长速度较快、耐饥饿能力强、肉质细嫩和高蛋白低脂肪等优点, 是一种生产潜力大的养殖品种[22]。目前, 关于大鳞副泥鳅补偿生长的研究较少, 在泥鳅仔鱼的研究中发现, 饥饿再投喂可提高仔鱼增重率和特殊生长率。其中, 饥饿7d后再投喂泥鳅仔鱼体重高于持续饲喂组, 表明短时间饥饿处理可激发泥鳅生长补偿机制[23]。然而, 在补偿生长激活过程中,机体的生理响应激活或抑制情况并不清楚。基于此, 本研究以大鳞副泥鳅为研究对象, 通过不同饥饿-再投喂方式, 检测其对大鳞副泥鳅生长性能的影响。同时, 研究饥饿再投喂模式对大鳞副泥鳅肝脏抗氧化能力和肠道消化酶的影响, 探讨在饥饿胁迫下大鳞副泥鳅的生理响应机制, 为制定高效饲喂策略提供数据支撑。
1 材料与方法
1.1 试验动物
本试验所用大鳞副泥鳅选自于重庆市永川区水产良种繁育中心, 选取的泥鳅暂养于重庆文理学院水产中心。室内控温, 保持水温(22±1)℃, 每日投喂2次(9:00和17:00), 饲料为泥鳅专用全价配合料(粗蛋白质含量为32%), 每次投喂至表观饱食, 每3天换1次曝气24h以上的自来水, 并清理水箱。9d后, 将大鳞副泥鳅分组饲养, 雌、雄随机分箱, 每箱20尾。
1.2 试验分组
本试验共分为4组, 包括持续投喂(对照组)、饥饿2d再投喂4d(S2F4)、饥饿2d再投喂6d(S2F6)和饥饿2d再投喂8d(S2F8; 表 1)。每组设3个重复, 每个重复泥鳅共20尾, 分别饲养于12个水箱(长、宽、高分别为90 cm×50 cm×50 cm), 试验期为30d。

表1 大鳞副泥鳅投喂模式Tab. 1 The feeding model of P. dabryanus
1.3 样本采集
根据不同投喂模式, 在投喂的第0、第15和第30天分别从每个水箱取5尾大鳞副泥鳅, 测定体重和体长, 分离泥鳅内脏并称重; 并将肝脏和肠道进行解剖分离, 用灭菌生理盐水清洗, 用滤纸吸去水分并称重, 保存于-80℃冰箱待用。
1.4 生长性能测定
本试验测定大鳞副泥鳅增重率(Weight gain rate,WGR)、特定生长率(Specific growth rate,SGR)、肝体比(Hepatosomatic index,HSI)、肥满度(Condition factor,CF)和脏体比(Visceral index,VSI), 计算方式如下所示:
增重率(WGR, %)=(Wt-W0)/W0×100%
摄食期内特定生长率(SGR, %/d)=(lnWt-lnW0)×100/t
肥满度(CF, g/cm3)=100×Wt/L3
肝体比(HSI)=100×Wg/Wt
脏体比(VSI)=100×Wv/Wt
式中, 肥满度单位为(g/cm3),W0和Wt各代表泥鳅初始和末体重(g),Wv表示内脏质量(g),Wg表示肝脏质量(g),C表示总摄食饵料量(g),t表示摄食时间(d),L表示泥鳅体长(cm)。
1.5 肝脏抗氧化酶和肠道消化酶活性测定
称取一定质量组织(肝脏和肠道)样本, 按质量(g)∶体积(mL)=1∶9的比例加入无菌生理盐水, 在冰水浴条件下进行机械匀浆, 于4℃, 2500 r/min离心10min, 收集上清液。测定肝脏抗氧化酶活性(包括SOD、CAT和GSH-PX), 肠道消化酶活性, 包括蛋白酶(Protease, PTA)、脂肪酶(Lipase, LPA)和淀粉酶(Amylase, ALA), 以上检测试剂盒均购买于南京建成生物工程研究所, 且参照试剂盒说明书进行测定。
1.6 数据处理与分析
所有数据均以平均值±标准差(mean±SD)表示。利用GraphPad Prism8.0软件进行数据统计分析, 包括单因素方差分析(One-way ANOVA), 双因素方差分析(Two-way ANOVA), 多重比较(Tukey’s)分析, 以P<0.05作为差异显著性判断标准。
2 结果
2.1 周期性饥饿再投喂对大鳞副泥鳅生长性能的影响
在30d周期性饥饿再投喂后, 各组间泥鳅存活率无显著差异。对体重和体长研究发现, S2F8组末体重(15.92±0.57) g显著高于对照组(15.04±0.09) g(P<0.05), S2F8组末体重显著高于S2F6(15.27±0.57) g(P<0.05), 而各组间的末体长不具有显著性差异(P>0.05; 表 2)。另外, S2F8组增重率(36.54±9.36)显著高于对照组(29.34±2.99)和S2F6组(28.96±4.12;P<0.05), 其余各组之间无显著差异。各组间特定生长率均无显著性差异(P>0.05)。在第0和第30天,各组间肥满度、脏体比和肝体比无显著性差异(P>0.05), 而30d后各组大鳞副泥鳅肥满度均显著低于第0天(P<0.05); 对照组、S2F4和S2F8组中30d脏体比显著高于第0天(P<0.05), S2F6组中无显著差异(P>0.05)。另外, 投喂30d后, 各组间肝体比无显著差异(P>0.05; 表 3)。
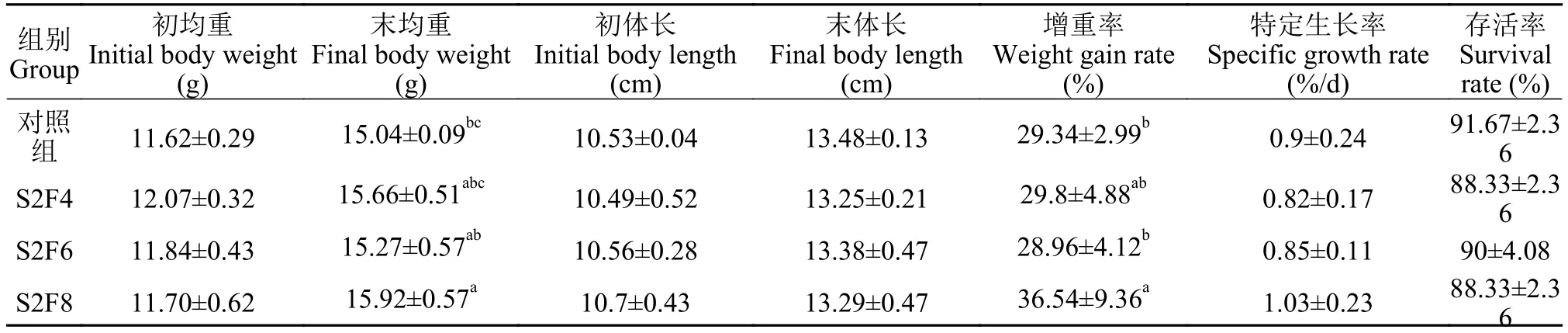
表2 周期性饥饿再投喂对大鳞副泥鳅生长性能的影响Tab. 2 Effect of periodical starvation-refeeding on growth performance of Paramisgurnus dabryanus (mean±SD, n=5)
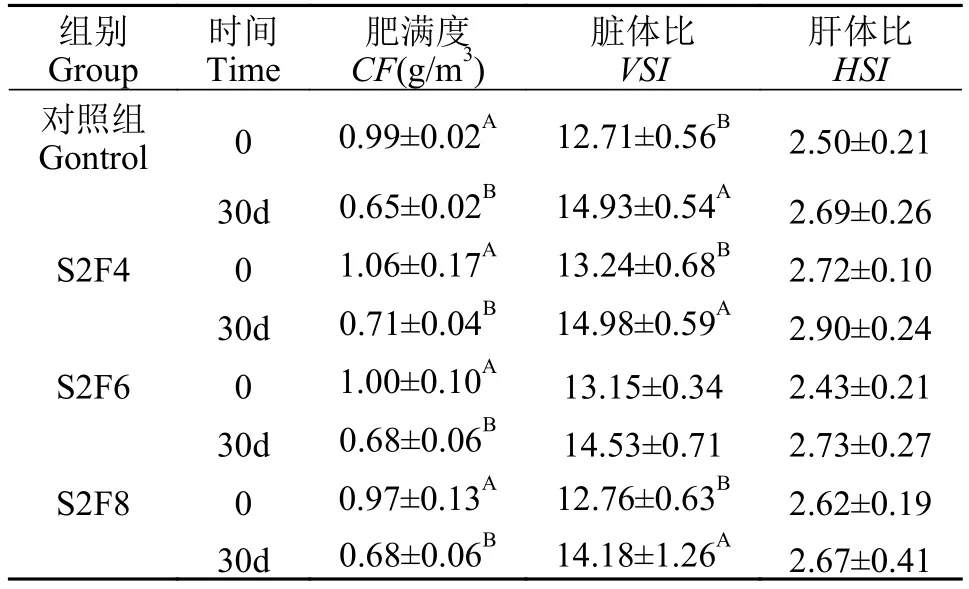
表3 周期性饥饿再投喂第0和第30天肥满度、脏体比和肝体比的差异Tab. 3 The difference of condition factor, visceral index and hepatosomatic index between 0 and 30d during periodical starvation-refeeding (mean±SD, n=5)
2.2 周期性饥饿再投喂对大鳞副泥鳅肝脏抗氧化活性酶的影响
如表 4所示, 随饲养时间增加, 对照组和S2F4组肝脏SOD活性呈升高趋势, 但均无显著性差异(P>0.05); 在S2F6组中, 第30天 SOD活性呈显著高于第0天(P<0.05); 在S2F8组中, 第15和第30天SOD活性均显著高于第0天(P<0.05)。在第0天时,各组间SOD活性无显著差异(P>0.05); 第15天时,S2F8组SOD活性显著高于对照组(P<0.05); 第30天时, S2F6和S2F8组SOD活性显著高于对照组(P<0.05)。对肝脏CAT活性研究发现, 对照组CAT活性随饲养时间增加而升高, 但无显著性差异(P>0.05); S2F4组肝脏CAT活性在第30天显著高于第0天(P<0.05); S2F6和S2F8组CAT活性在第15和第30天显著高于第0天(P<0.05); 另外, 第15天时,S2F6和S2F8组肝脏CAT活性显著高于对照组(P<0.05); 第30天时, S2F6组CAT活性均显著高于对照组(P<0.05)。对肝脏GSH-PX活性研究发现,S2F4、S2F6和S2F8组肝脏GSH-PX活性在第15和第30天均显著高于第0天(P<0.05)。此外, 第15天时, S2F6和S2F8组GSH-PX活性显著高于对照组(P<0.05), 且S2F8组GSH-PX活性显著高于S2F6(P<0.05); 在第30天时, S2F6和S2F8组中GSH-PX活性均显著高于对照组(P<0.05), S2F8组GSH-PX活性显著高于S2F4和S2F6组(P<0.05)。
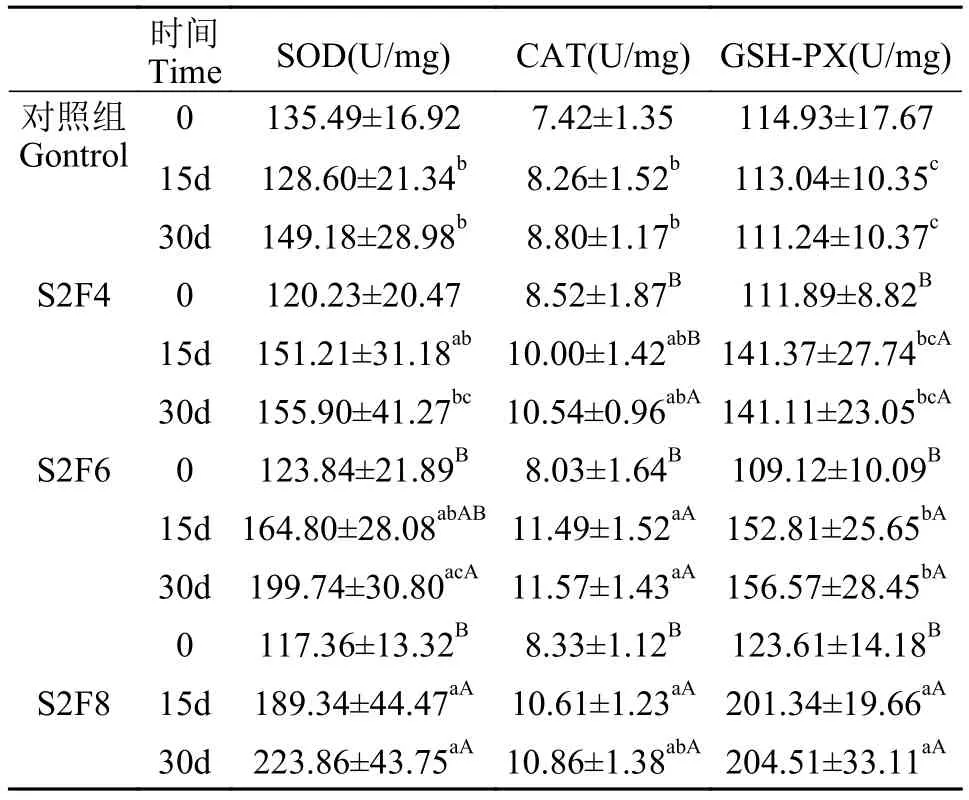
表4 周期性饥饿再投喂对大鳞副泥鳅肝脏抗氧化酶活性的影响Tab. 4 Effects of periodical starvation-refeeding on hepatosomatic antioxidant indices of P. dabryanus (mean±SD, n=5)
2.3 周期性饥饿再投喂对大鳞副泥鳅肠道消化酶的影响
在不同处理时间下, 对照组、S2F4和S2F8组中肠道蛋白酶(PTA)含量呈降低趋势, 但无显著变化(P>0.05), S2F6组中肠道PTA活性在第15和第30天显著低于0(P<0.05)。组间分析发现, 在第0、第15和第30天, 各组间肠道PTA活性无显著差异(P>0.05)。对肠道淀粉酶(ALA)活性研究发现, 各组ALA活性随时间增加均呈减低趋势, 其中S2F6组肠道ALA活性在第30天显著低于0(P<0.05), S2F8组肠道ALA在第15和第30天均显著低于0(P<0.05);另外, 在第0、第15和第30天各组间肠道ALA活性无显著差异(P>0.05)。对肠道脂肪酶(LPA)研究发现, 随时间增加, 对照组LPA活性有升高趋势(P>0.05), S2F4和S2F6组LPA活性呈先升高后下降的趋势(P>0.05), S2F8组LPA活性逐渐降低(P>0.05)。此外, 在第0和第15天时, 各组间肠道LPA无显著差异; 在第30天时, S2F6和S2F8组肠道LPA显著低于对照组(P<0.05; 表 5)。
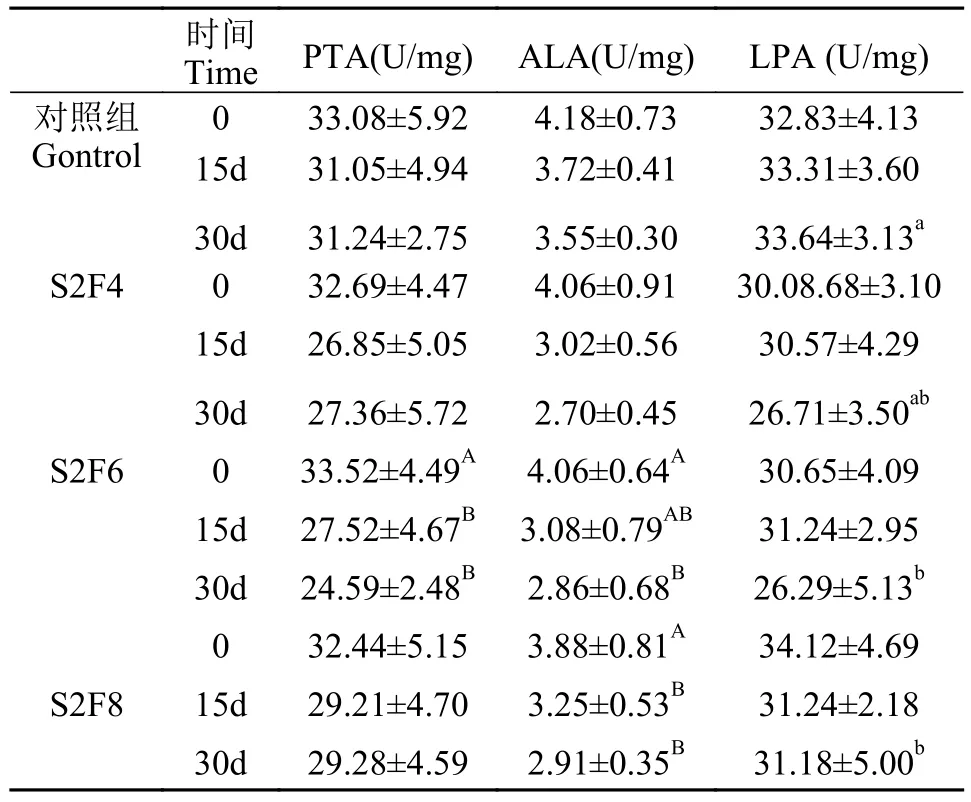
表5 周期性饥饿再投喂对大鳞副泥鳅肠道消化酶的影响Tab. 5 Effects of periodical starvation-refeeding on intestinal amylase of P. dabryanus (mean±SD, n=5)
3 讨论
3.1 饥饿再投喂对大鳞副泥鳅生长性能的影响
在饥饿状态下, 动物通过调整行为和生理状态等机制以获取能量满足代谢需求[24]。在水生动物中, 对饥饿具有不同的耐受力和适应度, 且会表现为补偿生长现象, 补偿生长分为超补偿生长、完全补偿生长、部分补偿生长和不能补偿生长[25]。然而, 不同种类水生动物可因种类、环境、生长状态和饥饿时长等因素产生较大的差异[26]。已有研究表明, 对于补偿生长的判断标准较多, 如将马粪海胆(Hemicentrotus pulcherrimus)的性腺指数和生化组分(水分、蛋白质、脂肪和糖类)作为衡量标准,将成活率和增重率作为无针乌贼(Sepiella japonica)的判断标准[27,28]。在本研究中, 大鳞副泥鳅周期性饥饿再投喂处理后S2F8组中的末体重和增重率显著高于对照组, S2F8组增重率显著高于S2F6,S2F8组表现出超补偿生长能力, S2F4和S2F6两组末体重高于对照组, 但无显著差异, 表现为完全补偿生长能力, 表明周期性饥饿再投喂有助于激发大鳞副泥鳅补偿生长机制。另外, 对大麻哈鱼(Oncorhynchus keta)、牙鲆(Paralichthys olivaceus)进行短期饥饿处理后, 均出现一定的补偿生长能力[29,30]。在本试验中, 对大鳞副泥鳅肥满度和脏体指数在第30天分别显著降低和升高, 肝体指数无显著差异,而各组间无显著差异, 表明饥饿再投喂对大鳞副泥鳅形体指标无显著影响。综上所述, 大鳞副泥鳅在短期周期性饥饿再投喂处理后能提高其生长, 因而从节约成本, 保障泥鳅生长速度来看, 采用S2F8的周期性投喂模式为最佳。
3.2 肝脏抗氧化酶对饥饿再投喂的响应
水生鱼类可利用储存脂质的氧化途径作为能量代谢的主要来源, 然而饥饿会引起ROS的产生,最后引起机体氧化应激[13,31]。鱼类作为低-变温动物, 其免疫应答能力相对较弱, 但具有抗氧化酶系统和非酶系统, 以保持机体内源ROS处于较低水平[32]。其中, SOD、CAT和GSH-PX是关键的抗氧化酶, 且在机体抵抗氧化应激中具有重要作用。SOD主要可将超氧阴离子自由基还原为过氧化氢,且在GSH-PX和CAT作用下将过氧化氢分解为水和氧气[33]。在本研究中, 随着处理时间增长, S2F6和S2F8组SOD活性逐渐升高, 且在第30天时S2F6和S2F8组SOD活性显著高于对照组, 表明饥饿再投喂处理引起大鳞副泥鳅机体产生氧化应激, 大鳞副泥鳅通过调节肝脏SOD活性抵抗氧化应激。在鲟(Acipenser dabryanus)饥饿再投喂研究中[34], 发现SOD活性在血清和肝脏中显著升高, 与本研究结果相似。此外, S2F6和S2F8组大鳞副泥鳅肝脏CAT活性在第15天显著高于对照组, S2F6组在第30天显著高于对照组, 在第15和第30天时, S2F6和S2F8组GSH-PX活性均显著升高, 表明在饥饿再投喂处理中, 随着处理时间增加, CAT和GSH-PX作为抗氧化酶系统关键因子参与大鳞副泥鳅抗氧化途径。以上结果表明, 长时间周期性饥饿再投喂可引起大鳞副泥鳅肝脏SOD、CAT和GSH-PX含量升高, 提高机体抗氧化能力。
3.3 肠道消化酶对饥饿再投喂的响应
在饥饿过程中, 鱼类所需的食物能量来源不足,自身代谢发生适应性改变, 通过消耗体内储存物质(如肝糖原、肌糖原等)以维持生命, 同时消化酶活性将发生改变[26]。在各品种的鱼类中, 饥饿引起的消化酶变化具有不同的规律。有研究表明, 饥饿3d将引起厚颌鲂(Megalobrama pellegrini)稚鱼淀粉酶活性显著增加, 但随饥饿时间增加, 其活性逐渐降低; 脂肪酶活力在饥饿3d后显著降低, 随时间延长却出现逐渐升高[25]。在虎斑乌贼(Sepia pharaonis)中发现, 饥饿2d时, 淀粉酶和脂肪酶活性处于最低水平, 饥饿3d后脂肪酶活性有一定升高[6]。在本研究中, 对大鳞副泥鳅饥饿再投喂后, 在第15和第30天时肠道淀粉酶、蛋白酶和脂肪酶均低于对照组, 表明长时间饥饿再投喂影响肠道消化酶的分泌,降低机体消化吸收能力。持续饥饿再投喂30d后,S2F6组蛋白酶含量显著低于0, S2F6淀粉酶含量显著低于0。在第30天时, S2F6和S2F8组肠道脂肪酶显著低于对照组。由此可知, 饥饿再投喂30d后, 大鳞副泥鳅肠道消化酶活性出现降低趋势, 其中脂肪酶受影响较大。在不同处理时间中, 各组蛋白酶和淀粉酶未发生显著变化, 保持了适当的活性, 可能是机体保证重新获得食物供给后可产生适当的分解反应, 与在黄鳝(Monopterus albus)中消化酶活性的影响相似[35]。综上所述, 长时间周期性饥饿再投喂引起肠道蛋白酶、淀粉酶和脂肪酶显著降低, 说明降低肠道营养物质的吸收利用是大鳞副泥鳅应对饥饿胁迫的主要响应。
4 结论
本文研究了周期性饥饿再投喂对大鳞副泥鳅生长、抗氧化能力和肠道消化酶活性的影响。结果表明, S2F4、S2F6和S2F8均出现补偿生长。周期性饥饿再投喂引起大鳞副泥鳅氧化应激, 导致肝脏抗氧化酶活性升高, 同时消化代谢功能受到影响,肠道消化酶活性降低。其中S2F8处理后增重率显著升高, 且在周期性饥饿再投喂过程中肝脏抗氧化酶和肠道消化酶活性保持较高水平, 优于S2F4和S2F6投喂模式。基于此, 建议以饥饿2d投喂8d的模式, 提高大鳞副泥鳅生长性能, 降低饲养成本。
