晶相对Pt/TiO2催化间硝基苯乙酮加氢性能的影响
2022-05-27谭佳佳何代平段鸣玉
谭佳佳,何代平,段鸣玉
(重庆师范大学 化学学院 绿色合成与应用重庆市重点实验室,重庆 401331)
氨基苯乙酮(AAP)是重要的有机合成中间体,主要由硝基苯乙酮(NAP)还原制备,催化加氢还原法因工艺先进、选择性高和废物排放少受到广泛关注[1-3]。
早期主要用Raney Ni催化剂在较苛刻的反应条件下催化NAP加氢制备AAP[4],AAP的选择性也低。Jackson 等[5]研究了Rh/SiO2催化间硝基苯乙酮(m-NAP)加氢制备间氨基苯乙酮(m-AAP),在优化的反应条件下,m-AAP的选择性达83%。Yin等[6]通过选择载体、活性组分及控制活性组分量制备的0.3% Pt/TiO2催化剂,其活性比Rh/SiO2催化剂提高了45倍,并且m-AAP的选择性达100%。载体的组成、结构直接关系到负载型催化剂的催化性能[7-8]。本文考察了不同晶相TiO2负载质量分数0.3%Pt催化m-NAP制备m-AAP加氢反应性能。
1 实验部分
1.1 试剂与仪器
氯铂酸、3-硝基苯乙酮均为分析纯。
内衬聚四氟乙烯的60 mL不锈钢反应釜;AI-508智能控温器;BSD- PS1-1000型比表面积及孔径分析仪;6100型X射线衍射仪;GC9790 plus型气相色谱仪;Thermo Scientific K-Alpha X射线光电子能谱仪;Tecnai G2 F20透射电子显微镜(TEM)。
1.2 催化剂制备

1.2.2 金红石相 TiO2的制备 在冰水浴中,剧烈搅拌下,将10 mL TiCl4逐滴加入10 mL蒸馏水中,再滴加10 mL无水乙醇,冷却至室温后,用蒸馏水稀释至60 mL,将混合液转移至100 mL带聚四氟乙烯內衬的水热反应釜中,160 ℃反应2 h,自然冷却,过滤,用蒸馏水洗涤至滤液中无Cl-,110 ℃下干燥 10 h,破碎,220目过筛,然后在流动空气中300 ℃焙烧5 h,制得金红石相TiO2,标记为TiO2-R。
1.2.3 0.3%Pt/TiO2的制备 将1.000 0 g TiO2加入到40 mL蒸馏水中,搅拌30 min,然后逐滴加入一定量的氯铂酸水溶液,再搅拌24 h后,逐滴加入一定体积新配制的0.5 mol/L硼氢化钠水溶液,再搅拌5 h,抽滤,洗涤至滤液中无Cl-,所得样品先经 50 ℃ 真空干燥2 h,再在110 ℃空气下干燥10 h,N2气氛中300 ℃焙烧5 h,制得0.3%Pt/TiO2催化剂。
1.3 催化剂表征
催化剂晶相分析在X射线衍射仪上进行,Cu Kα射线,波长为0.154 18 nm。采用氮气吸附法表征样品的比表面积和孔结构。用X射线光电子能谱仪进行催化剂X射线光电子能谱(XPS)测试,Al Kα为X射线源,结合能以碳C 1s为284.6 eV进行校正。采用透射电子显微镜(TEM)观测样品的形貌、粒径及分布情况。
1.4 催化剂性能评价
催化剂性能评价在内衬聚四氟乙烯的不锈钢反应釜中进行。向反应釜中加入一定量催化剂、反应底物和溶剂后,关闭反应釜。先后用氮气和氢气置换掉反应釜中的空气,充氢气至反应所需压力,然后将反应釜置于设定温度的加热器中,开始搅拌和反应计时。反应结束后取出反应釜立即置于冰水浴中使反应停止,打开反应釜,加入一定量的邻二甲苯内标物,混匀后离心分离,用气相色谱分析离心液。
2 结果与讨论
2.1 催化剂的表征结果
表1为TiO2-A、TiO2-R载体的比表面积、孔容和平均孔径。
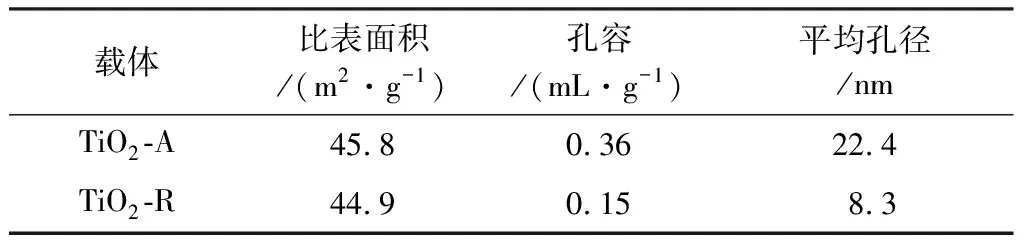
表1 TiO2载体的比表面积和孔结构Table 1 Specific surface area(SBET) and pore structure of TiO2 support
由表1可知,载体TiO2-A的比表面积(45.8 m2/g)与TiO2-R的比表面积(44.9 m2/g)接近,而TiO2-A载体的孔容积和平均孔径为0.36 mL/g和22.4 nm,是TiO2-R载体的孔容(0.15 mL/g)和平均孔径(8.3 nm)的2.4倍和2.7倍。
图1为TiO2-A、0.3%Pt/TiO2-A、TiO2-R和 0.3%Pt/TiO2-R的XRD谱图。
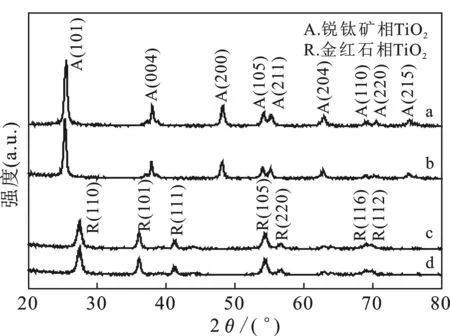
图1 TiO2-A(a)、0.3%Pt/TiO2-A(b)、 TiO2-R(c)和0.3%Pt/TiO2-R(d)的XRD谱图Fig.1 X-ray diffraction patterns of TiO2-A(a),0.3%Pt/TiO2-A(b),TiO2-R(c) and 0.3%Pt/TiO2-R(d)
由图1可知,TiO2-A和0.3%Pt/TiO2-A均在2θ为25.2,37.8,48.0,53.9,55.1,62.7,68.8,70.2,75.1°处出现了衍射峰,与锐钛矿相TiO2标准衍射峰(JCPDS Card No.21-1272)[9]吻合。TiO2-R和 0.3%Pt/TiO2-R都在2θ为27.4,36.1,41.0,54.3,56.7,68.9,69.8°处出现了衍射峰,与金红石相TiO2标准衍射峰(JCPDS Card No.21-1276)[10]一致。在 0.3%Pt/TiO2-A和0.3%Pt/TiO2-R催化剂的XRD谱图中均未观察到Pt的特征衍射峰[11],可能是Pt粒子在TiO2载体上高度分散所致。
图2是0.3%Pt/TiO2-A和0.3%Pt/TiO2-R的TEM图及Pt颗粒的粒径分布图。
由图2可知,Pt在TiO2-A和TiO2-R上均高度分散,这与0.3%Pt/TiO2-A和0.3%Pt/TiO2-R的XRD结果一致。0.3%Pt/TiO2-A催化剂中Pt颗粒的平均粒径为2.28 nm,0.3%Pt/TiO2-R催化剂中Pt颗粒的平均粒径4.63 nm。可见,Pt颗粒在锐钛矿相TiO2上分散得更好,粒径更小。
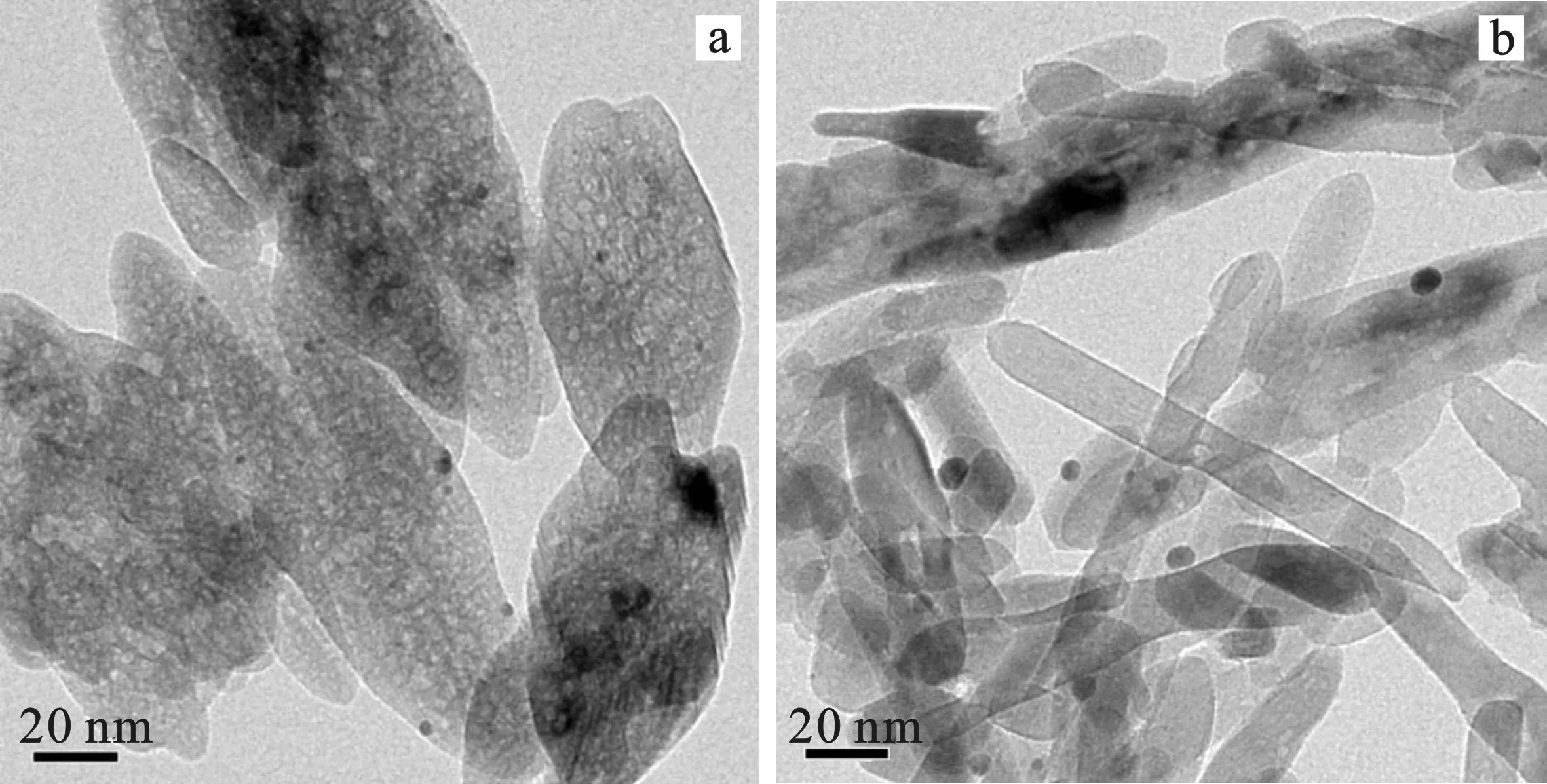
图2 0.3%Pt/TiO2-A(a)和0.3%Pt/TiO2-R(b) 的透射电镜图Fig.2 TEM images of 0.3%Pt/TiO2-A(a) and 0.3%Pt/TiO2-R(b)
图3给出了0.3%Pt/TiO2-A和0.3%Pt/TiO2-R催化剂中Pt 4f和Ti 2p的XPS谱图。

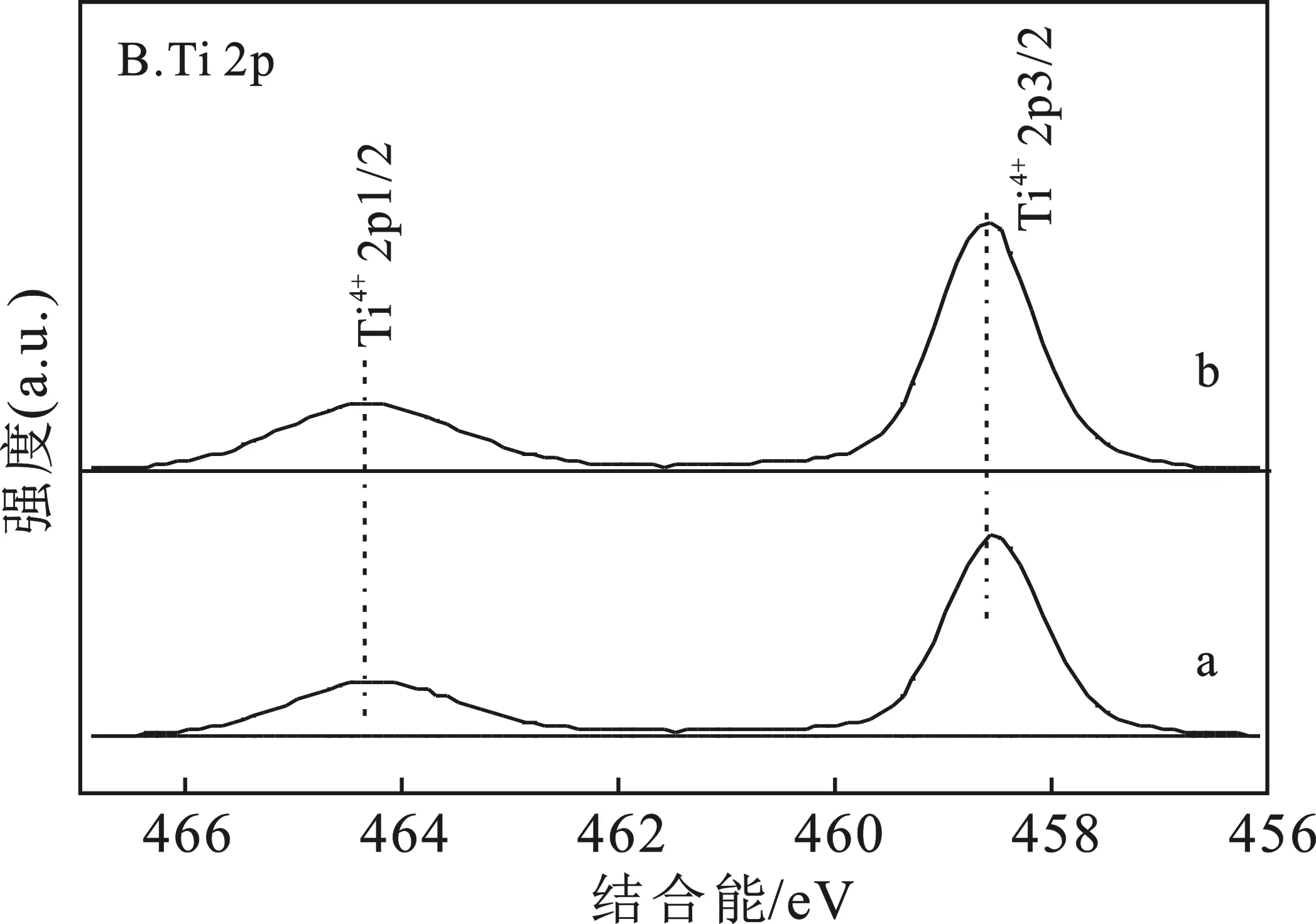
图3 0.3%Pt/TiO2-A和0.3%Pt/TiO2-R中 Pt 4f (A)和Ti 2p (B)的XPS谱图Fig.3 Pt 4f(A) and Ti 2p(B) XPS spectra of 0.3%Pt/TiO2-A and 0.3%Pt/TiO2-Ra.0.3%Pt/TiO2-A;b.0.3%Pt/TiO2-R
由图3A中a可知,0.3%Pt/TiO2-A催化剂中 Pt 4f7/2、4f5/2的结合能分别为 71.2 eV 和 74.5 eV,相对Pt本体金属态Pt04f7/2、4f5/2的结合能(分别为71.0,74.3 eV[12]),0.3%Pt/TiO2-A中Pt 4f的结合能向高结合能方向移动了 0.2 eV。由图3B中a可知,0.3%Pt/TiO2-A催化剂中 Ti 2p3/2、Ti 2p1/2的结合能分别为 458.6 eV 和 464.2 eV,与TiO2中 Ti 2p3/2、Ti 2p1/2 的结合能 458.7 eV 和 464.3 eV[13]相比,向低结合能方向移动了0.1 eV。这表明0.3%Pt/TiO2-A催化剂中Pt与TiO2-A存在电子相互作用。由图3A中b可知,0.3%Pt/TiO2-R催化剂中Pt 4f7/2、4f5/2的结合能为71.0,74.3 eV,与Pt本体金属态Pt04f7/2、4f5/2 的结合能相同;由图3B中b可知,Ti 2p3/2、Ti 2p1/2 的结合能为 458.7 eV 和 464.3 eV,与TiO2中Ti 2p3/2、Ti 2p1/2 的结合能一样,表明 0.3%Pt/TiO2-R 催化剂中Pt与TiO2-R不存在电子相互作用。
2.2 0.3%Pt/TiO2的催化性能
表2为0.3%Pt/TiO2催化m-NAP加氢制备m-AAP 反应结果。
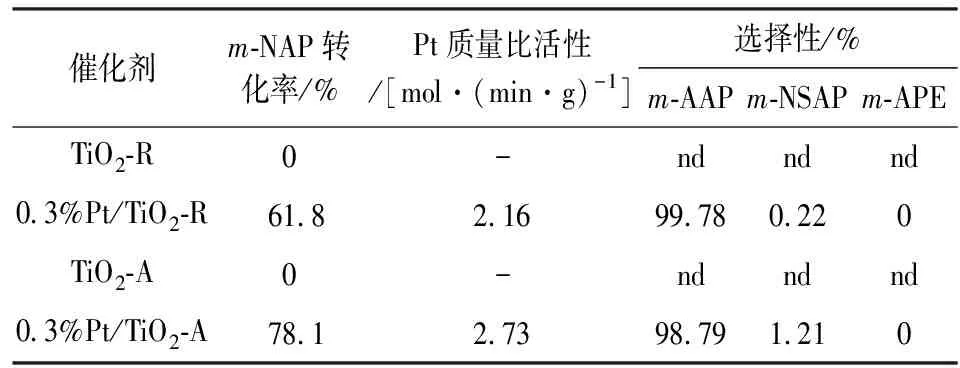
表2 0.3%Pt/TiO2催化m-NAP加氢反应性能Table 2 Catalytic performance of 0.3%Pt/TiO2 for m-NAP hydrogenation
由表2可知,在相同反应条件下,载体TiO2-A和TiO2-R均无催化活性;0.3%Pt/TiO2-R催化m-NAP 加氢的转化率为61.8%,以Pt计的质量比活性是 2.16 mol/(min·g);0.3%Pt/TiO2-A 催化m-NAP 加氢的转化率为78.1%,以Pt计的质量比活性是2.73 mol/(min·g),为0.3%Pt/TiO2-R催化剂活性的1.26倍。结合N2物理吸附、TEM和XPS等表征结果,Pt在TiO2-A上分散更好,粒径更小,有利H2分子活化;0.3%Pt/TiO2-A催化剂中Pt与TiO2-A存在电子相互作用使Pt处于缺电子态,有利硝基活化。这可能是0.3%Pt/TiO2-A比0.3%Pt/TiO2-R催化剂对催化m-NAP加氢制备m-AAP具有更优异性能的原因。
2.3 反应条件的影响
图4是不同反应温度下0.3%Pt/TiO2-A催化3-NAP加氢反应结果,其它反应条件同表2。
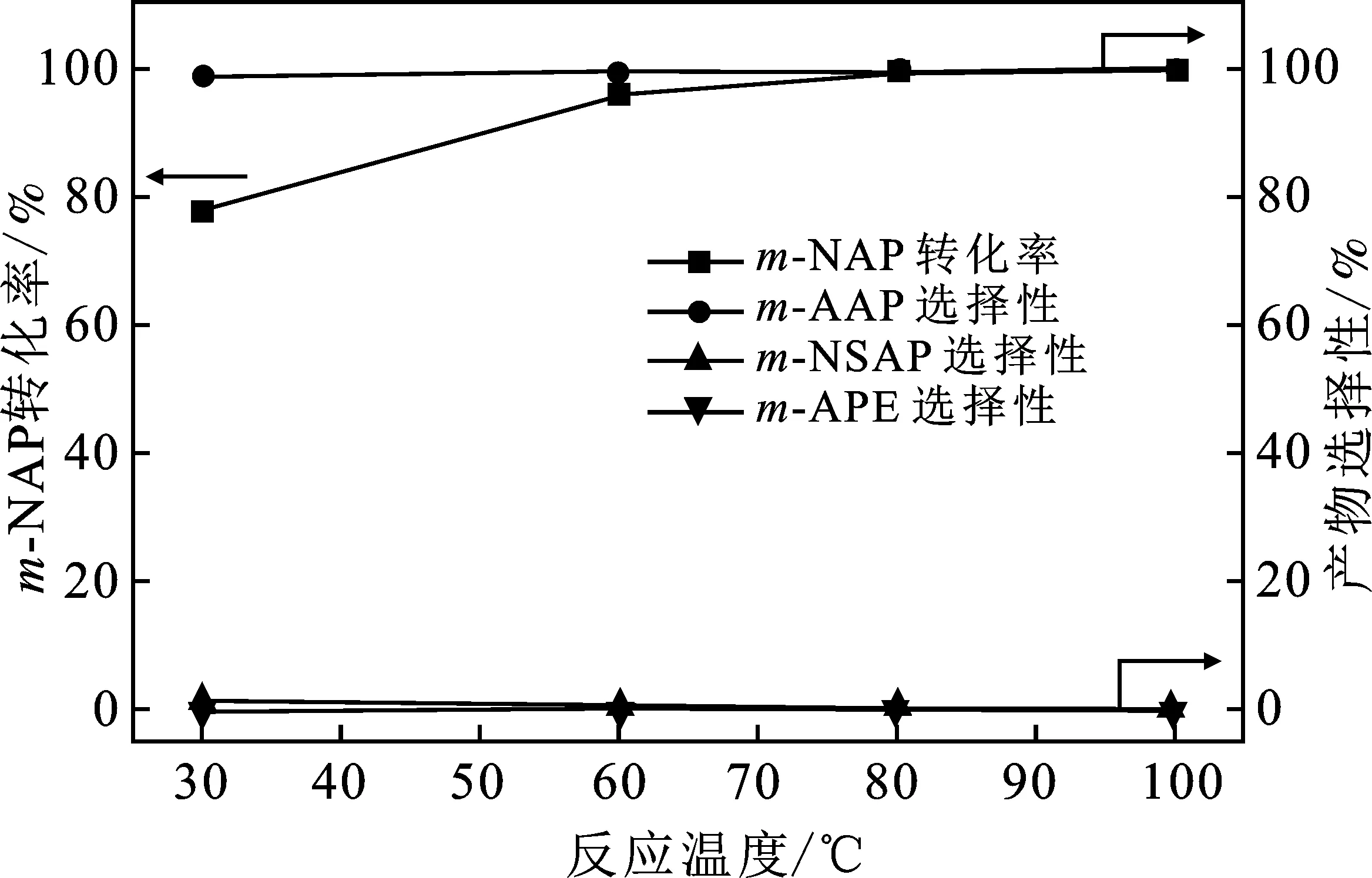
图4 反应温度对0.3%Pt/TiO2-A催化 m-NAP加氢性能的影响
由图4可知,当反应温度从30 ℃提高至80 ℃时,不仅m-NAP的转化率从78.1%上升到99.3%,而且间亚硝基苯乙酮(m-NSAP)进一步加氢生成目标产物m-AAP,使m-AAP的选择性从98.8%上升到 99.4%。继续提高反应温度,m-NAP完全转化为m-AAP,并且没有检测到m-AAP进一步加氢的副产物间胺基苯乙醇(m-APE)。可见,0.3%Pt/TiO2-A催化m-NAP加氢制备m-AAP具有较宽的温度窗口。
不同氢气压力下0.3%Pt/TiO2-A催化m-NAP加氢反应结果见图5,其它反应条件与表2相同。
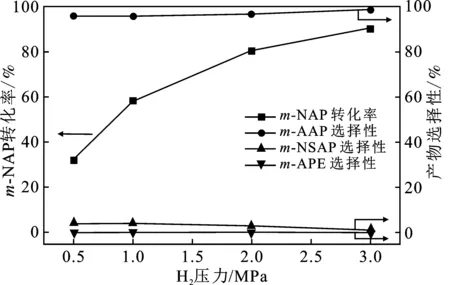
图5 氢气压力对0.3%Pt/TiO2-A催化m-NAP 加氢性能的影响Fig.5 Effect of H2 pressure on catalytic performance of 0.3% Pt/TiO2-A for m-NAP hydrogenation
由图5可知,H2压力对0.3%Pt/TiO2-A催化m-NAP加氢制备m-AAP有显著影响。当H2压力从0.5 MPa增加至3.0 MPa时,m-NAP转化率由32.1%提高到90.6%,提高了1.82倍,m-AAP的选择性从95.9%提升到98.8%,并且没有发生m-AAP进一步加氢生成m-APE的副反应。可见,提高H2压力有利0.3%Pt/TiO2-A催化m-NAP加氢制备m-AAP。
图6是不同反应时间下0.3%Pt/TiO2-A催化m-NAP加氢反应结果,其它反应条件与表2相同。
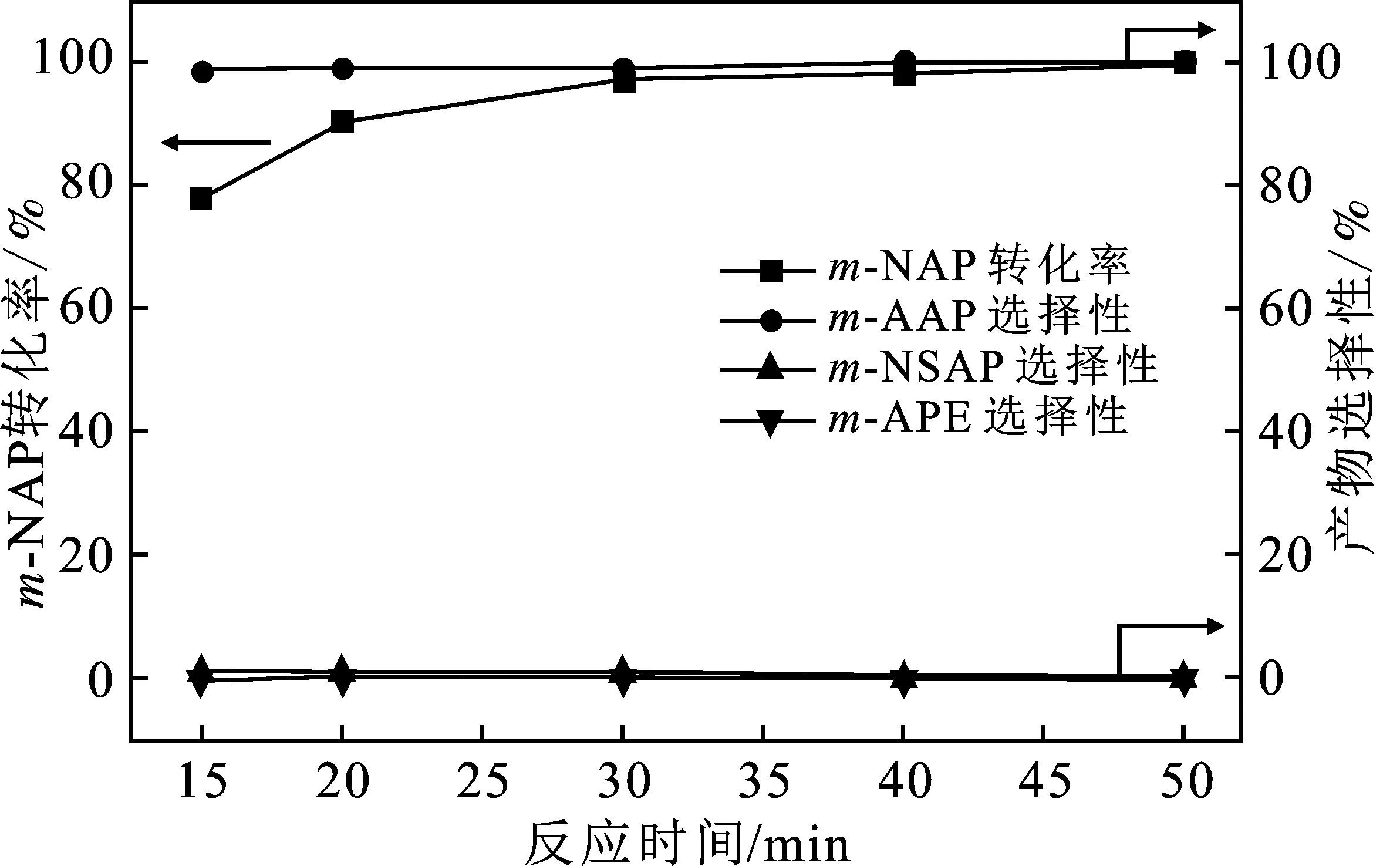
图6 反应时间对0.3%Pt/TiO2-A催化m-NAP 加氢性能的影响Fig.6 Effect of reaction time on catalytic performance of 0.3%Pt/TiO2-A for m-NAP hydrogenation
由图6可知,当反应时间从15 min延长至 50 min 时,m-NAP转化率从78.1%提高到100%,中间产物m-NSAP进一步加氢生成m-AAP,m-AAP选择性从98.8%增加至100%,并且没有发生m-AAP 的进一步加氢反应。可见,适当延长反应时间有利m-NAP加氢制备m-AAP。
3 结论
(1)TiO2的晶相对0.3%Pt/TiO2催化m-NAP加氢制备m-AAP有明显影响,锐钛矿相TiO2负载0.3%Pt对催化m-NAP加氢制备m-AAP具有优异性能,可在温和的反应条件下将m-NAP完全转化为m-AAP。
(2)Pt在锐钛矿相TiO2上分散更好以及它们之间的电子相互作用使Pt处于缺电子态,有利H2分子、硝基活化,这可能是锐钛矿相TiO2负载0.3%Pt对催化m-NAP加氢制备m-AAP具有优异性能的原因。
(3)适当提高反应温度、氢气压力和延长反应时间有利锐钛矿相TiO2负载0.3%Pt催化m-NAP加氢制备m-AAP。
