益生菌合成硒纳米颗粒的表征及其对荧光假单胞菌的抑菌活性研究
2022-05-27杨芙莲
徐 颖, 张 婷, 王 洋, 杨芙莲
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
硒是人类饮食中必不可少的营养素,成年人每天大约需40~60μg的硒作为膳食补充剂.硒纳米颗粒(Selenium nanoparticles,SeNPs)具有低细胞毒性和较高的生物活性[1,2],是一种新型的补硒形态,近年来其合成和应用受到广泛关注[3,4].
传统的合成纳米粒子的方法有物理法和化学法.常见的物理方法包括高温热处理、微波辐照和激光烧蚀等几个重要途径,但其合成成本很高.在化学合成中,一些添加剂、还原剂或稳定剂如乙醛、硼氢化物、十二硫代酸盐和许多化学品被使用.但发现其制备条件很严格,制备过程复杂.在微生物合成过程中,特别是益生菌生物合成SeNPs被广泛应用,其合成的纳米颗粒不易团聚、生物活性更高、原料来源更广.有报道指出嗜酸乳杆菌、嗜热链球菌、干酪乳杆菌可以合成SeNPs[5].目前,生物源硒纳米颗粒已被发现对一些革兰氏阳性菌和革兰氏阴性菌有抑菌活性,在浓度分别为125μg/mL、100μg/mL、100μg/mL、250μg/mL下,对金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌、类肠球菌等多种病原菌的抑制率达到99%[6,7].
荧光假单胞菌(Pseudomonasfluorescens)是一种食源性污染菌,可对包括牛奶和肉在内的冷藏食品造成严重危害[8].荧光假单胞菌分泌的蛋白酶和脂肪酶可以分解乳中的蛋白质和脂肪产生小分子的蛋白质、肽类、氨基酸以及游离的脂肪酸,导致乳制品出现苦味、凝块、脂肪上浮等现象,使乳制品品质显著下降,严重影响货架期[9].在肉制品中,荧光假单胞菌会分泌蛋白酶导致肉产生黏液,降低了加工肉制品的品质和安全性[10].因此,控制荧光假单胞菌的生长对提高食品安全性以及延长食品货架期具有重要意义.
有研究报道了添加精油[11,12]、植物提取物[13,14]、细菌素[15]、生物保鲜剂[16]等物质可以抑制荧光假单胞菌的产生.但精油类物质制作过程繁琐,原料取得不易,无法大量生产,成本高;细菌素的分离纯化过程复杂,有些细菌素的稳定性较差;生物保鲜剂抑制和杀灭微生物的能力有限.基于上述问题,研究发现纳米硒粒子作为新型硒源具有更好的生物利用度和化学稳定性,与其他形式硒相比具有更低的毒性.并且纳米硒已被证明具有多种生理活性,比如抑菌、抗氧化、抗肿瘤以及免疫调节活性等.
目前,对生物合成的SeNPs对荧光假单胞菌的抗菌活性及其可能机制的研究很少.因此,本文在干酪乳杆菌和嗜酸乳杆菌的作用下,生物转化为纳米硒,并对制备的纳米硒进行结构表征.再以荧光假单胞菌的模式菌株和野生型菌株为靶细菌,研究SeNPs对其抗菌性能.通过最小抑菌浓度(Minimum inhibitory concentration,MIC)和细菌生长曲线来考察SeNPs对其抑菌效果.选取模式菌株测定生物膜形成、生物膜胞外多糖含量来分析抑菌机制,为SeNPs应用于冷藏食品中提供理论依据.
1 材料与方法
1.1 材料与试剂
嗜酸乳杆菌(LactobacillusacidophilusZK-AS 1.2686)、干酪乳杆菌(LactobacilluscaseiZK-AS 1.1482)、荧光假单胞菌模式菌株(PseudomonasfluorescensCICC 21620)、荧光假单胞菌野生型菌株(PseudomonasfluorescensBNCC 194799)由实验室提供;亚硒酸钠,山东西亚化学工业有限公司;MRS培养基,LB培养基,北京奥博星生物技术有限公司;其它试剂为常见分析纯.
1.2 主要仪器
TG20KP高速冷冻离心机,长沙东旺实验仪器有限公司;Varioskan Flash全波长多功能扫描读数仪,赛默飞世尔科技有限公司;纳米粒度表面电位分析仪,英国Malvern公司;紫外-可见-近红外分光光度计,美国安捷伦公司;X射线衍射仪,日本理学Rigaku公司;真空傅里叶红外光谱仪,德国布鲁克Bruker公司.
1.3 实验方法
1.3.1 菌株的活化
将冻干管中的乳酸菌用灭菌的MRS液体培养基充分溶解.接种于MRS培养基中,37 ℃,培养24 h,再活化两代,得到三代菌.放置4 ℃,备用.
1.3.2 纳米硒的合成与分离纯化
(1)纳米硒的合成
将活化后的三代菌,培养至对数期.加2 mL的0.17 mg/mL亚硒酸钠于15 mL的菌液中,37 ℃,培养48 h.
(2)纳米硒的分离纯化
富硒培养后的菌液,8 000 r/min离心10 min,用无菌生理盐水洗涤.无菌水重悬.加100μL 的100 mg/mL溶菌酶,37 ℃,孵育2 h.超声破碎(功率100 W,10 min,破2 s停1 s,在冰浴中进行).12 000 r/min,离心5 min.含1% SDS的Tris-HCl洗涤3次,得到的沉淀重悬于无菌水中.加正辛醇,涡旋混匀.4 ℃下,静置24 h.弃上层,留水相和沉淀.用氯仿、乙醇、无菌水依次洗涤,离心.沉淀即得到硒纳米颗粒.4 ℃保存备用.
1.3.3 硒纳米颗粒的表征
(1)纳米粒度表面电位分析仪表征
将分离纯化的SeNPs重悬于超纯水中,在4 ℃储存下,每隔一周,取样测定纳米硒的粒径、分散系数(PDI)和电位.
(2)紫外分光光度计全波长扫描
利用紫外-可见-近红外分光光度计来进行全波长(200~800 nm)扫描.
(3)X 射线衍射仪(XRD)
将提取的SeNPs冷冻干燥,然后研磨成粉末进行XRD测试.
(4)红外光谱(FT-IR)
将冷冻干燥的样品与烘干的KBr混合(1∶100),研磨均匀,压片.置于傅里叶红外光谱仪中,光谱扫描(波长范围:400~4 000 cm-1).
1.3.4 抑菌活性
(1)最小抑菌浓度测定
按1%接种量将两种荧光假单胞菌(即模式菌株和野生型菌株)菌液接种于LB培养基中,30 ℃,160 r/min,培养至对数期,用0.9%无菌生理盐水重悬并调整菌数为106CFU/mL,制备成菌悬液.在96孔板上第1列加200μL的6.4 mg/mL硒纳米颗粒溶液,第2~8列加入100μL的LB培养基,从第1列吸取100μL的硒纳米颗粒溶液加入到第2列,吸打混匀后取100μL加到第3列,依次重复至第8列再吸出100μL弃掉.第9列以不加硒纳米颗粒作为阴性对照.然后分别在第1~9列中加入100μL的106CFU/mL菌悬液.30 ℃,培养24 h,酶标仪测定OD600.以未见指示菌生长(即OD600不增高)的最低SeNPs浓度为 MIC.
(2)硒纳米颗粒对荧光假单胞菌生长曲线的影响
用LB培养基将荧光假单胞菌模式菌和野生型菌培养至对数期,调整菌浓度为106CFU/mL.每孔先取菌悬液,随后加入SeNPs溶液使其终质量浓度分别为0(CK)、1/16MIC、1/8MIC、1/4MIC、1/2MIC、MIC和2MIC.对照组不添加硒纳米颗粒的菌悬液,30 ℃,每隔2 h测定OD600,到24 h结束,绘制生长曲线.
1.3.5 对生物膜的影响
(1)对生物膜形成的抑制作用
将荧光假单胞菌模式菌株培养至对数期,调整其细菌浓度为106CFU/mL备用.向96孔板每孔中加入菌悬液.随后,向上述菌悬液中加入SeNPs溶液使其终质量浓度分别为0(CK)、1/8MIC、1/4MIC、1/2MIC、MIC和2MIC.以无菌水为对照,每组3次重复,30 ℃,24 h.吸去菌液并使用无菌水将各孔漂洗3~5次.无菌风干燥.结晶紫染色15 min.无菌水反复冲洗.干燥.加入33%冰乙酸溶液(目的:充分溶解生物被膜-结晶紫复合物).在595 nm处测定OD值.按式(1)计算生物膜抑制率.
(1)
式(1)中:OD1指对照组的OD值;OD2指实验组的OD值.
(2)对生物膜胞外多糖的抑制
采用苯酚硫酸法测定胞外多糖含量.
①标准曲线绘制
先配制100μg/mL的葡萄糖标准液,分别取一定量的标准溶液,用蒸馏水定容,使浓度分别为0 mg/mL、0.02 mg/mL、0.04 mg/mL、0.06 mg/mL、0.08 mg/mL、0.1 mg/mL.加入6%的苯酚溶液,充分混匀后滴加浓硫酸,立即摇匀,室温下静置30 min.测OD490 nm.
②胞外多糖含量的测定
将含有不同浓度硒纳米颗粒的菌悬液,离心(10 000 r/min,15 min),吸取上清,加入上清液3倍体积的无水乙醇,涡旋.然后室温静置过夜,高速离心,加PBS稀释沉淀.用蒸馏水作空白,加6%的苯酚溶液于样品中,再加入浓硫酸,充分混匀,静置30 min,测490 nm波长处吸光度值.
2 结果与讨论
2.1 提取的硒纳米颗粒
通过有机溶剂-水分配体系(正辛醇-水)提取和纯化SeNPs,将得到的SeNPs进行冷冻干燥,如图1所示,其为粉红色.

图1 冷冻干燥后的SeNPs
2.2 SeNPs表征
2.2.1 纳米硒的稳定性分析
图2显示了两株乳酸菌提取的SeNPs在4 ℃储存条件下,粒径、PDI和电位随时间变化的情况.其结果发现,SeNPs保存在4 ℃下,粒径没有发生明显的变化,说明硒纳米颗粒可以稳定的保存在4 ℃.Zeta电位可以衡量纳米颗粒表面的有效电荷,其值的大小代表粒子的稳定性.从图2可知,电位值随着时间的延长,其Zeta电位值绝对值最高达30 mV左右.分散系数(PDI)在4 ℃条件下分别增加到0.239、0.267.

(a)干酪乳杆菌
2.2.2 紫外全波长扫描分析
将SeNPs悬浮于超纯水中,用紫外分光光度计进行全波长扫描(200~800 nm),结果显示富硒干酪乳杆菌提取的SeNPs在240 nm处有明显的吸收峰(如图3(a)所示),而富硒嗜酸乳杆菌提取的硒纳米颗粒则在波长为204 nm处有最大吸收峰(如图3(b)所示).Lokanadhan等[17]通过紫外-可见光谱对PF-SeNPs的形成进行了初步确认,发现吸收峰最大值出现在270 nm处,证明了SeNPs的形成.而 Fesharaki等[18]观察到在218 nm和248 nm处出现特征吸收峰.说明也形成硒.
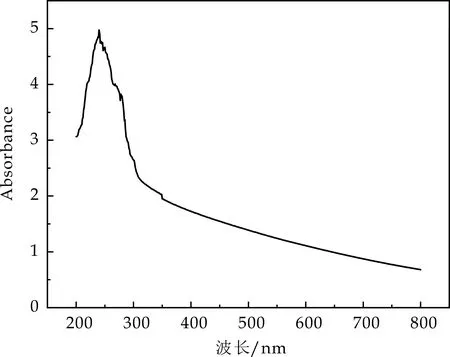
(a)干酪乳杆菌
2.2.3 XRD分析
X射线粉末结晶学是一种重要的晶体相识别技术.由图4可知,SeNPs的XRD谱图显示了更宽的谱图,没有任何确定的布拉格峰.富硒干酪乳杆菌提取SeNPs在2θ为9.60 °和19.26 °处出现了小的峰值,富硒嗜酸乳杆菌提取的硒纳米颗粒在8.57 °和18.98 °处有小的峰.结果表明结构为无定形、非晶态的.王丽红等[19]利用嗜酸乳杆菌LA5转化形成的纳米硒,在X射线衍射图中发现缺少一个尖锐的峰,表明生物合成的SeNPs具有非晶结构.
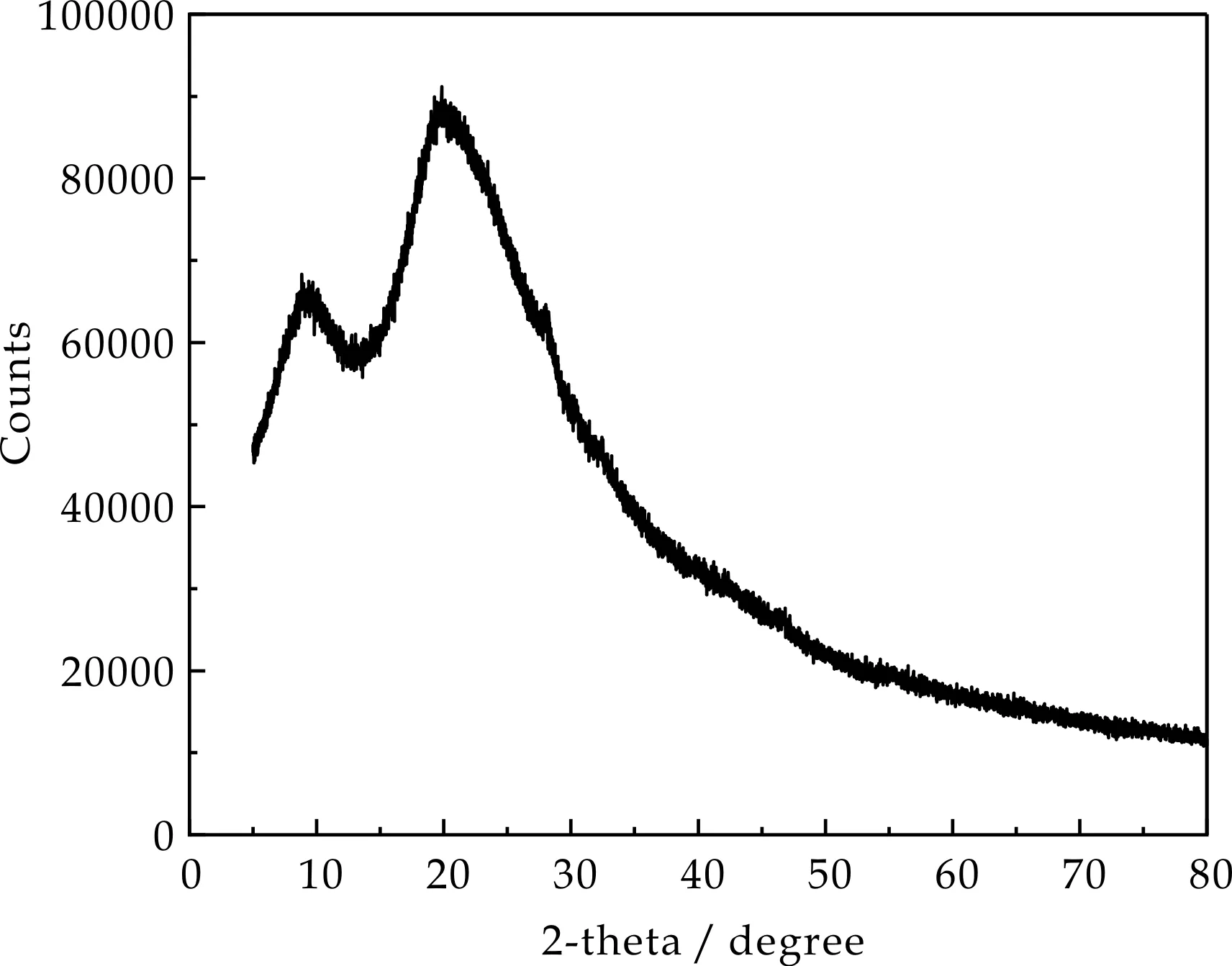
(a)干酪乳杆菌
2.2.4 FTIR分析
由红外光谱图5可知,富硒干酪乳杆菌和嗜酸乳杆菌提取的硒纳米颗粒在3 293/3 297 cm-1波长处有一个吸收峰,代表着蛋白质、糖类和脂类中的-NH和-OH伸缩振动;位于2 932/2 931 cm-1处的特征峰可能是由于饱和脂肪和蛋白、多糖的C-H伸缩振动;1 656/1 655 cm-1的特征峰对应蛋白质酰胺Ⅰ带的C=O与C=C的非对称伸缩振动,该基团与蛋白质相关,对形成的SeNPs的稳定起着关键作用[20];1 540/1 537 cm-1处的小峰由于蛋白质的酰胺Ⅱ带中肽键的C-N和N-H的非对称伸缩振动引起;1 452/1 451 cm-1特征峰源于羧基或蛋白质和脂质中弯曲的CH2/CH3;1 398/1 396 cm-1波段处的峰是蛋白质的酰胺Ⅲ带;1 235/1 236 cm-1为C-H弯曲振动;1 066/1 068 cm-1与多糖的-OH伸缩振动或C-O、C-OH键有关.FTIR结果表明:从2株菌中提取的硒纳米颗粒表面可能包含有蛋白质、脂类和糖类等物质.这与本实验室先前的研究一致[21].不同官能团的存在,可能是负责还原和稳定SeNPs[22].

(a)干酪乳杆菌
2.3 抑菌活性
2.3.1 MIC
采用微量二倍稀释法测定SeNPs对荧光假单胞菌的最小抑菌浓度(MIC).由图6可知,富硒干酪乳杆菌提取的SeNPs对荧光假单胞菌模式菌株的最小抑菌浓度为0.1 mg/mL,野生型菌株的MIC则为0.2 mg/mL.而富硒嗜酸乳杆菌提取的硒纳米颗粒对模式菌株和野生型菌株的MIC都为0.2 mg/mL.
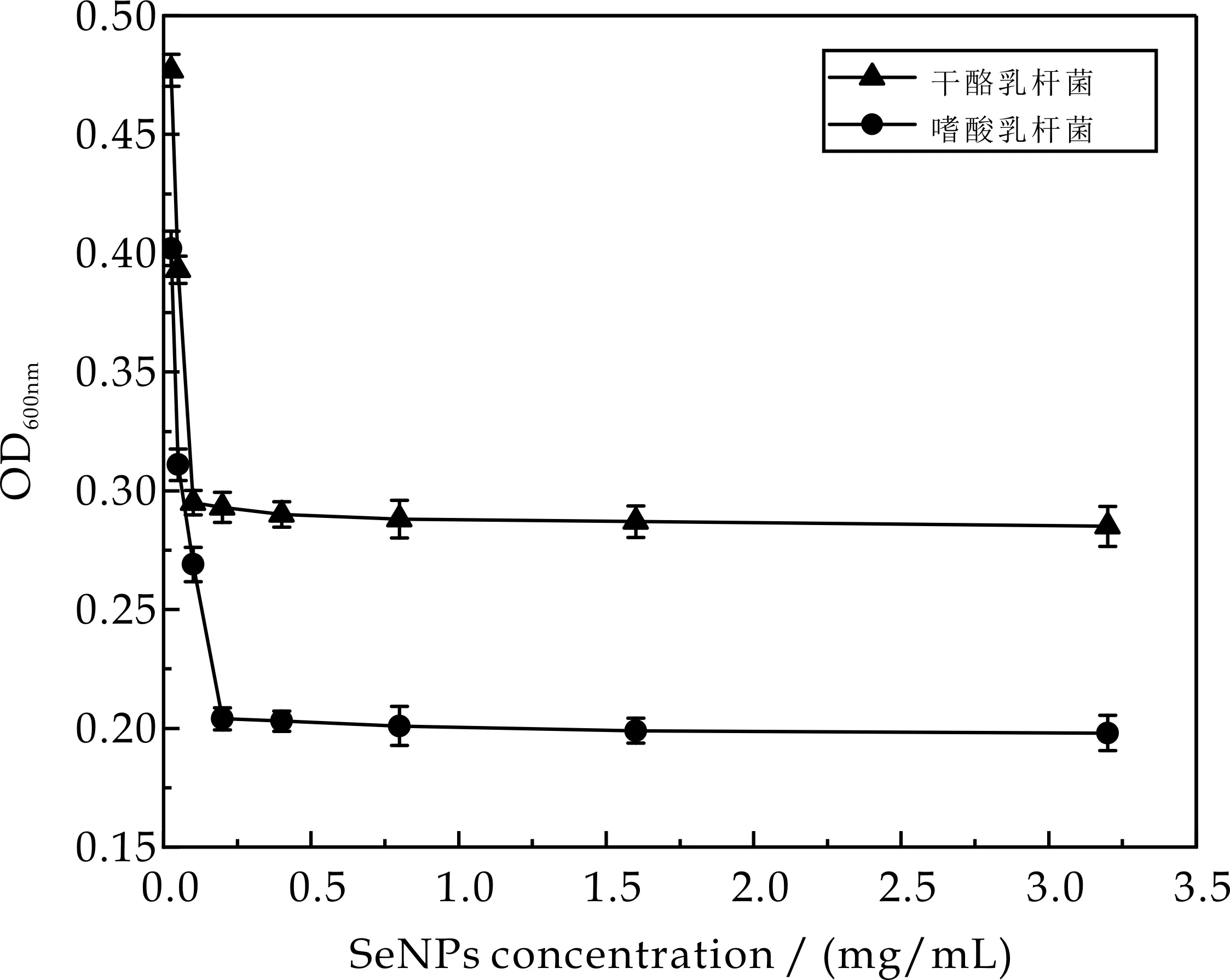
(a)荧光假单胞菌模式菌株
2.3.2 时间-抑菌曲线
图7为SeNPs对两株荧光假单胞菌的抑菌曲线,进一步体现了SeNPs对荧光假单胞菌的抑菌能力.在24 h 内空白对照组荧光假单胞菌生长状况良好,而实验组在0~2 h,有轻微的抑制作用,2 h后OD值增长较快,到12 h左右,作用趋于平缓.浓度越大,OD值逐渐减小,抑制效果增强.随着培养时间的增加,荧光假单胞菌的生长完全受到抑制,表明SeNPs有较强的抑菌能力,并具有良好的抑菌稳定性.

(a)干酪乳杆菌对荧光假单胞菌模式菌抑菌曲线
2.4 生物膜影响
2.4.1 生物膜形成量
近年来,具有抗生物膜活性的绿色合成纳米粒子越来越受到人们青睐.生物膜的形成使微生物腐败变质,并给食品加工业带来巨大的经济损失.研究表明,假单胞菌属可分泌大量胞外多糖形成生物被膜[23,24].
图8表明不同浓度的SeNPs对荧光假单胞菌模式菌株生物膜产生的抑制活性.加入不同浓度的SeNPs后,细菌的生物膜形成量开始减少.随着SeNPs的增大,在595 nm处的吸光度逐渐减小,而抑制率呈增长趋势.与未添加硒纳米颗粒组相比较,差异显著(p<0.05).Nalan等[25]研究了不同浓度的生物源SeNPs对铜绿假单胞菌的生物膜抑制活性.在添加不同浓度的SeNPs后,生物膜的形成开始下降,当浓度增加到2 mg/mL时,对生物膜表现出很强的抑制作用.

(a)干酪乳杆菌
2.4.2 胞外多糖
胞外多糖是构成生物膜的重要成分,因此研究了不同浓度SeNPs作用下,对荧光假单胞菌模式菌胞外多糖产生的影响.多糖浓度-吸光度线性关系为:y=12.539x+0.0629 9(R2=0.999 6).由图9可知,SeNPs可抑制生物膜胞外多糖,在1/8MIC、1/4MIC、1/2MIC、MIC和2MIC作用下,从干酪乳杆菌提取的SeNPs对荧光假单胞菌模式菌株的抑制率增加了15.89±0.41%,嗜酸乳杆菌提取的SeNPs抑制率从21.37±0.27% 增加到34.54±0.59%.这表明,SeNPs能显著抑制荧光假单胞菌模式菌生物膜中胞外多糖的分泌.
关于硒纳米颗粒的抗菌作用机制的研究还很少.一般来说,硒纳米颗粒可能遵循以下三种机制:细胞壁和细胞膜损伤;细胞内渗透损伤;氧化应激[26].本研究中SeNPs的添加减少了生物膜的含量,减弱菌体的活力,降低胞外分泌物的产生,从而实现抗荧光假单胞菌被膜形成的作用,最终抑制菌体的生长.后续将通过对菌体形态的观察,深入探究SeNPs对荧光假单胞菌模式菌株细胞膜的影响.测定丙二醛含量、ROS含量以及常见的三种抗氧化酶(GSH-Px、SOD和CAT)来阐明氧化应激的具体作用.从基因表达水平上,进一步研究其抑菌机理,为抑制冷藏食品中的嗜冷菌提供新思路,减少食品腐败变质.
3 结论
本研究利用两株乳酸菌生物合成SeNPs.对提取的SeNPs表征,发现所合成的SeNPs具有高度的稳定性、负电荷性、非晶性和纳米尺寸.此外,SeNPs对荧光假单胞菌模式菌株和野生型菌株表现出良好的抗菌活性.通过对荧光假单胞菌模式菌株的生物膜形成量和胞外多糖的测试,表明生物合成SeNPs的使用对模式菌株的生物膜结构有显著的破坏作用.综上所述,本研究能够为冷藏食品中的嗜冷菌-荧光假单胞菌的防控提供宝贵的参考意见,同时益生菌合成的纳米硒有望成为一种安全、有效的抗菌剂,应用于冷藏食品中.
