羧甲基纤维素钠改性球状纳米氧化锌的制备及其结构与性能
2022-05-27田振华何静瑄
田振华, 王 颖, 何静瑄
(陕西科技大学 轻工科学与工程学院 轻化工程国家级实验教学示范中心, 陕西 西安 710021)
0 引言
纳米氧化锌(ZnO)是一种面向21世纪的新型高功能精细无机产品,与普通的ZnO材料相比,显示出诸多特殊性能(如压电性、荧光性、吸收和散射紫外线能力等)和用途(如压电阻、荧光体、化妆品、气体传感器、紫外线屏蔽材料、高效能光催化剂和生物医用材料等)[1].目前制备纳米氧化锌常用的方法主要分为固相法、液相法和气相法.其中液相法备受关注,所制备的氧化锌粒径均匀、形貌与尺寸可控,主要包括溶胶-凝胶法、水热法和化学沉积法等.其中水热法操作过程简单、成本较低且制备的氧化锌形貌可适当调节,再辅以微波合成技术加热速度快、受热均匀、无滞后效应等特点,克服了水热容器加热不均匀的缺点,从而缩短反应时间,提高生产效率.然而纳米粒子因其粒径小、比表面积大、表面活性高,极不稳定而易出现团聚现象[2],使得纳米ZnO的许多优异性得不到充分体现,给其应用带来很大的困难,因此解决其分散稳定性差的问题尤为关键.
目前最为常用的分散方法是化学分散法,即表面改性——采用表面添加剂的方法,使粒子表面发生化学反应和物理作用,从而改变粒子表面状态,起到改善粒子分散性的效果.而表面化学改性作为表面改性最重要、最常用的方法,即表面改性剂与粒子表面进行化学反应,从而使表面改性剂覆盖于粒子表面,改变纳米颗粒的表面结构和状态,达到表面改性的目的.王新慧[3]通过硅烷偶联剂KH550和KH560将氨基和环氧基等活性基团接枝到Al2O3表面,提高Al2O3与环氧树脂的相容性,从而改善其分散性.王亮[4]采用共轭亚油酸改性纳米碳酸钙,提高其在环己烷中的分散性能,增强二者间的亲和力,从而更大程度地提高胶黏剂复合体系的耐热性和力学性能.
羧甲基纤维素钠(CMC-Na)是一种分布广泛的长链线性阴离子多糖[5],具有增稠、乳化、分散、悬浮、保护胶体等作用,在化妆品、食品、造纸、纺织、生物制药等行业有着广泛的应用[6].由于其分子上带有大量的羟基和羧基,因此可与金属离子如锌离子形成配位键从而稳定结合.理论上,可将天然高分子表面活性剂——羧甲基纤维素钠原位接枝在纳米氧化锌上,从而借助其高亲水性达到分散纳米氧化锌的目的.Shukla等[7]以羟丙基纤维素(HPC)为空间稳定剂,采用溶胶-凝胶技术,在乙醇溶液中水解缩合Zr(IV),合成了纳米氧化锆粉体,HPC的存在不仅减小了纳米粒子的粒径,还减少了纳米颗粒的团聚.Teng等[8]以Al(NO3)3为前驱体,加入CMC-Na,通过溶胶-凝胶法制备纳米氧化铝,CMC-Na的引入防止了纳米粒子的团聚并且改善了Al2O3分散液的稳定性.
本文以六水合硝酸锌和三乙醇胺作为原料,利用微波水热法制备球状纳米ZnO,同时原位引入CMC-Na接枝改性,并对改性前后纳米粒子的结构、形貌和性能等进行了一系列表征,以期制备晶型良好、粒径可控的纳米氧化锌,并且改性后的氧化锌分散均匀,稳定性有所提高,具有良好的吸附和光催化性能.
1 实验部分
1.1 主要试剂和仪器
(1)试剂:六水合硝酸锌,分析纯,国药集团化学试剂有限公司;羧甲基纤维素钠(CMC-Na),分析纯,上海阿拉丁生化科技股份有限公司;三乙醇胺、无水乙醇,分析纯,天津富宇精细化工有限公司;亚甲基蓝(MB),超级纯,上海阿拉丁生化科技股份有限公司.
(2)仪器:MDS-10微波消解仪,上海新仪微波化学有限公司;Vertex70傅立叶变换红外光谱仪,德国Bruker公司;D8 Advance X-射线衍射仪,德国Bruker公司;Nano-ZS纳米粒度表面电位分析仪,英国Malvern公司;TU-1900紫外可见分光光度计,北京谱析通用仪器有限公司;S4800场发射扫描电镜,日本理学公司;CEL-HXF300-T3氙灯光源,北京中教金源科技有限公司.
1.2 改性纳米氧化锌的制备
在0.01 mol/L的六水合硝酸锌溶液中分别加入不同质量的CMC-Na使其最终质量分数为0、0.02%、0.04%、0.06%、0.12%和0.20%.将1.2 mol/L的三乙醇胺水溶液加入到一定量的无水乙醇中,并与上述硝酸锌溶液混合搅拌1 h至溶液混合均匀后转移到聚四氟乙烯反应釜中,用微波消解仪在600 W的条件下快速升温至180 ℃反应15 min.待冷却到室温后,将反应产物离心,用乙醇和水反复洗涤3次并于60 ℃干燥6 h,研磨得到白色粉末状产物即不同用量CMC-Na改性纳米氧化锌,依次命名为ZnO、0.02%C-ZnO、0.04%C-ZnO、0.06%C-ZnO、0.12%C-ZnO和0.20%C-ZnO.
1.3 改性纳米氧化锌的表征
1.3.1 场发射扫描电子显微镜(SEM)
将样品分散于导电胶上,经真空喷金后采用SEM观察改性前后纳米ZnO的微观形貌,电压为5 kV,放大倍数20 000.
1.3.2 粒径测试
分别将ZnO、0.02%C-ZnO、0.04%C-ZnO、0.06%C-ZnO和0.12%C-ZnO分散于去离子水中,搅拌并超声使纳米粒子充分分散,制得浓度为0.1 mg/mL的分散液.通过纳米粒度表面电位分析仪(DLS)测得纳米氧化锌的粒径大小和分散液的多分散性指数(PDI).
1.3.3 傅里叶红外光谱(FT-IR)
准确称取2 mg纳米氧化锌粉末与200 mg溴化钾共混研磨进行压片,采用傅里叶红外光谱仪(FT-IR)扫描测得改性前后纳米氧化锌的红外图谱.扫描范围为4 000 ~ 400 cm-1,分辨率为4 cm-1,扫描32次.
1.3.4 X-射线衍射(XRD)
采用X-射线衍射仪(XRD)表征改性前后纳米ZnO的晶型.CuKα作为X射线源,额定电压为40 kV,电流为40 mA,扫描速度2 °/min,衍射角2θ范围为10 °~80 °.
1.3.5 分散稳定性实验
分别配制20 mg/mL的ZnO、0.02%C-ZnO、0.04%C-ZnO、0.06%C-ZnO和0.12%C-ZnO的分散液,观察不同静置时间下(0 min、5 min、1 h、3 h、4 h、5 h、6 h、7 h)分散液的稳定性.
1.3.6 吸附实验
将20 mg的ZnO与C-ZnO分别置入100 mL 30 mg/L的MB水溶液中,搅拌并超声使其充分分散后置于暗处磁力搅拌60 min.每隔10 min取4 mL反应溶液,离心取上清液并于664 nm处测定吸光度,根据亚甲基蓝标准曲线(y= 0.044x,R2= 0.999)计算对应浓度,根据公式(1)计算吸附率(Adsorption rate):
(1)
式(1)中:C0和Ct分别为MB溶液的初始浓度和t时刻MB溶液的浓度,mg/L.
通过方程(2)对吸附动力学进行准二级动力学模型拟合:
(2)
式(2)中:qe是平衡吸附量,mg/g;qt是在t时刻的MB吸附量,mg/g;k2是吸附速率参数,g/(mg·min).
1.3.7 光催化性能实验
在距离液面15 cm的300 W氙灯光照下对MB进行光催化降解.采用循环水对反应器外壁进行冷却,使反应温度始终保持在25 ℃.将1.3.6达吸附-解吸平衡后的样液使用氙灯光照60 min,在光降解过程中,每隔10 min取4 mL反应溶液,离心取上清液,采用紫外分光光度计记录上清液于664 nm处的吸光度值,并根据亚甲基蓝标准曲线转化为浓度值.计算亚甲基蓝的降解率Ct/C0.
为了进一步研究纳米ZnO的光催化性能,运用一级反应动力学模型[9]进行拟合,如式(3)所示:
ln(C0/Ct)=kt
(3)
式(3)中:C0和Ct分别为MB溶液的初始浓度和t时刻MB溶液的浓度,mg/L;t为时间,min;k为反应速率常数,min-1.
2 结果与讨论
2.1 纳米氧化锌的微观形貌
不同用量CMC-Na改性纳米ZnO的SEM图如图1所示.由图1可知,成功制备了球状纳米ZnO.其中,未改性纳米ZnO的平均粒径为276±34 nm,由大量的ZnO小颗粒堆积而成,呈现“杨梅状”球体,粒径分布均匀,粒子之间无粘结.然而,C-ZnO虽然仍呈现球状,但未观察到“杨梅”表面并出现片状结构,具有一定的粘连性,表明CMC-Na成功接枝到纳米ZnO的表面.此外,CMC-Na会吸附在粒子表面形成有机包覆层,减缓粒子间的碰撞和团聚,从而抑制ZnO小颗粒堆积形成大颗粒,同时CMC-Na中的羧基、羟基等官能团与Zn2+之间可形成配位键,对ZnO的成核生长提供较大的空间位阻,从而降低了纳米ZnO的粒径[10-12].经统计,0.02%C-ZnO、0.04%C-ZnO和0.06%C-ZnO的平均粒径分别为157±50 nm、123±43 nm、95±35 nm.当CMC-Na用量增加到0.12%时,较多的CMC-Na包裹在了球状纳米ZnO的表面,导致其粒径增大到125±48 nm.但是0.20% C-ZnO的SEM图中几乎观察不到纳米粒子,均为片状结构,可能是由于大量的CMC-Na覆盖在ZnO的表面或者过量CMC-Na的引入影响了纳米氧化锌的成核,阻碍了纳米粒子的形成,对此样品不再进行考察.

图1 ZnO和C-ZnO的SEM图
2.2 纳米氧化锌的粒径分析
图2为C-ZnO个数粒子粒径分布曲线,即个数粒子粒径分布按照粒子个数百分数说明某一粒径粒子数量的多少.随着CMC-Na加入量的增加,C-ZnO粒径也呈先减小后增大的趋势,与根据SEM图所统计的平均粒径的结果趋势一致.

图2 ZnO和C-ZnO粒径分布曲线
纳米粒子在水溶液中的平均粒径和多分散性指数(PDI值)如表1所示.据表1可知,CMC-Na用量越多,溶液的PDI值越小,则纳米粒子在溶液中的分散性越好,当CMC-Na用量为0.12%时,溶液分散性最佳.这可能是由于C-ZnO中的CMC-Na在溶液中发挥其作为表面活性剂的作用,具有较高的亲水性,从而改善了纳米粒子在溶液中的分散性.然而测得的平均粒径比通过SEM图所统计的实际粒径大,推测可能是由于在测试浓度下,ZnO粒子仍存在有两个或多个聚集的现象,未形成单分散体系.
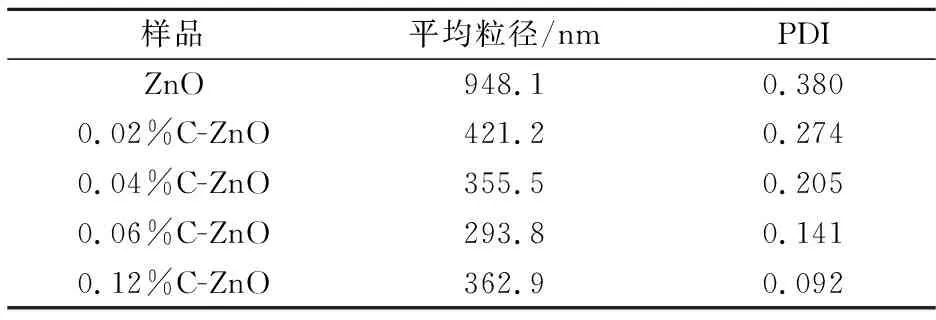
表1 ZnO和C-ZnO分散在溶液中的平均粒径和PDI值
2.3 纳米氧化锌的FT-IR分析
图3为CMC-Na、ZnO和C-ZnO的FT-IR谱图.由图3可见,CMC-Na光谱图中,在3 541 cm-1处的吸收峰归属于O-H伸缩振动与氢键的耦合,1 612 cm-1对应于C=O伸缩振动.此外,1 426 cm-1处的吸收峰归属于离子化羧基的C-O的伸缩振动,1 329 cm-1和1 058 cm-1分别对应为C-O弯曲振动和羟基的C-O伸缩振动[11].在ZnO谱图中,449 cm-1处出现Zn-O伸缩振动的特征峰.C-ZnO具有CMC-Na和ZnO的全部特征峰,证实了两者成功复合[13].此外,CMC-Na进入ZnO后,3 544 cm-1处的吸收峰发生明显移动至3 430 cm1附近,1 426 cm-1、1 329 cm-1和1 058 cm-1处的吸收峰分别移动至1 415 cm-1、1 321 cm-1、1 065 cm-1,说明CMC-Na的羟基、羧基与纳米ZnO之间存在相互作用,推测是与纳米氧化锌间形成了氢键或静电作用.
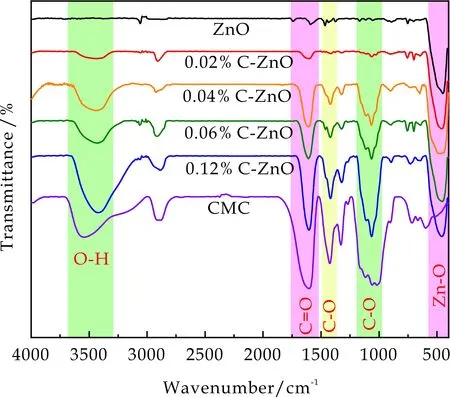
图3 CMC-Na、ZnO和C-ZnO的FT-IR谱图
2.4 纳米氧化锌的晶型结构分析
通过XRD对样品的晶型结构进行分析,其结果如图4所示.CMC-Na是典型的非晶聚合物,因此在22.5 °左右出现无定形特征衍射峰[14].结合ZnO标准卡片(JCPDS 36-1451)[15]指认ZnO的衍射峰(2θ),31.83 °、34.49 °、36.33 °、47.52 °、56.70 °、62.85 °和67.89 °处的衍射峰分别对应于氧化锌的(100)、(002)、(101)、(102)、(110)、(103)和(112)晶面,表明纳米ZnO呈现六角纤锌矿结构,并且结晶性良好,无杂峰.加入不同用量CMC-Na改性后的C-ZnO,峰位和相对峰强均与ZnO的XRD谱图匹配良好,表明CMC-Na的加入不影响ZnO的晶体结构,这是由于CMC-Na中羧酸根(-COO-)和羟基(-OH)的存在提供了净负电荷,通过静电相互作用保证了纳米粒子晶体的稳定性[5].
2.5 ZnO和C-ZnO分散液的分散稳定性
图5是不同静置时间下ZnO和C-ZnO分散液的光学照片.由图5可知,未改性的纳米ZnO静置5 min开始出现沉淀,静置20 min几乎完全沉淀,而改性后的C-ZnO在3 h内均未出现沉淀的迹象,表明CMC-Na改性能够改善ZnO在水溶液中的分散稳定性.0.02%C-ZnO、0.04%C-ZnO、0.06%C-ZnO、0.12%C-ZnO分散液开始出现沉淀的时间分别为4 h、5 h、6 h、7 h.综上,0.12%C-ZnO分散液静置的时间最持久,表明其分散稳定性最好,与2.2中PDI值所显示的结果相一致.ZnO借助CMC-Na的高亲水性实现在水中的分散,同时CMC-Na的空间结构限制了纳米ZnO的聚集[16],从而改善了分散液的分散稳定性.
2.6 ZnO和C-ZnO对MB吸附性能及动力学分析
图6为ZnO和C-ZnO对MB的吸附曲线及准二级动力学拟合曲线.从图6(a)中可以看出,ZnO对MB的吸附作用一般,吸附率仅为7.72%,而C-ZnO均表现出良好的吸附性能,在60 min内基本达吸附平衡,这是由于C-ZnO上的CMC-Na作为吸附剂对MB的吸附作用占主导,随着CMC-Na用量的增加,C-ZnO的吸附率逐渐增加,当CMC-Na用量增加为0.12%时,吸附率达到49.26%,是未改性ZnO的6.38倍.此外,吸附初期C-ZnO的吸附率迅速增大,此时MB浓度较大,CMC-Na对染料的吸附能力大,所以吸附速率较快[17],10 min吸附率即达到30% ~ 40%,随着吸附时间的延长,染料浓度梯度逐渐减小,吸附效率降低,最终趋于吸附平衡.
由于亚甲基蓝在溶液中呈正电荷,会与CMC-Na的羧基进行静电结合,MB的吸附受到化学吸附的影响,其吸附动力学受化学作用所控制,因此C-ZnO对MB的吸附过程更符合准二级动力学模型,如图6(b)所示,拟合相关系数R2>0.999.随着CMC-Na用量的增加,qe值不断提高,当CMC-Na用量为0.12%时,达到805.11 mg/g.然而ZnO却无法拟合,表明其不符合准二级吸附动力学模型.
2.7 光催化降解性能测试
图7为ZnO和C-ZnO对MB的光催化降解曲线及一级动力学拟合曲线.如图7(a)所示,随着光照时间的延长,催化剂对MB染料的降解率呈迅速提高态势.60 min时,ZnO的降解率最高达98.81%,相比之下改性后的C-ZnO降解效果较弱,是因为纳米ZnO在紫外光照射下产生的羟基自由基·OH和过氧自由基·O2-能很好地将有机物降解,而加入CMC-Na改性之后,CMC-Na的存在将ZnO的光催化位点覆盖[18,19].然而,CMC-Na可提供较多的MB活性吸附位点,C-ZnO可协同发挥CMC-Na的化学吸附作用和纳米ZnO的光催化活性,从而达到化学吸附和光催化的协同影响,强化催化剂的光降解性能[20];同时C-ZnO分散稳定性得到改善,分散更为均匀,纳米粒子表面所暴露的活性位点增多,相应的催化活性越高,有助于提高降解率[21],因此随CMC-Na用量的增加,C-ZnO对MB的降解率逐渐增加.当CMC-Na用量为0.12%时,降解率达95.79%,与未改性ZnO的光催化性能相当.
如图7(b)所示,ZnO和C-ZnO对MB的光催化降解过程符合一级动力学模型,拟合相关系数R2>0.999.改性后C-ZnO对MB的降解速率常数k有所降低,但随着CMC-Na用量的增加,k值不断增加,当CMC-Na用量为0.12%时,达到0.042 84 min-1.

(a)光催化降解曲线
3 结论
CMC-Na原位引入纳米ZnO对其进行改性,所制备的纳米氧化锌为球状,具有完整的六角纤锌矿结构,分散稳定性好.随着CMC-Na用量的增加,C-ZnO的粒径呈现先减小后增大的变化趋势,分散稳定性和对染料的吸附降解效果逐渐增强.当CMC-Na用量为0.12%时,纳米ZnO的粒径分布均匀,静置时间长达7 h,具有良好的分散稳定性,对染料亚甲基蓝的吸附率约为50%,且其对亚甲基蓝的光催化性能与未改性ZnO相当,降解率达到95.79%.
