Pd/TiO2-ZnO异质结用于光催化CO2氧化乙烷脱氢制乙烯
2022-05-26周黎明岳海荣刘长军钟山马奎梁斌唐思扬
周黎明,岳海荣,刘长军,钟山,马奎,梁斌,唐思扬
(四川大学 化学工程学院,四川 成都 610065)
热催化C2H6直接裂解制备C2H4,反应高温(通常>1 050 K),C2H4选择性较低(70%~80%)[1]。Pd/TiO2催化剂可以在室温紫外光照射下对C2H6分子进行有效活化[2]。当Pd颗粒粒径<3 nm,Pd0/Pd2+的比例<1时,CO2的还原产物CO会完全消失,C2H4和H2产量则会增加[3]。虽然Pd/TiO2光催化剂能对C2H6分子进行活化,但较低的光生载流子分离效率限制了其光催化活性的提高。
本文利用异质结调节催化体系的能带,提升光生载流子的分离效率。将Pd/TiO2与ZnO复合构建异质结,表征ZnO加入对于催化剂活性中心的影响,原位红外考察C2H4生成机理,以期增强对光催化CO2氧化C2H6脱氢制C2H4异质结催化剂的认识。
1 实验部分
1.1 材料与仪器
P25型TiO2(Degussa公司);四氯钯酸钠、硼氢化钠、氢氧化钠、氧化锌均为分析纯;高纯氩气(≥99.999%);高纯乙烷(≥99.95%);二氧化碳(≥99.999%)。
HSX-F300氙灯光源;微型高压反应釜,由华思仪器提供;MP-10C制冷和加热循环槽;490 Micro GC气相色谱仪(PoraPLOT U(PPU)列,Molesieve 5(MS5A)列);Thermo Fisher IS50傅里叶红外光谱。
1.2 催化剂的制备
Pd在TiO2表面负载的质量分数为0.25%。把3.0 g TiO2粉末加入到200 mL去离子水中。0.020 7 g Na2PdCl4加入到15 mL去离子水中,溶解后滴加到TiO2悬浮液中,在80 ℃下维持1 h,自然冷却到室温。使用0.1 mol/L的NaOH水溶液调节酸碱度至10。150 mg NaBH4加入至15 mL去离子水中,将其极为缓慢地滴加到混合液中,静置老化过夜。离心分离,用去离子水和无水乙醇交替洗涤。在60 ℃下彻底干燥得到Pd/TiO2催化剂。
0.2 g的 Pd/TiO2催化剂与10 mg氧化锌加入到研钵之中,加入2 mL去离子水,研磨30 min,在60 ℃下彻底干燥,再次研磨,制得异质结样品,记为Pd/TiO2-10%ZnO。其它异质结催化剂的制备过程与上相同。
1.3 催化剂活性评价
催化剂的活性评价在一个密闭的间歇式光反应釜内进行,反应釜内部容积为116 mL,上方有一个直径约2 cm的石英玻璃透光窗。釜的底部配备有一个磁力搅拌子,不停地旋转,使得釜内气体混合均匀。拆开反应釜,将20 mg催化剂均匀地洒在反应釜内部的石英棉上,固定好。打开间歇式光反应釜上端的进气口,将体积比为1∶1的C2H6与CO2(Ar)的混合气通入到反应釜内,再打开釜的出气口,将内部的空气排出。通入5 min后关闭进气口,启动气体循环采样泵,将釜内部的气体全部排除。关闭气体循环采样泵,再次打开釜的进气口和出气口,重复上述操作1次。连续2次将釜内的空气全部排空后,停止排气,并再次将C2H6与CO2的混合气通入到釜的内部,直至釜上的压力表显示为0.3 MPa,停止灌气并密闭反应釜。将反应釜的出气口接到配备有双通道的490 Micro GC气相色谱仪上面,对反应前的气体进行组成和含量测定。反应前的气体分析结束后,调节反应釜内的压力,维持在0.2 MPa,打开制冷和加热循环槽,维持反应温度为20 ℃,开启磁力搅拌,打开氙灯,照射反应釜光窗。照射1 h后,关闭氙灯,再次将反应釜出气口接到气相色谱仪上面,进行反应后的产物分析。
1.4 原位实验
采用原位漫反射傅里叶红外光谱测试进行原位实验。检测器为MCT/A,分束器为KBr,窗口选用BaF2,检测范围740~4 000 cm-1。操作过程如下:将样品放置于原位反应池当中,将原位反应池装在光谱仪适当的位置,使得光谱仪的信号强度适中。使用15 mL/min的Ar对催化剂进行吹扫,并使用升温装置将样品迅速升温至110 ℃,维持30 min,彻底去除水分。自然冷却至室温,并采集背景文件。将Ar替换为CO2和C2H6的混合气,CO2与C2H6的流量均为10 mL/min。吹扫30 min,达到吸附饱和之后关闭原位反应池的进气口和出气口,并采集谱图文件。打开氙灯,对原位反应池光窗进行照射,每隔1 min在黑暗条件下采集谱图文件,直至150 min。
2 结果与讨论
2.1 Pd/TiO2-ZnO光催化CO2氧化乙烷脱氢反应行为研究
2.1.1 Ar和CO2气氛下光催化CO2氧化乙烷脱氢研究 不同催化剂样品在Ar和CO2气氛下的光催化活性测试结果见图1。

图1 不同催化剂样品在Ar和CO2气氛下的活性变化Fig.1 Activity changes of different catalysts in Ar and CO2 atmosphere
由图1可知,CO2的引入,对反应整体活性的提升起到了较大的促进作用[3]。在Ar和CO2气氛下,Pd/TiO2-10%ZnO异质结催化剂上的光催化CH4生成活性并没有发生变化。与Pd/TiO2催化剂相比,Pd/TiO2-10%ZnO异质结催化剂在Ar和CO2气氛下CH4的光催化生成活性均呈现较大幅度降低,但是H2的光催化生成活性却明显提高,ZnO的引入可能抑制了CO2还原为CH4。单独的ZnO与TiO2-10%ZnO都显示出了很差的光催化活性,表明Pd是整个反应的活性中心[2-3]。
2.1.2 不同ZnO比例Pd/TiO2-ZnO光催化CO2氧化乙烷脱氢研究 ZnO含量对于异质结催化剂整体活性的影响见图2。

图2 ZnO含量对催化剂整体活性的影响Fig.2 Effect of ZnO content on overall activity of catalysts
由图2可知,Pd/TiO2-10%ZnO具有最佳的光催化活性(H21 021.3 μmol/gcat;C2H41 049.9 μmol/gcat;CH444.9 μmol/gcat);当ZnO的加入量较少时(<15%),C2H4的产率略多于H2产率,但是随着ZnO含量的进一步增加,在整体活性下降的同时,H2的产率逐渐超过C2H4,对比全程范围内CH4的产率逐渐下降并保持稳定,推测ZnO的引入导致了体系当中积碳的生成。
2.1.3 Pd/TiO2-10%ZnO光催化体系稳定性研究 由图3a可知,Pd/TiO2-10%ZnO异质结催化剂随着反应时间的延长,C2H4和H2总产量的增加逐渐放缓;由图3b可知,随着循环次数的增加C2H4和H2的生产速率迅速下降,表明催化剂在迅速失活。


图3 Pd/TiO2-10%ZnO异质结催化剂的 稳定性测试结果Fig.3 Photocatalytic stability of Pd/TiO2-10%ZnO catalyst
使用拉曼光谱(Raman)对经历不同反应时间后的 Pd/TiO2-10%ZnO 异质结催化剂进行表征。图4a 是相应纯物质的拉曼谱图,图4b是Pd/TiO2-10%ZnO异质结催化剂经过5~120 min光照反应后的拉曼谱图。


图4 不同样品的拉曼光谱图Fig.4 The Raman spectra of different samples

将反应前后的样品分别在空气气氛下进行热重分析(TGA),结果见图5。
由图5可知,Pd/TiO2在反应前以及在CO2气氛下光照1 h后,失重情况差距不大,说明无积碳产生;而在Ar气氛下光照1 h后,Pd/TiO2样品的失重情况有所增加,CO2的存在起到了消除积碳的作用[4]。在ZnO加入之后,Pd/TiO2-10%ZnO在CO2和Ar气氛下光照1 h后,都显示出了严重的失重情况,再次说明ZnO的引入导致了积碳的生成。


图5 不同样品的热重分析结果Fig.5 Thermogravimetric analysis results of different samples
综上所述,Pd/TiO2-10%ZnO具有最佳的光催化C2H4生成活性。ZnO的加入,提高了C2H4和H2产率,降低了CH4产率。Pd/TiO2-ZnO体系反应后,会产生较为明显的积碳现象,体系中CH4和部分H2源于C2H6裂解。
2.2 催化剂活性中心颗粒大小分析
2.2.1 X射线衍射(XRD) 图6是不同Pd/TiO2-ZnO异质结样品的XRD测试结果。其中锐钛矿TiO2、金红石TiO2以及ZnO的衍射峰分别根据标准卡片PDF no.21-1272、PDF no.21-1276以及PDF no.36-1451来确定[5-6]。

图6 Pd/TiO2-ZnO异质结样品的XRD图谱Fig.6 The XRD patterns of Pd/TiO2/ZnO heterojunction samples
由图6可知,当ZnO的含量比较少时,ZnO的衍射峰并不明显,说明ZnO分布均匀。在所有催化剂中均观察到归属于Pd的XRD衍射峰,表明Pd颗粒较小,且分布均匀。
2.2.2 高倍透射电子显微镜(HRTEM) 图7为Pd/TiO2-10%ZnO异质结样品的高倍透射电子显微镜图片。

图7 Pd/TiO2-10%ZnO异质结样品的HRTEM图像Fig.7 HRTEM images of Pd/TiO2-10%ZnO heterojunction samples
由图7可知,样品呈现出30~40 nm的颗粒状。由图7b可知,0.195 nm与0.25 nm的晶格条纹分别属于Pd(200)与 ZnO(101)晶面,证明两者都成功沉积在了TiO2的表面。据报道,Pd的负载量为0.25%时,Pd颗粒的平均粒径约为 2.06 nm[3]。
XRD、EDX-Mapping、HRTEM的结果证实,ZnO加入之后,反应活性中心Pd颗粒的大小依旧在 3 nm 以下,同时Pd元素与Zn元素在TiO2的表面分散均匀。
2.3 催化剂活性中心颗粒价态分析
不同催化剂样品的X射线光电子能谱(XPS)见图8。




图8 不同样品的XPS谱图Fig.8 XPS spectra of different samples
由图8可知,Ti 2p谱图中位于458.61 eV处的峰属于Ti 2p3/2,而位于464.32 eV处的峰则属于 Ti 2p1/2[7];Zn 2p谱图中位于1 021.42 eV和 1 044.49 eV 处的峰分别属于Zn2+2p3/2和Zn2+2p1/2[8];O 1s谱图中位于529.83 eV处的峰代表晶格氧Ti-O和Zn-O的存在,位于531.58 eV处的峰代表羟基氧Ti-OH和Zn-OH的存在[8]。Pd 3d谱图中结合能 335.38 eV 和 340.49 eV 的峰则为 Pd03d5/2和 Pd03d3/2,而另外两个位于336.54 eV和342.49 eV的峰属于Pd2+3d5/2以及Pd2+3d3/2[9]。在ZnO加入之后,Ti元素与Ag元素的结合能位置均发生了移动,说明Pd/TiO2与ZnO之间并不只是简单的物理混合,而是形成了相应的异质结,彼此之间存在着电荷转移。
对Pd元素半定量分析结果见表1。

表1 加入ZnO前后的样品对Pd元素所做的半定量分析结果Table 1 Semi quantitative analysis of Pd element in samples before and after adding ZnO
由表1可知,ZnO的加入,不会对Pd0与Pd2+的比例范围产生影响,Pd0/Pd2+的比值仍然大于1,同时ZnO与Pd/TiO2之间构成了异质结。
2.4 催化剂反应机理研究
使用原位漫反射傅里叶红外光谱测试在CO2和C2H6的混合气氛下对催化剂进行原位反应测试,结果见图9。


图9 CO2气氛下在Pd/TiO2-10%ZnO异质结上进行的 原位漫反射傅里叶红外光谱测试Fig.9 In situ diffuse reflectance FTIR spectra of C2H6 oxidative dehydrogenation to C2H4 over Pd/TiO2-10%ZnO heterojunction in CO2 atmosphere

2.5 催化剂光学性质分析
对光照过程中产生的e-、h+以及·OH等活性物种进行电子自旋共振光谱(ESR)检测,结果见图10。

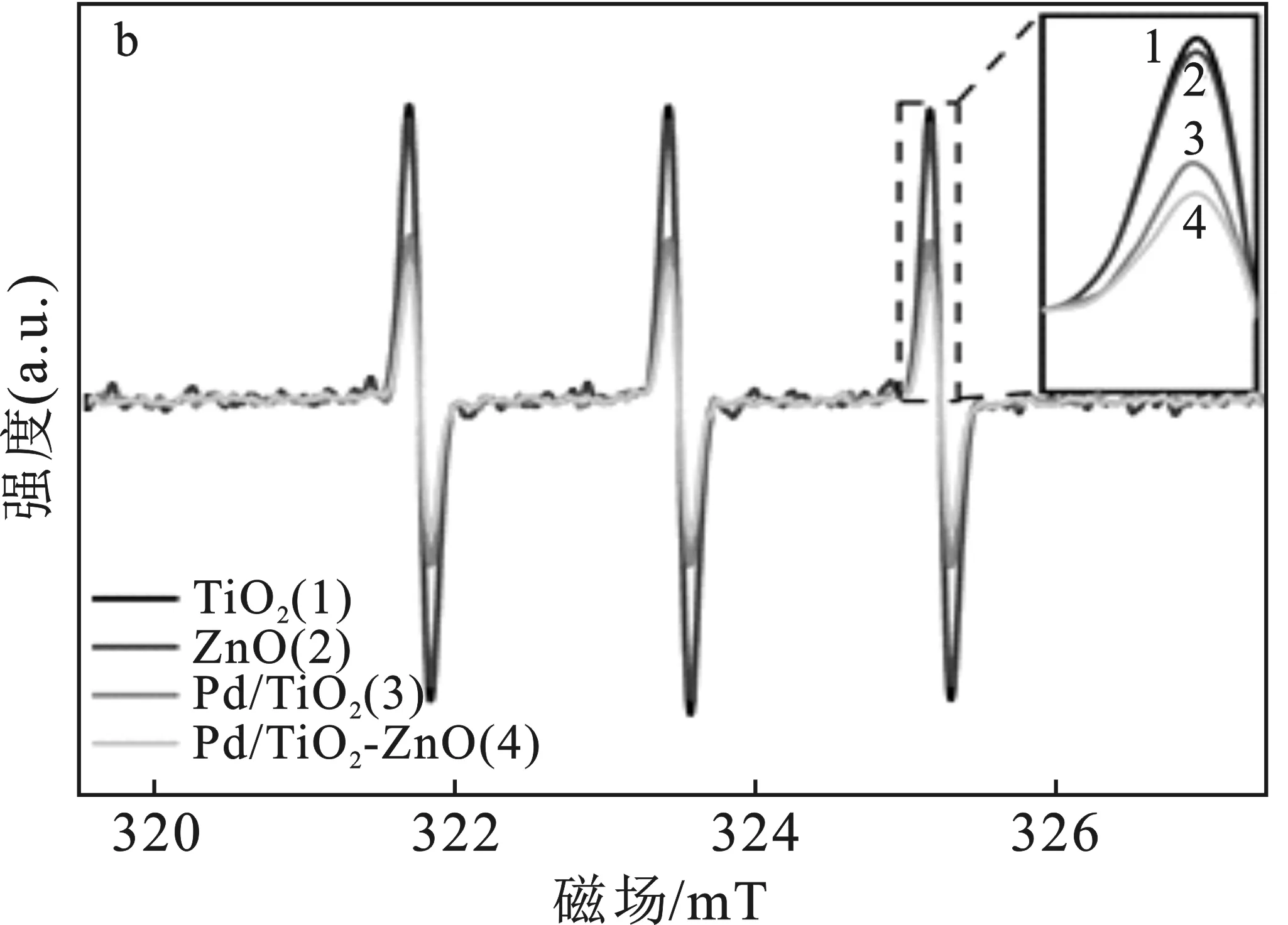

图10 ESR光谱测试结果Fig.10 ESR spectroscopya.e-捕获结果;b.h+捕获结果;c.·OH捕获结果
由图10可知,ZnO加入以后,相比较于Pd/TiO2和ZnO,Pd/TiO2-10%ZnO有最佳的光生电子-空穴对分离效率;图10c显示出Pd/TiO2-10%ZnO异质结样品在光照条件下产生的DMPO-·OH信号最强,说明该样品在光照条件下产生的·OH数量最多。
2.6 催化剂能带结构分析
2.6.1 紫外可见漫反射光谱(UV-Vis DRS) 使用UV-Vis DRS测定不同催化剂样品的光吸收情况以及带隙宽度,结果见图11。


图11 不同样品的紫外-可见漫反射吸收光谱(a) 和(Ahν)2-hν作图(b)Fig.11 Absorption spectrum of UV-Vis DRS of different samples (a) and plot of (Ahν)2 vs photon energy (hν)(b) curves
由图11可知,Pd/TiO2-ZnO异质结催化剂表现出了在可见光区吸光能力的下降。再次使用Kubelka-Munk公式的转换型式对不同样品的带隙宽度进行表征,ZnO是一种直接型半导体,因此n=1[10]。得到的结果见图11b,Pd/TiO2与ZnO的禁带宽度大小依次为3.18 eV和 3.22 eV。
2.6.2 紫外光电子能谱(UPS) 使用紫外光电子能谱(UPS)对ZnO的VB位置进行测定,结果见图12。
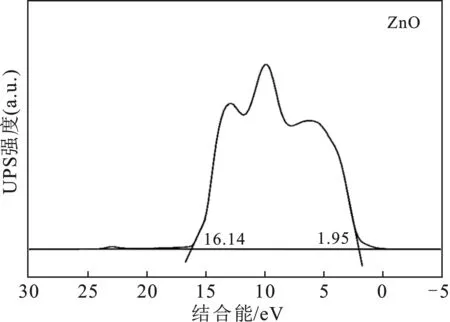
图12 ZnO的紫外光电子能谱测试结果Fig.12 UPS results of ZnO
由图12可知,ZnO的 VB能为2.59 eV,Pd/TiO2的 VB能已知为2.50 eV。根据Ec=Ev-Eg求得ZnO与Pd/TiO2的CB位置分别为-0.63 eV和-0.68 eV。
2.7 反应机理图
根据实验与表征的结果,提出在Pd/TiO2-10% ZnO异质结催化剂上可能的反应机理与电荷转移路径。在氙灯的照射下,ZnO和TiO2VB上的e-均会跃迁到CB上面。位于TiO2CB上的e-会逆着电场方向迁移到ZnO的CB位置上,同时ZnO VB上的h+会顺着电场的方向迁移到TiO2的VB上面,完成光生电子-空穴对的分离。C2H6分子会吸附在Pd活性中心上面,然后在TiO2的VB位置一步脱氢生成C2H4。C2H6生成C2H4过程中产生的H+会在TiO2的CB位置上生成H2,还有一部分H2来源于C2H6的直接裂解过程。反应过程中产生的CH4绝大部分来源于C2H6的直接裂解。
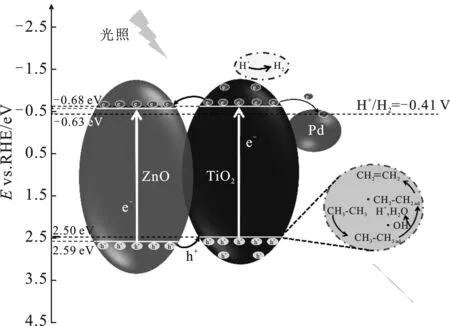
图13 Pd/TiO2-10%ZnO异质结上可能的电荷 转移路径以及各产物生成机理 Fig.13 Possible charge transfer paths and formation mechanism of products over Pd/TiO2-10%ZnO heterojunction
3 结论
制备了Pd/TiO2-ZnO异质结催化剂,将其用于光催化CO2氧化C2H6脱氢制C2H4领域。实验结果表明,Pd/TiO2-10%ZnO异质结催化剂具有最佳的光催化CO2氧化C2H6脱氢制C2H4活性。活性中心的测试结果表明,ZnO的加入并不会对反应活性中心Pd的颗粒大小范围以及Pd0与Pd2+的比例范围产生影响。ZnO能与Pd/TiO2之间构成所设计的异质结,增加了TiO2VB位置的h+密度,同时使体系产生了更多的·OH活性物种。同时ZnO的加入也导致了积碳的产生。
