细胞hnRNP M蛋白与病毒基因组相互作用对塞内卡病毒复制影响的研究
2022-05-26曹志远魏丹丹王海伟
曹志远,魏丹丹,王海伟,孙 超,于 力
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/牛羊传染病研究创新团队,黑龙江 哈尔滨 150069)
塞内卡病毒(Senecavirus A,SVA)也称为塞内卡谷病毒(Seneca valley virus,SVV)[1],其2015 年以来在许多国家引起了一种猪新发病,该病在临床上与口蹄疫难以区分,感染猪的发病率和死亡率受猪群年龄、地理因素和猪群状况等因素的影响。我国最早于2015 年夏季在广东省某些猪场发生了SVA 感染疫情,病猪出现水疱症状、新生仔猪大量死亡,随后该病迅速蔓延到黑龙江、福建和河南等省,其传播速度与口蹄疫病毒(FMDV)一样快,传播方式也与FMDV 相近或相同,对我国养猪业造成严重的影响[2-3]。虽然该病毒已发现多年,但是对其了解不够深入。因此,深入了解该病毒复制的分子机制,可为该病的防控提供参考依据。
SVA 为微RNA 病毒科(Picornaviridae)塞内卡病毒属(Senecavirus)的唯一成员,为无囊膜的单股正链RNA 病毒。其基因组全长约7.3 kb,由5'非翻译区(5'UTR)、编码多聚蛋白的开放阅读框(ORF)和3'端非翻译区(3'UTR)组成,其中,5'UTR含有病毒基因组连接蛋白(Viralgenome-linked protein,VPg),3'UTR下游含有一个poly(A)尾[1]。
核不均一核糖核蛋白M(hnRNP M)是hnRNP 家族的重要成员,该蛋白约75 ku,含有3 个RNA 识别基序(RRM)[4]。hnRNP 是核质穿梭的RNA 结合蛋白家族,最初是根据它们与pre-mRNA 的关联而被鉴定的[5]。已发现的该家族蛋白大约有20 个,分别命名为hnRNP A~hnRNP U,均含有至少一个RNA 结合结构域,即RNA 识别基序RRM 或hnRNP K 同源性(KH)结构域。已发现hnRNP 蛋白家族参与许多微RNA 病毒的生命周期,例如AUF1(hnRNP D)直接结合脊髓灰质炎病毒的基因组而抑制病毒的翻译[6],近年来有关hnRNP 与病毒核酸、病毒蛋白相互作用而影响病毒复制的研究越来越多。hnRNP M 是一种多功能蛋白,通过与核酸和蛋白的相互作用参与许多生物学过程。目前已发现,hnRNP M 在仙台病毒(SeV)、水泡性口炎病毒(VSV)和肠病毒71(EV71)的复制过程中发挥重要的作用[7],但尚未见关于其在SVA 生命周期中发挥的功能和作用的研究。因此,本研究通过过表达和敲低其表达发现hnRNP M 蛋白抑制SVA 的复制,进而采用RNA 免疫共沉淀和激光共聚焦显微镜观察,进一步证实了hnRNP M 蛋白和SVA 基因组RNA 之间的相互作用,双荧光素酶报告试验发现hnRNP M 能够影响SVA 内部核糖体进入位点(Internal ribosome entry site,IRES)的活性。这些结果将为深入研究hnRNP M 蛋白在SVA 感染和复制中的生物学功能奠定基础。
1 材料与方法
1.1 主要实验材料 仓鼠肾细胞(BHK-21)由本实验室保存;SVA、SVA VP2 抗体以及质粒pCAGGS-HA、pCAGGS-HA-EGFP、pVAX1-T7-SVA-IRES[8]均由本实验室制备保存。
pCAGGS 载体购自Addgene 公司;T4 DNA 连接酶购自NEB 公司;In-Fusion HD Cloning Kits、以及各种限制性内切酶、Primerscript 反转录酶、Prime STAR HS DNA 聚合酶、DH5α 感受态细胞均购自TaKaRa 公司。无血清培养基和胎牛血清(FBS)购自Gibco公司。
质粒小提试剂盒、胶回收试剂盒和RNA 提取试剂盒购自Axygen 公司;Protein A/G 磁珠购自金斯瑞公司,双荧光素酶检测试剂盒Dual-luciferase repoter assay kit 和RNasin 购自Promage 公司;脂质体3000 转染试剂购自Invitrogen 公司;蛋白酶抑制剂购自Roche公司;Triton X-100、RIPA 蛋白裂解液和多聚甲醛购自Sigma 公司;针对仓鼠源的hnRNP M shRNA 和对照shNC 购自吉玛基因;蛋白Marker、蛋白上样缓冲液和硝酸纤维素膜、山羊抗兔IgG-TRITC、山羊抗鼠IgG-FITC 和DAPI 均购自碧云天公司;鼠源HA 单克隆抗体(MAb)、β-actin MAb 购自金斯瑞公司;鼠源双链RNA MAb(dsRNA)J2 购自SCICONS 公司;鼠源hnRNP M MAb 和兔源hnRNP M MAb 购自OriGene公司;IRDye®800CW 山羊抗鼠IgG 购自Licor 公司。
1.2 hnRNP M 真核表达质粒的构建及hnRNP M 蛋白表达的western blot 检测 参照GeneBank 中鼠源hnRNP M 基因序列(XM_005081323.3),设计特异性引物HA-hnRNP M-F/R,以及参照文献[3]合成SVA 基因组特异性引物RIP-F/R(表1)。提取BHK-21 细胞RNA 反转录为cDNA,以其为模板,利用引物HAhnRNP M-F/R PCR 扩增hnRNP M 基因后,插入载体pCAGGS-HA 的EcoR I 和XhoI 位点,构建重组质粒pCAGGS-HA-hnRNP M。经PCR 和测序鉴定后,利用脂质体3000 试剂将其转染至BHK-21 细胞中,24 h 后裂解细胞,经SDS-PAGE 检测后进一步以鼠源hnRNP M MAb(1∶1 000)为一抗,以IRDye®800CW 山羊抗鼠IgG(1∶1 000)为二抗,采用western blot 检测hnRNP M蛋白的表达。

表1 本研究所用引物Table 1 Primers used in this study
1.3 过表达hnRNP M 对SVA 复制影响的检测 将2 μg pCAGGS-HA-hnRNP M 和pCAGGS-HA 空载体分别利用脂质体3000 试剂转染BHK-21 细胞,按照1.2中western blot 方法确认hnRNP M 过表达后,于转染24 h 后感染SVA(MOI 1),感染后11 h、16 h 和21 h分别收集细胞并反复冻融裂解后,经SDS-PAGE 检测后以SVA VP2 蛋白MAb(1∶500)为一抗,以IRDye®800CW 山羊抗鼠IgG(1∶1 000)为二抗,western blot 检测SVA VP2 蛋白的表达,试验设β-actin 为内参蛋白。将上述收集的细胞样品用DMEM 做10 倍倍比稀释后,根据Kärber 法检测病毒效价。
1.4 敲低hnRNP M 的表达对SVA 复制的影响 将2 μg shRNA-hnRNP M 和对照shNC 分别利用脂质体3 000 试 剂 转 染BHK-21 细 胞,参 照1.2 中 方 法 检 测hnRNP M 表达情况。于转染24 h 后感染SVA(MOI 1),分别于感染后11 h、16 h 和21 h 收集感染细胞并反复冻融3 次后按照1.3 中的方法检测SVA VP2 蛋白的表达情况和病毒效价。
1.5 hnRNP M 蛋白和SVA 基因组相互作用的RNA免疫共沉淀(RIP)试验 长满单层的BHK-21 细胞按MOI 1 感染SVA,16 h 后加入RIPA 裂解液4 ℃裂解1 h,12 000 r/min 离心10 min,取上请加入20 μL Protein A/G 磁珠在4 ℃摇床中孵育1 h,去除非特异性结合。取上清加入2 μg 鼠源hnRNP M MAb(同时保留30 μL 做阳性对照,鼠源HA MAb 做阴性对照),继续置4 ℃孵育2 h 后加入30 μL 磁珠置4 ℃孵育1 h,反复清洗5 次,收集免疫沉淀复合物提取RNA,并使用SVA 基因组特异性引物RIP-F/R 经RTPCR 检测,同时设置H2O 为空白对照。
1.6 hnRNP M 蛋白和SVA 基因组RNA 的定位检测 将SVA(MOI 1)接种至生长约90%单层的BHK-21 细胞,37 ℃分别培养11 h 和16 h 后使用4%多聚甲 醛 常 温 固 定 细 胞20 min,0.5% TritonX-100 处 理10 min,1%BSA 室温封闭1 h。分别以鼠dsRNA MAb J2(1∶1 000)和兔hnRNP M MAb(1∶1 000)为一抗,分别以山羊抗兔IgG-TRITC(1∶500)和山羊抗鼠IgGFITC(1∶500)为二抗,DAPI(1∶1 000)复染细胞核后,在激光共聚焦显微镜下观察hnRNP M 与SVA RNA 的定位情况。试验设置不接病毒的细胞作为阴性对照。
1.7 双荧光素酶试验检测hnRNP M蛋白对SVA IRES活性的影响 将pCAGGS-HA-hnRNP M质粒及pCAGGSHA 空质粒使用脂质体3000 试剂分别转染至BHK-21细胞,同样将shRNA-hnRNP M 和对照sh-NC 使用脂质体3000 转染试剂分别转染至BHK-21 细胞,24 h后将双荧光素酶报告质粒T7-RHF、T7-RHF-IRES分别转染上述细胞中,每组3 个平行孔,参照Dualluciferase reporter assay kit 操作说明检测两种荧光素酶活性,计算SVA IRES 的相对活性。
1.8 数据分析 本研究中获得的所有数据均采用GraphPad Prism 软件进行分析。数据的统计学分析均采用t检验,0.01<P<0.05,表示差异显著;P<0.01,表示差异极显著。
2 结 果
2.1 真核表达质粒及hnRNP M 蛋白表达的鉴定结果 利用同源重组技术构建hnRNP M 基因的真核表达质粒pCAGGS-hnRNP M,对获得重组质粒经PCR鉴定,结果显示,获得了约为2.1 kb 的hnRNP M 基因片段,与预期相符,而空载体未扩增出相应条带(图1A);扩增基因片段的测序以及ORF 分析均与预期相符,表明pCAGGS-hnRNP M 表达质粒构建正确。将构建的3 μg hnRNP M 质粒转染BHK-21 细胞,western blot 检测结果显示,在75 ku 处出现特异性条带(图1B),与预期大小一致。表明hnRNP M 蛋白在BHK-21 细胞中能够正确表达。
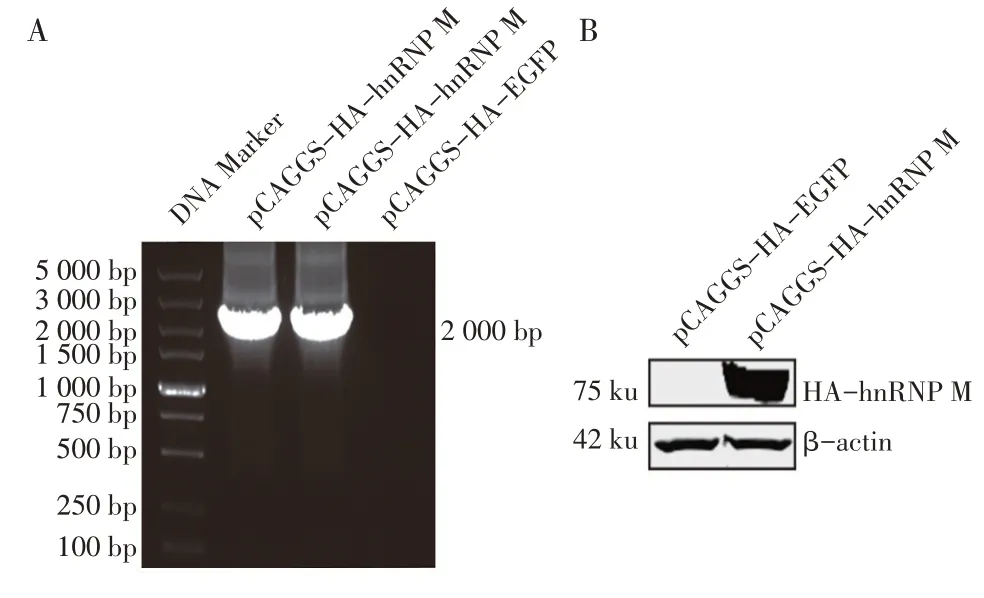
图1 重组质粒pCAGGS-HA hnRNP M的PCR检测(A)及hnRNP M蛋白在BHK-21细胞表达的western blot(B)鉴定结果Fig.1 Identification of the recombinant plasmids containing genes of HA-hnRNP M by PCR(A)and western blot(B)
2.2 过表达hnRNP M 蛋白对SVA 复制的影响 分别将pCAGGS-HA-hnRNP M 和pCAGGS 空载体转染BHK-21 细胞24 h 后感染SVA(MOI 1),分别在感染后11 h、16 h 和21 h 取样,采用western blot 和Körber 法分别检测SVA VP2 蛋白的表达水平和病毒滴度。结果显示,在病毒感染11 h、16 h 和21 h时,过表达hnRNP M 蛋白的细胞中SVA VP2 蛋白的表达量均明显低于对照组(图2A),且在病毒感染后的11 h 和16 h 过表达hnRNP M 蛋白细胞的病毒滴度显著低于对照细胞的病毒滴度(图2B)(P<0.01)。表明过表达hnRNP M 可显著抑制SVA 的复制。
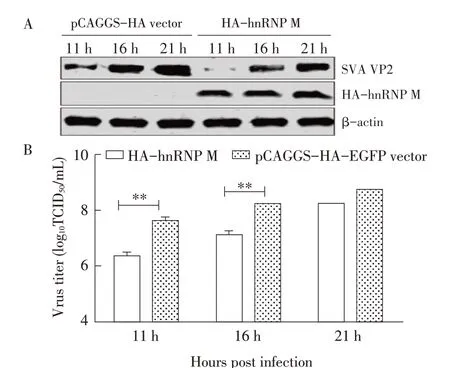
图2 过表达hnRNP M对SVA复制影响的检测结果Fig.2 Overexpression of hnRNP M inhibit SVA protein expression and SVA replication
2.3 敲低hnRNP M 蛋白的表达对SVA 复制的影响 将sh-hnRNP M 或sh-NC 分别转染BHK-21 细胞24 h 后感染SVA,在感染后11 h、16 h 和21 h 后取样,western blots 检测结果显示,在病毒感染11 h、16 h和21 h后,下调hnRNP M蛋白表达的细胞中SVA VP2蛋白的表达量均明显高于对照组(图3A);病毒滴度检测结果显示,在病毒感染后的11 h 和16 h 敲低hnRNP M 蛋白细胞的病毒滴度极显著高于对照细胞的病毒滴度(图3B)(P<0.01)。表明敲低hnRNP M 的表达能够促进SVA 的复制。

图3 敲低hnRNP M表达对SVA病毒蛋白表达和病毒复制的检测结果Fig.3 Downregulation of hnRNP M promoted SVA protein expression
2.4 hnRNP M 蛋白和SVA 基因组相互作用的RIP的试验结果 采用RIP 检测在SVA 感染的情况下hnRNP M 是否与病毒基因组存在相互作用。结果显示,仅有阳性对照和用hnRNP M 抗体结合的复合物可以通过RT-PCR 扩增出约700 bp 的目的条带(SVA RNA),而HA 抗体结合的复合物及H2O 对照均未扩增出任何DNA 条带(图4)。表明在SVA 感染情况下hnRNP M 与SVA 基因组存在相互作用。
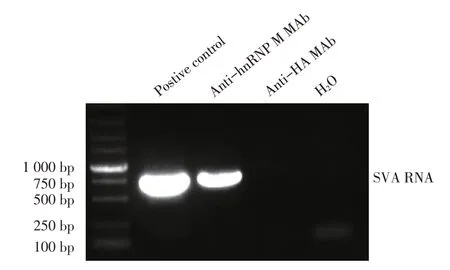
图4 hnRNP M与SVA基因组相互作用的检测结果Fig.4 Interaction of the hnRNP M with SVA genome
2.5 hnRNP M 蛋白和SVA 基因组RNA 的定位检测结果 hnRNP M 蛋白属于核不均一核糖核蛋白家族,其主要存在于细胞核中,而SVA 的复制是在细胞质中完成的。将SVA 按MOI 1 接种BHK-21 细胞,37 ℃培养11 h 或16 h,利用激光共聚焦显微镜观察hnRNP M 在不同时间点与SVA 基因组RNA 的共定位情况。结果显示,在未感染SVA 的情况下,hnRNP M 在细胞核细胞质均有分布,且主要分布在细胞核中。在SVA感染过程中,随着时间的推移,越来越多的hnRNP M蛋白从细胞核转移至细胞质,并与细胞质中的SVA RNA 存在共定位(图5)。进一步表明在SVA感染的情况下hnRNP M 与SVA 基因组RNA 存在相互作用。

图5 在SVA感染BHK-21细胞中hnRNP M蛋白与SVA基因组的共定位Fig.5 Co-localization of the celluar hnRNP M with SVA genome in the SVA-infected BHK-21 cells
2.6 hnRNP M 对SVA IRES 活性影响的双荧光素酶报告基因检测结果 将报告质粒分别转染到hnRNP M 过表达、hnRNP M 敲低及其各自的对照细胞中,转染后测定SVA IRES 相对活性,结果显示,与对照细胞相比,过表达hnRNP M 的细胞中SVA IRES 的活性显著降低(图6A)(下降了65%)(P<0.001);敲低hnRNP M 表达后检测结果显示,与sh-NC 转染的对照组相比,敲低hnRNP M 表达的细胞中SVA IRES 的活性显著增加(图6B)(上升了30%)(P<0.05)。表明hnRNP M 负调控SVA IRES 的翻译活性,因此该细胞蛋白对SVA 复制的抑制作用很可能是通过抑制SVA IRES的活性来实现的。
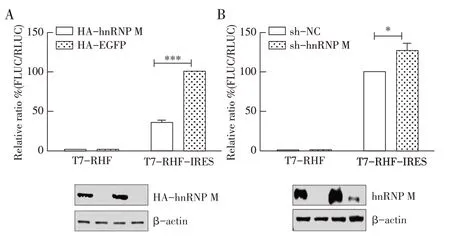
图6 hnRNP M抑制SVA IRES所介导的翻译活性Fig.6 hnRNP M inhibits the SVA IRES-mediated translation activity
3 讨 论
hnRNP M 广泛存在于哺乳动物的各种组织和细胞中,并且主要定位于细胞核中。hnRNP 家族中的一些成员能够在病毒感染过程中从细胞核穿梭至细胞质,例如hnRNP L 和hnRNP K,在正常情况下存在于细胞核中,当FMDV 感染宿主细胞后,hnRNP L[9]和hnRNP K[10]从细胞核转移至细胞质中并与FMDV 基因组相互作用,从而抑制FMDV 的复制。本研究发现,hnRNP M 在同科病毒SVA 感染细胞的过程中也发生了类似的现象。
hnRNP M 是hnRNP 家族的重要成员,是一种RNA 结合蛋白,由3 个RNA 识别结构域(RRM)组成,通过与RNA 和多种蛋白的相互作用,参与细胞中mRNA 前体的剪切、mRNA 的转运、mRNA 的稳定性、染色质重塑、转录调控、剪接和RNA 翻译等细胞代谢过程[11]。据报道,hnRNP M 参与了多种病毒的感染过程[12],包括SeV、VSV 等。最近的研究表明,hnRNP M 能够与病毒蛋白或基因组相互作用从而影响柯萨奇病毒(CVB3)和肠道病毒的复制[7]。而且有研究发现,hnRNP M 与RIG-1 和MDA5 相互作用能够削弱RIG-I 样受体(RLR)与病毒RNA 的结合,导致先天性抗病毒反应受到抑制[13]。因此,细胞hnRNP M 蛋白对于一些微RNA 病毒在宿主细胞中的复制发挥重要的作用,但在SVA 复制过程中发挥的作用尚不清楚。
为了研究hnRNP M 是否参与SVA 的生命周期、如果参与是抑制还是促进SVA 的复制,本研究经过表达和敲低试验证实hnRNP M 能够抑制SVA 的复制,经RNA 免疫共沉淀和激光共聚焦试验检测hnRNP M 与SVA 基因组之间存在特异性相互作用。本研究进一步表明,在SVA 感染的情况下细胞hnRNP M 蛋白通过与SVA 基因组的相互作用并抑制SVA 的复制。已有研究表明,病毒脱壳后RNA 进入细胞,通过基因组自身的IRES 元件介导病毒蛋白的翻译,这是启动病毒复制的一个关键步骤[14]。因此,推测hnRNP M 是通过影响IRES 的活性来抑制SVA 的复制。本研究构建的双荧光素酶报告质粒,翻译的第一个顺反子RLuc 是帽依赖,而第二个顺反子FLuc 为SVA IRES 依赖的,FLucRluc 即为IRES 的相对活性[9]。利用T7 启动子的双荧光素酶报告质粒来检测过表达和敲低hnRNP M 对SVA IRES 活性的影响。本研究发现,hnRNP M 能够明显影响SVA IRES的活性,从而抑制SVA 病毒蛋白的翻译。可见,hnRNP M 通过与SVA 基因组相互作用影响SVA IRES介导的翻译活性,从而抑制SVA 的复制。
关于hnRNP M 抑制SVA IRES 翻译活性的机制,推测有两种可能:一是,SVA IRES 在翻译起始因子和反式作用因子的作用下直接招募宿主细胞40S 和60S 核糖体,形成翻译起始复合物,因此hnRNP M有可能通过影响核糖体的招募从而影响翻译起始复合物的形成、进而抑制IRES 的翻译活性以至SVA 的复制;二是,在SVA IRES 形成翻译起始复合物中有大量宿主蛋白的参与,其中有一部分蛋白质起稳定IRES 结构的作用[15-16],因此hnRNP M 与SVA 基因组的相互作用可能导致那些起稳定作用的蛋白从SVA基因组上解离,进而影响到翻译复合物的稳定性、IRES 的翻译活性以至SVA 的复制水平。
尽管本研究结果表明,hnRNP M 负调控SVA 复制并下调IRES 介导的翻译。但在病毒复制的后期,hnRNP M 对病毒的抑制作用不像早期那么明显。在之前的一项研究中,几个eIFs 和ITAFs 在微RNA 病毒感染的细胞中被病毒基因组中编码的蛋白酶水解[17]。因此推测,hnRNP M 可能在SVA 感染细胞中被SVA 的蛋白酶水解,从而导致其在后期的抑制作用不明显。本研究仅探究了hnRNP M与SVA基因组的相互作用从而影响SVA IRES 的翻译活性和SVA 的复制,至于hnRNP M通过与SVA基因组的相互作用是否影响SVA RNA复制尚不清楚,本团队将进一步研究。
本研究首次证实了宿主细胞蛋白hnRNP M 与SVA 基因组存在相互作用、抑制IRES 的翻译活性、进一步抑制SVA 复制,为深入研究SVA 在宿主体内复制的分子调控机制奠定了基础。
