核苷类似物序贯联合聚乙二醇干扰素α-2b治疗乙型肝炎表面抗原低水平慢性乙型肝炎患者疗效观察
2022-05-26李长安赵巍峰刘淑媛杜敬佩王园园
李长安,赵巍峰,刘淑媛,窦 芊,杜敬佩,杨 瑞,王园园,李 赢
(新乡医学院第三附属医院感染性疾病科,河南 新乡 453003)
慢性乙型肝炎(chronic hepatitis B,CHB)是因乙型肝炎病毒(hepatitis B virus,HBV)持续感染而导致的慢性肝脏疾病,肝脏常发生不同程度的炎症坏死、肝纤维化,部分患者可发展为肝硬化或肝癌[1-2]。研究证明,HBV持续复制和机体免疫功能紊乱是导致CHB的主要原因,早期有效的抗病毒治疗可以延缓CHB进展[3-4]。因此,寻找最佳抗病毒治疗策略一直是临床医生不断探索的方向。血清乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)水平可能与病毒复制及临床治愈具有相关性,抗病毒治疗的理想目标为HBsAg消失甚至发生血清学转换,实现安全停药或停药后不复发[5]。核苷类药物(nucleoside analog,NA)是目前治疗CHB的首选药物,能够有效抑制HBV DNA复制,使病毒载量降低,延缓疾病进展[6]。恩替卡韦作为国内外推荐的一线抗病毒药物,具有高效抗病毒效率及耐药率低等特点,已被广泛应用于临床[7]。部分CHB患者经NA治疗后血清HBsAg维持在低水平,无法达到血清学转换的目的,但低水平HBsAg患者作为治疗后优势人群,具有临床治愈的极大优势,为了实现HBsAg消失,临床抗病毒治疗常联合其他药物进行序贯疗法。干扰素也是常用的抗病毒药物,研究显示,聚乙二醇干扰素α-2b(pegylated interferon α-2b,PEG-IFNα-2b)能够实现HBsAg阴转,且血药浓度持久,给药方式方便[8]。对不同类别抗病毒药物的优势研究发现,2类药物联合或序贯应用可有效发挥药物协同作用,提高HBsAg阴转率,尤其是序贯联合疗法是一种优选的治疗方法,常可增加疗效,减少不良反应,提高患者的依从性,是目前临床常用的抗病毒治疗策略之一[9]。本研究旨在探讨NA序贯联合PEG-IFNα-2b治疗HBsAg低水平CHB患者的临床效果,以期为临床有效抗HBV治疗提供思路。
1 资料与方法
1.1 一般资料选择2018年8月至2019年8月新乡医学院第三附属医院感染性疾病科收治的HBsAg低水平CHB患者为研究对象。病例纳入标准:(1)符合CHB诊断标准[10];(2)血清HBeAg阴性,HBsAg水平为0.05~1 000.00 kU·L-1,HBV DNA>20 kU·L-1;(3)入组前所有患者均已接受恩替卡韦治疗1~4 a,血清HBV DNA<100 kU·L-1,且持续1 a以上。排除标准:(1)合并甲型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒等其他肝炎病毒及人类免疫缺陷病毒感染;(2)合并自身免疫性疾病、酒精性和非酒精性脂肪肝、肝硬化、肝癌等;(3)精神状态异常或认知功能障碍;(4)哺乳或妊娠期女性。本研究共纳入HBsAg低水平CHB患者60例,采用简单随机分组法将患者分为观察组和对照组,每组30例。观察组:男27例,女3例;年龄21~51(38.21±5.78)岁。对照组:男28例,女2例;年龄21~53(40.15±6.18)岁。2组患者的年龄、性别比较差异无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会审核,所有患者及家属签署知情同意书。
1.2 治疗方法对照组患者继续给予恩替卡韦(北京百奥药业有限责任公司,国药准字H20193077)0.5 mg,空腹服用,每日1次,连续治疗48周。观察组患者给予恩替卡韦序贯联合PEG-IFNα-2b治疗:前12周给予恩替卡韦0.5 mg,空腹服用,每日1次;PEG-IFNα-2b(厦门特宝生物工程股份有限公司,国药准字S20174006)180 μg,腹部或大腿皮下注射,每周1次;后36周给予PEG-IFNα-2b单药治疗(用法同前12周);共治疗48周。
1.3 观察指标
1.3.1 临床疗效治疗后48周评估2组患者临床疗效。临床治愈:观察期内患者持续病毒学应答且血清HBsAg阴转、血清丙氨酸转移酶(alanine aminotransferase,ALT)正常、肝组织学轻微病变或无病变;临床显效:血清HBsAg未阴转,但其水平较基线下降大于1个对数值,血清转氨酶和HBV DNA正常;临床有效:血清HBsAg未阴转,血清转氨酶和HBV DNA正常;临床无效:血清HBsAg未阴转,血清转氨酶和HBV DNA异常[11]。治疗总有效率=(临床治愈例数+临床显效例数)/总例数×100 %。
1.3.2 血清学指标分别于治疗前及治疗12、24、48周和治疗后24、48周,抽取患者空腹肘静脉血3 mL,3 000 r·min-1离心10 min,取上清血清;采用酶联免疫吸附试验检测血清HBsAg和乙型肝炎e抗原(hepatitis B e antigens,HBeAg)水平,并计算血清HBsAg和HBeAg阴转率,试剂盒购自瑞士Roche公司;应用美国ABI公司的7000荧光定量聚合酶链反应仪及其配套试剂,采用实时荧光定量聚合酶链反应检测血清HBV DNA水平;使用日本Olympus公司的AU-400全自动生物化学检测仪及其配套试剂检测血清天冬氨酸氨基转移酶(aspartate aminotransferase,AST)和ALT水平。

2 结果
2.1 2组患者临床疗效比较治疗后48周,观察组患者临床治愈11例,临床显效12例,临床有效7例,总有效率为76.67%(23/30);对照组患者临床治愈2例,临床显效11例,临床有效15例,总有效率为43.33%(13/30);观察组患者治疗总有效率显著高于对照组,差异有统计学意义(χ2=6.944,P<0.05)。
2.2 2组患者血清HBsAg水平及阴转率比较结果见表1和表2。治疗前2组患者血清HBsAg水平比较差异无统计学意义(P>0.05);治疗后2组患者血清HBsAg水平整体呈下降趋势(F对照组=158.076,F观察组=1 192.664;P<0.05);治疗12、24、48周及治疗后24、48周,观察组患者血清HBsAg水平显著低于对照组,差异有统计学意义(P<0.05)。治疗24周时2组患者血清HBsAg阴转率比较差异无统计学意义(P>0.05);治疗48周及治疗后24、48周时,观察组患者血清HBsAg阴转率显著高于对照组,差异有统计学意义(P<0.05)。
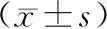
表1 2组患者血清HBsAg水平比较
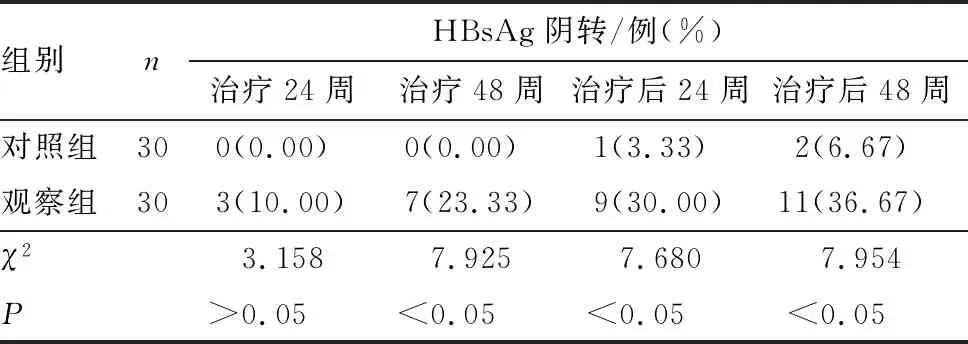
表2 2组患者血清HBsAg阴转率比较
2.3 2组患者血清HBeAg水平及阴转率比较结果见表3和表4。治疗后2组患者血清HBeAg水平整体呈下降趋势(F对照组=8.836,F观察组=32.550;P<0.05);治疗前和治疗12周时2组患者血清HBeAg水平比较差异无统计学意义(P>0.05);治疗24、48周及治疗后24、48周,观察组患者血清HBeAg水平显著低于对照组,差异有统计学意义(P<0.05)。治疗12、24、48周及治疗后24、48周时,观察组患者血清HBeAg阴转率显著高于对照组,差异有统计学意义(P<0.05)。
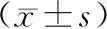
表3 2组患者血清HBeAg水平比较

表4 2组患者血清HBeAg阴转率比较
2.4 2组患者血清HBV DNA水平比较结果见表5。治疗前2组患者血清HBV DNA水平比较差异无统计学意义(P>0.05);2组患者治疗12周至治疗后48周时血清HBV DNA水平显著低于治疗前,差异有统计学意义(P<0.05);治疗12、24、48周及治疗后24、48周,观察组患者血清HBV DNA水平显著低于对照组,差异有统计学意义(P<0.05)。治疗后24、48周(停药后),2组患者血清HBV DNA水平有上升趋势。
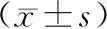
表5 2组患者血清HBV DNA水平比较
2.5 2组患者血清ALT和AST水平比较结果见表6和表7。治疗前2组患者血清ALT和AST水平比较差异无统计学意义(P>0.05);治疗后2组患者血清ALT和AST水平整体呈下降趋势(对照组:FALT=18.551,FAST=26.782;观察组:FALT=53.672,FAST=55.511;P<0.05);治疗12周时2组患者血清ALT水平比较差异无统计学意义(P>0.05);治疗24、48周及治疗后24、48周,观察组患者血清ALT水平显著低于对照组,差异有统计学意义(P<0.05);治疗12、24周时2组患者血清AST水平比较差异无统计学意义(P>0.05);治疗48周及治疗后24、48周,观察组患者血清AST水平显著低于对照组,差异有统计学意义(P<0.05)。
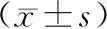
表6 2组患者血清ALT水平比较
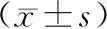
表7 2组患者血清AST水平比较
3 讨论
HBV感染呈世界性流行,要实现消除病毒性肝炎的目标仍有很长的路要走[12]。目前,临床将临床治愈和降低肝癌发生率作为CHB的主要治疗目标。NA是目前CHB治疗的首选药物,但长期单一使用一种药物可能会引起患者耐药性增加,2种药物序贯治疗可有效发挥药物协同作用,提高疗效,减少不良反应,是目前临床常用的抗病毒治疗策略。研究显示,NA和Peg-IFNα-2b作为2种作用机制不同的抗病毒药物在CHB治疗中发挥了重要作用[13-14]。同时,NA治疗后的血清HBsAg低水平等CHB优势人群可通过联合PEG-IFNα-2b治疗实现临床治愈[15],为攻克CHB这一世界性难题提供了新的思路。
本研究结果显示,开始治疗后,2组患者血清HBsAg、HBeAg水平整体呈下降趋势,且观察组患者血清HBsAg、HBeAg水平下降更显著,提示NA序贯联合PEG-IFNα-2b治疗对HBsAg低水平CHB患者具有良好的抗病毒效果和血清转换率。目前,CHB治疗的理想终点主要包括HBsAg和HBV DNA的阴转、肝脏各项生物化学指标恢复及组织病变改善,而HBeAg血清学转换的出现标志着长期预后的改善。HBsAg与CHB患者体内共价闭环DNA(covalently closed circular DNA,cccDNA)有相关性,体内cccDNA是HBV持续感染的关键,因此,清除HBsAg的关键一步是耗竭体内的cccDNA[16]。NA是重要的抗病毒药物,通过直接抑制HBV DNA复制,使病毒载量降低,发挥抑制病毒的作用。恩替卡韦是临床上应用最普遍的NA药物之一,其给药途径便捷,可有效降低患者体内HBV DNA载量,但其对HBsAg的清除率不太理想,同时存在停药复发和长期用药产生耐药的风险[17-18]。干扰素也是常用的抗病毒药物,其在维持持久应答方面显示出明显的优势,这得益于其兼具抗病毒和免疫调控的功能,干扰素通过与细胞表面特异性细胞膜受体结合发挥作用,启动一系列细胞内反应,干扰细胞内病毒复制过程,抑制细胞增殖,增加免疫调控[19],使用干扰素治疗CHB,患者血清HBsAg清除率理想,因此,二者联合治疗的案例在临床上越发普遍。
本研究结果显示,观察组患者HBsAg和HBeAg阴转率明显高于对照组,血清HBV DNA水平明显低于对照组;这是因为PEG-IFNα-2b和NA早期直接发挥抗病毒作用,使HBV DNA 水平下降,晚期PEG-IFNα-2b发挥其免疫调节功能,宿主本身的免疫重建最终决定了抗病毒治疗的疗效转归,实现降低HBV DNA水平的同时,实现HBsAg和HBeAg血清转换。PEG-IFNα-2b的作用机制为直接抗病毒作用和对HBV感染的肝细胞的细胞免疫反应,PEG-IFNα-2b的抗病毒作用通过调控相关信号通路,产生多种抗病毒蛋白,作用于HBV 复制和转录等环节,从而抑制 HBV DNA 合成[20-21]。PEG-IFNα-2b的免疫调节功能通过提高特异T 细胞实现。既往研究显示,NA序贯联合PEG-IFNα-2b治疗的模式可刺激特异性淋巴细胞应答[22]。NA 治疗CHB难以达到持久免疫控制效果,一旦停药容易复发,而序贯联合PEG-IFNα-2b是辅助患者实现持久免疫控制、安全停药的理想方案。对于NA 经治CHB患者而言,尤其是初始HBsAg低水平和获得病毒学与血清学应答的优势患者,应用PEG-IFNα-2b治疗,可巩固临床疗效,同时还可实现停药后持久应答[23]。相比于单用恩替卡韦治疗,恩替卡韦序贯联合PEG-IFNα-2b治疗在抑制病毒复制、提高HBsAg和HBeAg血清阴转率方面均显示出更有效的效果。相关研究显示,部分患者经过约48周PEG-IFNα-2b治疗结束后1 d内能够实现HBeAg血清学转换,相当一部分CHB患者在治疗结束后 2 d依然维持应答[24]。PEG-IFNα-2b在慢性乙型肝炎治疗中可维持持久的免疫抑制功能,能够实现患者停药后持久应答,协助患者安全停药[25-26]。PEG-IFNα-2b序贯治疗是有效的CHB治疗方案,但与NA类药相比,PEG-IFNα-2b价格昂贵,一定程度上加重了患者的经济负担,因此,临床用药还应综合患者整体情况,选择合适的治疗方案。
ALT和AST是临床常用的反映肝功能的指标,当肝组织发生病变时,ALT和AST水平会显著升高。本研究结果显示,治疗后2组患者血清ALT和AST水平整体均呈下降趋势,观察组患者血清ALT和AST水平下降更显著,提示NA序贯联合PEG-IFNα-2b治疗可以有效改善HBsAg低水平CHB患者的肝功能。
综上所述,NA序贯联合PEG-IFNα-2b治疗HBsAg低水平CHB患者具有良好的临床疗效,该序贯联合治疗方案可有效抑制患者体内HBV DNA复制,提高血清HBsAg和HbeAg的阴转率。本研究的不足之处在于仅研究了HBsAg低水平优势患者NA序贯联合PEG-IFNα-2b治疗的效果,部分患者经NA治疗后未实现病毒学与血清学应答的情况尚未考虑;同时,本研究样本量有限,尚需进一步深入研究。
