血耳多糖对小鼠Raw264.7 巨噬细胞的免疫调节作用研究
2022-05-26王新茹姚秀君王君楚包鸿慧
牛 越,王新茹,姚秀君,王君楚,包鸿慧
(1. 湖北文理学院 食品科学技术学院,湖北 襄阳 441000;2. 湖北保侬康血耳科技开发有限公司,湖北 襄阳 441600)
0 引言
免疫是人体重要的防御屏障,无论是对癌症的预防,还是对新冠肺炎病毒的对抗,增强机体免疫力尤为关键[1]。血耳又名血银耳,是一种传统名贵药食兼用珍稀食用菌,具有益气活血,平肝阳、去热毒的功效,常用于妇科疾病、痢疾和急性肝炎等的治疗[2-3]。多糖是食用菌中的主要活性成分,目前对血耳多糖的研究报道不多[4],而对血耳免疫活性未见报道。采用热水浸提法从血耳子实体中提取血耳多糖,研究其对小鼠巨噬细胞的免疫活性,为血耳资源的研究与开发提供试验科学依据。
1 材料与方法
1.1 材料
血耳,湖北保侬康血耳科技开发有限公司提供,原料去杂,鼓风干燥,打磨,过60 目筛,-20 ℃下保存;RPMI-1640 培养基(含胎牛血清),瑞士Roche 公司提供;水溶性四唑盐(WST-1),美国标准生物品收藏中心(ATCC),小鼠巨噬细胞;其余试剂均为国产分析纯级。
1.2 仪器与设备
离子交换色谱,加拿大戴安公司产品;R200 型旋转蒸发器,瑞士BUCHI 公司产品;HC-3514 型离心机,科大创新股份有限公司产品;EL-800 型酶联检测仪,美国BioTek 公司产品。
1.3 试验方法
1.3.1 血耳子实体多糖的提取
血耳粉末按料液比1∶10 沸水浸提2 h,冷却,以转速4 000 r/min 离心15 min。取上清液,旋转蒸发仪浓缩,浓缩液按1∶4 乙醇沉淀,冰箱中4 ℃下过夜,离心取沉淀,经复溶、透析、冻干,得血耳多糖。
1.3.2 血耳子实体多糖化学组成分析
含糖量测定采用硫酸苯酚法,蛋白含量测定选用lowry 法,单糖含量测定采用离子交换色谱法[5]。
1.3.3 血耳多糖对癌细胞的抑制作用
取含10%胎牛血清的RPMI-1640 培养基,于96 孔培养板上接种人胃腺癌细胞(AGS)、结肠腺癌细胞(DLD-1) 和子宫颈癌细胞(HLa) 悬液,每孔200 μL 培养24 h(5%CO2、37 ℃),弃上清液,加入不同浓度梯度的不含小牛血清的血耳多糖样品,培养48 h 后,加入WST-1,再培养4 h,于波长450 nm 处测定OD 值。癌细胞抑制率按照公式(1) 计算。

式中:As——试验组OD 值;
Ac——空白对照组OD 值。
1.3.4 血耳多糖对Raw264.7 的增殖作用
将巨噬细胞Raw264.7 和多糖溶液(100 μL) 放置于96 孔培养板培养72 h,于波长405 nm 处测定吸光度。采用WST-1 法分析增殖作用,免疫细胞增殖率按照公式(2) 计算。
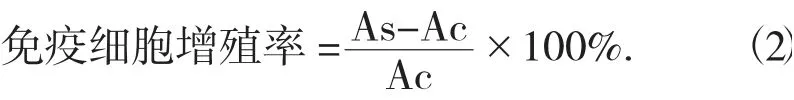
式中:As——实验组OD 值;
Ac——空白对照组OD 值。
1.3.5 血耳多糖对Raw264.7 分泌NO 分泌量的影响
将巨噬细胞(浓度为1×106cell/mL) 接种于96 孔培养板中,待细胞贴壁后,弃上清液。添加不同浓度的TSP 溶液或LPS(1 μg/mL,阳性对照),继续培养。24 h 后取上清液,加入等体积的Griess试剂,避光下反应10 min,于波长540 nm 处测定吸光度。
1.3.6 血耳多糖对Raw264.7 免疫因子的影响
将不同浓度的多糖溶液及LPS 与巨噬细胞悬液混合,置于96 孔平板上培养48 h 后,用ELISA 试剂盒检测细胞上清液中的细胞因子(TNF-α、PGE2、IL-1β) 的表达量。每组多糖处理组为3 个重复。
1.3.7 血耳多糖对Raw264.7 免疫因子基因表达的影响
Raw264.7 中加入TSP 或LPS,置于24 孔细胞培养板中,培养18 h。收集细胞,用TRIzol 试剂(Invitrogen,Carlsbad,CA,USA) 提取总RNA。以提取的RNA 为模板,用oligo-(dT) 20 primer 和Superscript III RT(Invitrogen hCarlsbad hCA hUSA) 制备cDNA,再用PCR 技术进行扩增,产物用1%琼脂糖凝胶电泳检测,并用凝胶图像处理软件扫描分析(Kodak Digital Science hKennesaw hGA hUSA)。
1.3.8 数据处理
应用SAS 8.0 软件分析,各试验组之间的差异用单因素方差分析(ANOVA) 和邓肯氏复极差(Duncan's multiple-range test) 法进行分析比较。
2 结果与分析
2.1 血耳多糖的化学组成
采用水提醇沉法提取血耳多糖,提取的血耳多糖含糖量为82.13%,含有少量蛋白(5.34%) 及灰分(6.05%),单糖组成表明,血耳多糖主要由葡萄糖(80.52%) 组成,含有少量半乳糖(19.48%)。Wang Zhaojing 等人[6]报道了血耳多糖TSPII 主要由甘露糖、木糖、半乳糖和葡萄糖组成,这主要是由于原料来源、提取纯化和检测方法不同。
血耳多糖的化学组成见表1。

表1 血耳多糖的化学组成/%
2.2 血耳多糖TSP 对小鼠巨噬细胞增率的影响
巨噬细胞在病原体和抗原的刺激下会启动免疫应答[7]。因此,试验以小鼠巨噬细胞Raw264.7 为细胞模型,考查血耳多糖对Raw264.7 免疫增殖及细胞因子分泌的影响,为血耳多糖的开发利用提供理论依据。结果表明,含有血耳多糖的培养皿中,细胞长势良好,培养基清澈。
TSP 对巨噬细胞Raw264.7 增殖率的影响见图1。

图1 TSP 对巨噬细胞Raw264.7 增殖率的影响
加入TSP 后,小鼠巨噬细胞增殖率提高,且增殖率随TSP 质量浓度增加而增加,具有质量浓度梯度关系,说明TSP 对小鼠巨噬细胞Raw264.7 无细胞毒性,可以促进小鼠巨噬细胞的增殖。
2.3 TSP 对小鼠巨噬细胞NO 的影响
TSP 对巨噬细胞Raw264.7 中NO 的影响见图2。

图2 TSP 对巨噬细胞Raw264.7 中NO 的影响
NO 的分泌是巨噬细胞激活的重要指标,抗癌抗病毒等功能通过释放NO 来实现[8]。TSP 对小鼠巨噬细胞分泌NO 的影响。由图2 可知,TSP 能显著提高小鼠巨噬细胞NO 的分泌,并呈现计量依赖关系。说明TSP 是免疫调节活性物质,具有免疫调节活性。
2.4 TSP 对小鼠巨噬细胞细胞因子分泌的影响
被激活的巨噬细胞能释放大量的细胞因子,如TNF-α、PGE2 等。细胞因子在免疫反应中起到了至关重要的作用,可以抗击炎症、抑制肿瘤等[9-12]。
TSP 对巨噬细胞中TNF-α 释放的影响见图3。
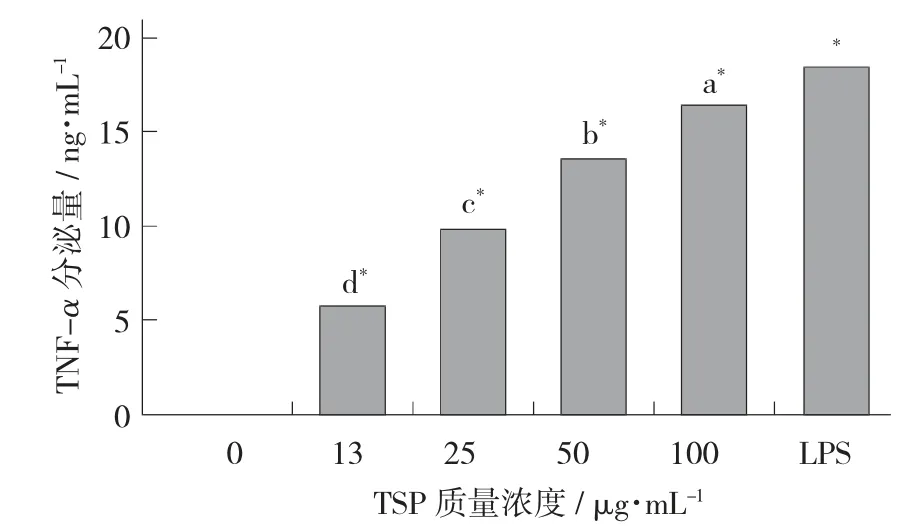
图3 TSP 对巨噬细胞中TNF-α 释放的影响
在添加TSP 后,巨噬细胞分泌细胞因子TNF-α、PGE2、IL-1β 较阴性对照明显增加(p<0.01),且生成的细胞因子随TSP 剂量的增加而增加,呈剂量依赖关系。
TSP 对巨噬细胞中PGE-2 分泌量的影响见图4,TSP 对巨噬细胞中IL-1β 分泌量的影响见图5。

图4 TSP 对巨噬细胞中PGE-2 分泌量的影响
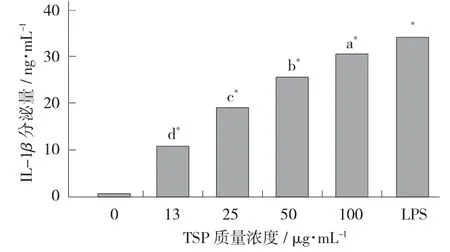
图5 TSP 对巨噬细胞中IL-1β 分泌量的影响
2.5 TSP 对小鼠巨噬细胞iNOS、COX-2 的影响
TSP 对巨噬细胞中iNOS mRNA 表达的影响见图6,TSP 对巨噬细胞中COX-2 mRNA 表达的影响见图7。

图6 TSP 对巨噬细胞中iNOS mRNA 表达的影响

图7 TSP 对巨噬细胞中COX-2 mRNA 表达的影响
iNOS 和COX-2 的表达由RT-PCR 方法检测获得。结果表明,小鼠巨噬细胞在与不同质量浓度TSP培养后,相对于阴性对照组,多糖组的mRNA 表达显著提高,并且呈现剂量依赖关系。结果表明,TSP促进小鼠巨噬细胞分泌NO 和PGE2 是通过iNOS 和COX-2 基因的表达完成的。
3 结论
沸水浸提法提取血耳多糖(TSP),TSP 对小鼠巨噬细胞Raw264.7 具有显著的刺激作用,具有免疫调节活性,可以作为免疫调节剂应用在食品和医药行业中。今后将进一步研究血耳多糖免疫活性的构效关系和免疫通路,以期为开发血耳多糖保健助剂提供基础理论依据。
