工业化生产大豆酱微生物群落发酵演替规律及功能变化特征
2022-05-25庞惟俏佐兆杭张乃丹周欣雨
庞惟俏,佐兆杭,孙 维,张乃丹,周欣雨,王 颖,2,3,4*
(1 黑龙江八一农垦大学食品学院 黑龙江 大庆 163319 2 国家杂粮工程技术研究中心 黑龙江 大庆 163319 3 粮食副产物加工与利用教育部工程研究中心 黑龙江 大庆 163319 4 黑龙江省农产品加工与质量安全重点实验室 黑龙江 大庆 163319)
豆酱属于一种传统发酵食品,丰富了中国人餐桌上的饮食文化和饮食选择的多样性,备受消费者青睐和商家关注。豆酱的原料挑选、种曲筛选[1]、发酵条件优化、产品研发,每个环节对制作和生产高质量豆酱和酱衍生类产品十分重要[2]。工业化生产大豆酱的发酵过程是原料大豆、面粉等物质,在曲精(霉菌、酵母菌、芽孢杆菌等)的作用下[3]于发酵池内进行一系列生化反应及能量代谢,包括淀粉糖化、糖酵解、产酯增香等,进而生成各类代谢产物和风味物质,赋予其独特的风味品质和功能特性。研究证实,传统大豆酱中的核心微生物对其风味物质的形成和不同发酵阶段的表观性质具有重要作用[4]。结合传统方式自然发酵加工工艺生产的大豆酱,因发酵生产过程处于开放式环境,最终生产出的豆酱品质不一。研究大豆酱微生物群落结构组成、演替规律、优势微生物及代谢过程等,对其发酵过程、产物生成及风味类别起重要作用[5]。
早期大豆酱及发酵酱制品微生物多样性和群落组成的研究,大都采用传统的分离培养、PCRDGGE、构建基因文库克隆技术[6-8]等方法,以便深入认识并揭示其微生物群落环境的整体情况。如陈依淼等[9]采用传统方法分离虾酱发酵过程中的17 株优势细菌;Nam 等[10]利用高通量测序技术比较分析韩国市售9 种成品传统大豆酱的微生物多样性,证明芽孢杆菌属(Bacillus)是主要的优势菌属。近年来,多数研究集中在大豆酱的微生物群落多样性和组成,对其发酵过程中微生物的功能性预测分析的相关文献报道较少。大豆酱不同发酵节点的微生物群落多样性及优势微生物对其发酵理化性质和香气品质的影响可能存在差异。宏基因组测序技术和宏转录组测序技术能够深入表达基因和获得发酵食品中微生物群落结构及特定微生物,并可预测其发酵过程中微生物潜在的功能特性[11-13],其应用越来越受到重视。本试验以不同发酵时间节点的工业化生产大豆酱为研究对象,分析其发酵过程中理化性质变化和微生物群落的演替规律并进行相关性分析,同时预测发酵过程中的微生物群落组成,以期保证在酿造周期内生产的大豆酱保持稳定的天然酿造风味,同时,通过了解大豆酱生产和风味物质形成的机制,为日后完善大豆酱标准化生产工艺,进一步研究功能性和风味稳定的关系奠定基础。
1 材料与方法
1.1 材料和试剂
大豆酱,黑龙江省某知名品牌大豆酱酱厂。
3,5 -二硝基水杨酸、苯酚,上海生工生物工程技术服务有限公司;福林酚试剂、碳酸钠,国药集团化学试剂有限公司;对甲氧基苯甲醛、酪蛋白,上海岚派生物科技有限公司;柠檬酸、柠檬酸钠,天津市大茂化学试剂厂。所有有机溶剂、标准品均为分析纯级。DNA 提取试剂盒QIAamp DNA stool mini kit,美国OMEGA 公司。
1.2 仪器与设备
720 紫外-可见分光光度计,北京莱伯泰科仪器有限公司;微量高速离心机,Thermo 公司;Pico-21 台式离心机,Thermo Fisher 公司;GL-88B 漩涡混合器,海门市其林贝尔仪器制造有限公司;TND03-H-H 混匀型干式恒温器,深圳拓能达科技有限公司;DYY-6C 型电泳仪电源、DYCZ-21 电泳槽,北京市六一仪器厂;T100TM Thermal Cyeler PCR 仪,BIO-RAD 公司。
1.3 试验方法
1.3.1 大豆酱样品采集 分别收集大酱池中发酵1,7,14,21,28,34 d 的大豆酱,在酱池顶部、中部、底部随机采集翻醅后的酱醅各20 g 后混匀;置于灭菌袋中,-80 ℃保存,以备进行DNA 提取。
1.3.2 大豆酱风味理化物质测定 大豆酱粗提液的制备:称取5.0 g 大豆酱用蒸馏水定容100 mL,28 ℃下均质振荡60 min,3 500 r/min 离心15 min,上清液经滤纸过滤,过滤后溶液为粗提液。参照酱卫生标准的分析方法 (GB 5009.40-2003)[14]和食品安全国家标准食品中氨基酸态氮的测定方法(GB 5009.235-2016)[15],测定大豆酱总酸和氨基酸态氮含量。通过3,5-二硝基水杨酸法测定还原糖和葡萄糖淀粉酶含量;采用福林酚法测定蛋白酶含量。单位体积大豆酱粗酶液1 min 水解淀粉生成1 μg 麦芽糖为1 个酶活力单位(U);单位体积大豆酱粗酶液1 min 水解酪蛋白生成1 μg 酪氨酸为1 个酶活力单位(U)。
通过气相色谱-质谱连用顶空固相微萃取技术(HS-SPME-GC-MS)测定大豆酱挥发性成分。每组分别取约2.0 g 的大豆酱样品加入40 mL 样品瓶中,加入经过稀释的对甲氧基苯甲醛内标溶液5 μL,将样品瓶放入60 ℃水浴中平衡10 min,将老化5 min 的50/30 μm(DVB/CAR/PDMS)萃取针头插入样品瓶中,恒温60 ℃萃取30 min,插入GC-MS 的进样器于250 ℃条件下解析1 min,同时启动仪器采集数据。GC-MS 分析时,进样口温度250 ℃,载气He,流速1.0 mL/min。程序升温条件,由室温升至80 ℃保持2 min,然后以4 ℃/min升至180 ℃在此温度下保持3 min,再以5 ℃/min升至230 ℃,保持5 min,降温至80 ℃,不分流进样。质谱条件:MS 离子源在225 ℃全扫描,电离方式:EI,电子能量70 eV;扫描质量范围:50~500 u。通过检索质谱图和NIST02.L 标准谱库对照匹配进行定性分析;根据内标物的浓度、样品中各组分的峰面积与内标峰面积的比值进行定量分析。
1.3.3 大豆酱DNA 的提取 使用QIAamp DNA stool mini kit 试剂盒提取大豆酱的总DNA,确保所提取的DNA 纯度和完整性,-80 ℃保存,待构建测序文本备用。
1.3.4 PCR 扩增及高通量测序 16S rDNA 扩增引物是利用测序平台的341F 引物/805R 引物;18S rDNA 扩增引物是NS1-FUNG 通用引物,通过Illumina Miseq 测序平台对文库进行测序。使用PEARV0.9.6 将Miseq 双端测序的reads 重叠部分拼接成一条序列,利用软件UsearchV5.2.236 去除非靶区域序列、嵌合体及短片段序列,为减少错误率,对样本序列进行标准化(Q20 和Q30 得分均是99%)。利用MothurV1.30.2 将多条序列按其序列间的距离进行聚类,根据序列之间的相似性0.97 作为阈值分成OTU (Operational taxonomic unit),获取样品属水平的分类和丰度,利用RDP classifer(v2.2)软件将OTU 序列与数据库进行比对,获得物种注释。
1.3.5 数据分析 基于Excel 2021 软件和GraphPad Prism 9.2 软件进行数据统计分析和图形绘制。用Simca-p11.5 软件进行偏最小二乘判别分析 (Partial least squares discriminant analysis,PLS-DA),基于R 语言version 3.3.1 进行主成分分析(Principal co-ordinates analysis,PCoA)。通过使用LEfSe 线性判别分析(LDA)来估算每个组分(物种)丰度对差异效果影响的大小,鉴定不同发酵时期细菌和真菌群落物种之间的差异,并将LDA 的筛选值设置为2[16]。通过PICRUSt2 对OTU丰度进行标准化,然后通过每个OTU 对应的greengene id,获得OTU 对应的COG 家族信息;并计算各COG 的丰度和KO 丰度,根据eggNOG 数据库中解析到各个COG 的预测性描述信息,以及其功能信息。RDA 分析即冗余分析,97%相似性的样本OTU 进行分析,判断理化因素与不同发酵时期的豆酱菌群之间相关性和显著性。使用R 语言软件包psych 和corr.test 函数计算斯皮尔曼(Spearman) 两两相关性并分析相关性的显著性,通过Cytoscape 软件将显著性P<0.05 且相关系数|r|>0.6 的高度相关性可视化。
2 结果与分析
2.1 大豆酱风味理化物质的监测
总酸、氨基酸态氮、还原糖、挥发性成分、微生物酶活性的动态变化是影响豆酱发酵品质的关键因素[17]。工业化生产大豆酱在发酵过程中可滴定酸和氨基酸态氮呈先上升后下降的趋势,如图1a和1b 所示,可滴定酸度在发酵第28 天含量最高,为4.05%;氨基酸态氮在发酵第21 天含量最高,为9.31 g/100g。这是由于发酵过程中乳酸菌或者乳酸杆菌发酵代谢,促使大豆酱中的酸不断富集;氨基酸态氮在大豆酱发酵过程中对其风味品质具有一定影响,发酵后期时其含量下降可能是由于蛋白酶活性减弱,进而影响氨基酸态氮含量的变化。还原糖在大豆酱发酵过程中影响其颜色和微生物的生长情况,如图1c 所示,还原糖在发酵第14 天时含量最高,为6.32 g/L,含量最低时是第21天,为4.24 g/L,含量突然变化可能是由于微生物的代谢能力下降以及微生物对碳源消耗的增加导致。蛋白酶和淀粉酶是将大分子物质分解为小分子的催化剂,如图1d 和1e 所示,这2 种酶的活性随发酵时间的延长而减弱,结果表明大豆酱中微生物的代谢在发酵后期也逐渐趋于稳定。通过HS-SPME-GC-MS 检测分析发现,大豆酱发酵过程中共检出45 种挥发性化合物,其中包括7 种醇类、17 种酯类、4 种酸类、3 种酚类、2 种醛类、2种酮类和10 种其它类挥发性成分。如图1f 所示,总挥发性化合物含量在发酵过程中逐渐积累,而在第28 天时,挥发性成分下降至285.42 ng/g,这与酶活性的结果相吻合,除了微生物群落的影响因素,可能与发酵过程中翻醅的次数和车间环境因子相关;待发酵结束时,挥发性成分含量积累到最大(945.91 ng/g)。醇类和酯类是大豆酱的主要挥发性成分,其中酯类化合物占挥发性化合物总含量的60%以上。这与贾云等[18]的相关研究结果一致,醇酯类挥发性成分是大豆酱风味的主成分。
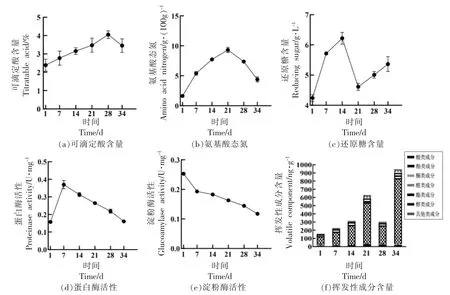
图1 大豆酱发酵过程中风味理化指标的动态变化情况Fig.1 Dynamic changes of physicochemical and flavor indicators during fermented soybean paste
由不同发酵节点的大豆酱挥发性成分热图(图2)可以看出,发酵代谢产生的各种挥发性成分出现更替变化,挥发性成分在发酵后期显著富集,同时发酵中后期是醇酯类化合物的高产期。醇酯类化合物赋予大豆酱适宜的特殊醇酯香气,丰富其独特的发酵品质和性质。乙醇、苯乙醇、2,3-丁二醇、麦芽醇、异戊醇等醇类化合物在大豆酱中被检出,其是脱水缩合酯化反应的重要前体成分[19]。例如,乙醇在许多类发酵食品中被广泛检出,是微生物的主要代谢产物,对发酵食品的风味、质地和颜色的形成发挥重要作用[20]。大豆酱中的酯类化合物,除了酸醇催化反应生成酯以外,微生物代谢反应亦可代谢可溶性酯。本试验中检测到的酯包括亚油酸乙酯、棕榈酸乙酯、硬脂酸乙酯、肉豆蔻酸乙酯等,它们具有各自独特的花果芳香气味。大豆酱中酸来源于乳酸菌等微生物的代谢产物和酯类化合物分解产物;酚类化合物来源于代谢产物还原糖的美拉德反应。本试验中酸酚类化合物尽管含量和种类较少,包括棕榈酸、乙烯基愈创木酚、肉豆蔻酸、甲基麦芽酚等,赋予大豆酱独特的酸味、辛香味和焙烤香气[21]。苯乙醛、2-羟基-5-甲基苯乙酮、六甲基环三硅氧烷等醛酮化合物和其它类化合物在大豆酱中被检出,赋予大豆酱类似水果甜味和风信子的香气[22]。

图2 大豆酱发酵过程中挥发性风味物质的变化Fig.2 Changes of volatile flavor compounds in soybean paste during fermentation
2.2 大豆酱微生物物种注释及组成
2.2.1 大豆酱微生物群落多样性 序列经过高通量测序平台质量控制,根据OTU 数目和OTU 所含的序列数得到大豆酱发酵过程中微生物群落的丰富度和多样性,揭示其物种多样性的信息。由图3可知,细菌多样性指数呈先上升后下降的趋势,表明大豆酱中细菌多样性先增加后减少,发酵第14 天时,Shannon 指数为2.54,细菌多样性最高,发酵初期细菌多样性最低为1.35;真菌丰富度更替变化,多样性指数在第21 天最低,第7 天最高,Shannon 指数分别为0.30 和0.81,发酵初期大豆酱醅中微生物营养物质含量高,生长条件适宜,大部分微生物生长和代谢增强。这些结果与以往多数发酵食品报道的结果相似[18-19]。
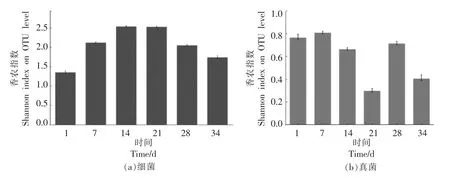
图3 不同发酵节点大豆酱细菌(a)和真菌(b)群落Shannon 指数Fig.3 Shannon index of the community of active bacteria (a) and fungi (b) in fermented commercial soybean paste at different fermentation nodes
2.2.2 大豆酱微生物物种组成 大豆酱中丰富的微生物物种组成赋予其独特的发酵品质和特性,利用宏基因组测序技术,筛选出其中序列丰度大于5%的优势细菌和真菌,得到了大豆酱在属水平上,不同发酵阶段动态优势微生物的种类和丰度。如图4所示,不同发酵节点优势细菌属不同,最高丰度分别为葡萄球菌属(Staphylococcus,58.78%),阪崎肠杆菌属(Cronobacter,57.34%),四联球菌属(Tetragenococcus,37.83%),肠杆菌属(Enterobacter,32.49%),乳酸杆菌属(Lactobacillus,18.55%),魏斯氏菌属(Weissella,12.85%)。在整个发酵周期中随着发酵温度和盐度的升高,细菌序列丰度最高的是葡萄球菌属,其序列丰度呈现不断增加的趋势,是发酵初期的2 倍左右。然而,大豆酱中优势真菌属组成种类较单一,主要的真菌属分别是接和酵母属 (Zygosaccharomyces) 和曲霉属(Aspergillus)。接和酵母属的序列丰度在发酵初期和中期呈不断上升的趋势,由14.04%升高到97.38%;然而,曲霉属的序列丰度变化趋势与之相反,从81.36%下降至1.07%。曲霉菌属在大豆酱发酵过程中,提供了丰富的蛋白酶、脂肪酶和淀粉酶等,对酱的鲜味具有较大的贡献。在随后的发酵过程中需不断加入盐水,形成高渗透压和缺乏氧气的生长环境,使得霉菌的生长被抑制,曲霉属含量逐渐下降[23-24]。

图4 大豆酱发酵过程中属水平群落演替柱状图Fig.4 Successions and distributions community structure in commercial soybean paste at the genus level
通过PCoA 分析,第1 个主坐标轴(PCoA1)对细菌和真菌群落总变化的解释度分别为 57.98%和79.56%,对一系列特征值和特征向量进行排序,根据优势微生物物种的丰度,不同发酵节点的大豆酱中细菌和真菌的微生物群落组成差异显著,结果如图5a、5b 所示。通过微生物群落聚类分析,将大豆酱整体发酵过程分为发酵初期 (0~7 d)、发酵中期(7~14 d)、发酵中后期(14~27 d)、发酵后期(28~34 d)。

图5 大豆酱属水平的群落组成结构PCoA 和聚类分析Fig.5 Principal component and clustering analysis of microbial community diversity during commercial soybean paste fermentation
根据LEfSe 及线性判别分析(LDA 阈值为2)检测不同发酵节点的显著性差异优势类群,并判断其差异效果的程度。如表1所示,发酵初期的差异物种主要是四联球菌属和曲霉属,发酵中期富集大量肠杆菌属和曲霉属,而发酵中后期和后期葡萄球菌属和接合酵母菌属显著富集。在相关大豆酱的研究[25-26]中,测定出的优势菌属是耐盐性的接合酵母菌属和葡萄球菌属,它们一般对氧需求量不高,可减少大豆酱在发酵过程中翻醅次数,并可产生大量的酯类物质,贡献于大豆酱香气成分的形成。

表1 大豆酱不同发酵节点的差异优势微生物Table 1 Commercialize dominant biomarkers during the different fermentation stages of soybean paste
2.3 大豆酱微生物的功能预测
基于宏基因组数据的功能注释分析,分别对16S rDNA 基因序列数据进行PICRUSt2 功能预测和ITS 基因组的FUNGuild 功能预测分析,进而揭示大豆酱发酵过程中微生物群落功能。COG 数据库按照功能共分为26 类,在大豆酱发酵的所有样品中比对得到了23 种功能类别,如图6a 所示,发现不同发酵阶段的细菌群落的预测功能种类丰度分布均匀且变化稳定,丰度高的功能类别主要包括“S:Function unknown(未知功能)”、“E:Amino acid transport and metabolism(氨基酸的运输和代谢)”、“G:Carbohydrate transport and metabolism(碳水化合物运输和代谢)”、“J:Translation,ribosomal structure and biogenesis(翻译,核糖体结构和生物发生)”、“K:Transcription(转录)”、“P:Inorganic ion transport and metabolism (无机离子的转运和代谢)”。这说明大豆酱中细菌群落可能存在很多功能值得去深入挖掘;氨基酸和碳水化合物代谢主要是大豆酱发酵前、中期的代谢活动,这可能是由于其中的微生物可编码与氨基酸和碳水化合物代谢相关的酶,同时表明大豆酱在发酵过程中微生物群落细胞生长、代谢和产生能量物质很积极。使用FUNGuild 对大豆酱真菌进行功能分类,见图6b,不同发酵阶段样品未知功能(Unknown) 和未定义的腐生生物 (Undefined saprotrophs)占所有真菌OTU 的90%以上,大豆酱中此类真菌在属水平上分类地位和具体功能类别未定,需要进一步探索其真菌资源,相关报道指出腐生营养型(Saprotroph)通过降解死亡的宿主细胞来获取营养[27],本试验结果中此类功能随着大豆酱发酵时间的延长,丰度逐渐减少,这可能是因为发酵后期真菌活性减弱,促进其风味品质趋于成熟,进一步证实真菌对其发酵程度的影响。目前,本研究及相关研究均是基于DNA 水平技术研究大豆酱中微生物的情况,然而,可能会检测到的微生物会处于休眠状态进而导致试验结果的片面性[28],后期研究可以基于宏转录组测序技术(RNA水平)揭示大豆酱发酵过程中微生物群落的组成、演替和功能性注释,同时,也可利用代谢组学技术靶向性定性、定量地研究微生物代谢产物。
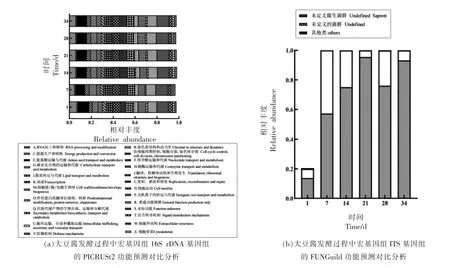
图6 大豆酱微生物群落演替功能预测对比分析Fig.6 Comparative analysis of function prediction of successions and distributions of microbial community during commercial soybean paste fermentation
2.4 大豆酱与风味物质相关性分析
2.4.1 不同发酵节点大豆酱与理化因素的相关性 为揭示大豆酱不同发酵时期与理化性质的关系,通过对细菌属和真菌属相对丰度与理化性质进行RDA 分析。由图7可知,挥发性成分、氨基酸态氮、蛋白酶活性对不同发酵节点大豆酱的影响程度较大,说明这几种指标是影响大豆酱风味物质的主要因素,其余指标(总酸、葡萄糖淀粉酶、还原糖)的影响程度相对较小。氮是微生物生长所必需的营养物质,因此,其含量会影响某些微生物生长[29]。根据6 种理化指标箭头间的夹角大小可知,挥发性成分与总酸和氨基酸态氮呈正相关;还原糖与蛋白酶、葡萄糖淀粉酶活性相关,这与其它文献研究相似[30]。

图7 理化性质与大豆酱不同发酵节点的RDA 分析Fig.7 RDA analysis of physicochemical properties and different fermentation period of commercialize soybean paste
2.4.2 大豆酱微生物群落与风味物质因素的相关性 基于上述微生物功能预测,通过对大豆酱发酵过程中的优势菌属与风味物质因素进行相关性分析,进一步证明了大豆酱微生物发酵过程中优势微生物的重要性及微生物功能预测的准确性。由图8可知,葡萄球菌属和接和酵母属与挥发性物质及其组成成分酸醛、醇酯等物质呈正相关,这与前期的研究结果及他人研究结果相吻合[18],这两种优势菌属对大豆酱挥发性物质形成具有贡献。曲霉属与总酸、蛋白酶和淀粉酶呈正相关,这表明前期添加的曲霉菌属可通过分泌酶降解代谢产物,这与菌群主要功能预测中碳水化合物和氨基酸代谢结果相似;其余菌属如阪崎肠杆菌与还原糖,乳杆菌属与蛋白酶呈正相关。

图8 大豆酱不同节点微生物属与理化指标之间的相关性分析Fig.8 Correlation analysis between microbial genera and physicochemical properties of different period soybean paste
利用R 语言软件,通过对序列丰度大于5%的37 种细菌属和真菌属以及45 种挥发性化合物之间的相关性进行分析,如图9所示,葡萄球菌属与醇酯、醛酮、酸类化合物呈正相关,如与苯乙醇、棕榈酸乙酯、2,2,4,4-四甲基-3-戊酮、对甲氧基苯甲酸等呈正相关。接和酵母属与醇酯类、酮类化合物呈正相关,包括乙醇、肉豆蔻酸乙酯、亚油酸甲酯、2,2,4,4-四甲基-3-戊酮等挥发性成分具有相关性。总之,优势菌葡萄球菌属和接和酵母属是对大豆酱风味物质贡献最大的微生物菌属,对醇酯类形成具有重要作用;其中葡萄球菌属促进代谢产物酸类物质和氨基酸态氮的形成。

图9 大豆酱不同发酵节点微生物属与挥发性成分之间的相关性分析Fig.9 Correlation analysis between microbial genera and volatile flavor compounds of different period soybean paste
3 结论
本研究采用宏基因组技术对工业化生产不同发酵节点大豆酱中主要理化指标、微生物群落及功能演替规律进行分析,并将风味物质影响因素与优势微生物进行相关性分析,揭示大豆酱微生物生态分布情况,预测其功能性变化。在微生物属水平上,细菌的微生物群落组成较真菌更加丰富,其中最主要的优势菌是细菌属的葡萄球菌属和真菌属的接和酵母属,随着发酵时间的延长,其序列丰度呈上升趋势。根据微生物菌群功能预测可知,大豆酱发酵过程中细菌和真菌属水平功能丰度分布主要是未知功能,这说明大豆酱中的菌群功能值得进一步深入研究。其次,优势菌属主要富集在氨基酸的运输和代谢以及碳水化合物的运输和代谢两种功能。相关性分析表明,氨基酸态氮、还原糖、挥发性成分等6 种理化因素对不同发酵节点的大豆酱具有不同程度的影响,且彼此之间呈正相关。优势菌属葡萄球菌属和接和酵母属与挥发性成分醇酯、醛酮类化合物相关性较大,促进大豆酱后期风味物质的形成,是挥发性成分形成的关键微生物。本试验从微生物群落结构和功能角度研究,有助于进一步探明传统工艺结合现代技术生产大豆酱的酿造机制,为大豆酱生产条件的控制及发酵种曲的开发提供一定的理论支持。
