波动温度条件下生鲜三文鱼中单增李斯特菌生长预测模拟
2022-05-25刘丽敏唐宇宏刘铖珺李长城
刘丽敏,唐宇宏,刘铖珺,方 婷,2,李长城,2*
(1 福建农林大学食品科学学院 福州 350002 2 闽台特色海洋食品加工及营养健康教育部工程研究中心 福州 350002)
单增李斯特菌(Listeria monocytogenes)是一种能够引起人畜共患疾病的食源性致病菌,因其能在低温环境(0~4 ℃)下生长,故对冷藏即食食品安全构成严重威胁,被称为“冰箱杀手”[1-4]。婴幼儿、老年人、孕妇及免疫缺陷人群都是单增李斯特菌的易感人群[5]。据美国疾病控制和预防中心报道,在美国每年至少确诊1 600 例李斯特菌病[6]。2017年,欧洲疾病预防和控制中心报告了2 502例确诊病例[7]。在中国,单增李斯特菌在食品中也屡见不鲜。2016年,辽宁省食品风险监测随机抽取市售水产品及其制品共87 份样品,检出单增李斯特菌7 株,检出率8.1%[8];梁文革等[9]对宝鸡市13 类食品进行分离和鉴定,共检出200 株单增李斯特菌,检出率8.49%。生鲜三文鱼因肉质鲜嫩,口感极佳而深受人们的喜爱。生鲜三文鱼加工只包括清洗、去皮去骨、切割等过程,不涉及任何加热烹饪处理,在极大限度地保证口感和营养的同时,也增加了感染单增李斯特菌的风险[10-12]。研究三文鱼中单增李斯特菌的生长行为规律具有重要意义。
预测微生物学以计算机为基础,描述一定环境下微生物的生长、失活行为,为食品安全风险评估提供重要支撑[13-16]。针对是否同步构建初级模型、二级模型,可分为一步法和两步法[17-19]。周晏等[4]将单增李斯特菌分别接种到三文鱼片、金枪鱼片、鲷鱼片中,在恒温条件下考察生食鱼片中单增李斯特菌的生长规律,通过两步法分别构建初级模型、二级模型;Jia 等[20]基于一步法,在恒温条件下研究温度对三文鱼中单增李斯特菌的影响,并根据背景菌群是否存在,分别构建非竞争生长模型和竞争生长模型。上述研究主要基于恒温条件下构建预测模型,在实际生产过程中,温度处于随机波动状态;然而,关于波动温度下三文鱼中单增李斯特菌的生长未见报道。
本研究旨在使用一步法构建并验证数学模型,以预测三文鱼中单增李斯特菌在波动温度情况下的生长行为,为食品安全决策和风险评估提供依据。此外,通过模拟暴露于连续波动温度条件下三文鱼中单增李斯特菌的生长,评估该模型的应用价值。
1 材料与方法
1.1 材料与试剂
三文鱼,福州山姆会员商店,真空包装后于福建康普顿辐照技术有限公司进行辐照处理(辐射源为Co60,剂量为15 kGy),并于-80 ℃冻藏。单增李斯特菌 (Listeria monocytogenes) 依国标GB 4789.30-2016《食品微生物学检验 单核细胞增生李斯特氏菌检验》[21]分离于三文鱼样品。
胰酪大豆胨琼脂培养基(TSA)、脑-心浸出液肉汤(BHI),广东环凯微生物科技有限公司;利福平(Rifampicin/Rif),北京索莱宝科技有限公司;蛋白胨粉,杭州微生物试剂有限公司。
1.2 仪器与设备
LRH-250 生化培养箱,上海恒一科学仪器有限公司;FRIOCELL 变温培养箱 (ECO),德国MMM 公司;Bag Mixer-400 均质拍打器,法国Interscience 公司;ST-16R 高速冷冻离心机,美国Thermo Fisher 公司;BSC-1000 生物安全柜,新加坡ESCO 公司;Whirl-Pak-207 mL 无菌均质袋,美国Nasco 公司;GI80TW 立式高压灭菌锅,致微(厦门)仪器有限公司。
1.3 细菌培养及接种菌液的制备
3 株单增李斯特菌均分离自三文鱼样品,保存在-80 ℃、含30%甘油的BHI 冻藏管中。使用菌株时,分别从冻藏管中挑取单环菌液接种至10 mL BHI 溶液中培养18~20 h,连续活化3 代获得活性稳定的菌株[22]。参照Fang 等[23]的方法对3 株活化菌株进行诱导,产生抗性,经平板(TSA/Rifampicin,TSA/Rif)划线并于4 ℃培养箱保存。
每次试验前,用接种环从平板上分别挑取一环单增李斯特菌,转移至含有0.5 mL 利福平、10 mL BHI 溶液的离心管中,在37 ℃摇床 (130 r/min) 中培养18~20 h,使菌株浓度达到109.0~109.5CFU/mL。然后放入高速冷冻离心机(转速5 000 r/min),在4 ℃条件下离心15 min,加入无菌蛋白胨水(0.1%)清洗菌体2 次。将上述3 株单增李斯特菌菌液混合,经无菌蛋白胨水(0.1%)梯度稀释至103.5~104.5CFU/mL,保存备用。
1.4 样品准备及接种
在无菌环境下将辐照处理的三文鱼切分成(5±0.2)g,置于无菌均质袋中。取50 μL 上述梯度稀释的悬浮液接种至三文鱼样品,并通过揉捏使菌液与样品充分接触。
1.5 动态生长试验及微生物计数
设置3 组波动温度程序(DT1:2~35 ℃连续波动174 h;DT2:1~34 ℃连续波动370 h;DT3:2~35℃连续波动255 h),将上述样品分别置于预设的波动温度程序下培养,并根据不同波动温度试验预设取样频率,每组至少独立重复2 次,用于模型的构建。另设6 组波动温度程序(DT4:2~35 ℃连续波动175 h;DT5:4~36.8 ℃连续波动165 h;DT6:4~37.3 ℃连续波动225 h;DT7:3~37 ℃连续波动250 h;DT8:4~30 ℃连续波动270 h;DT9:4~30 ℃连续波动168 h),将样品放入上述程序中培养,用于模型验证。取样时,向均质袋中加入20 mL 无菌蛋白胨水(0.1%),正、反面均质拍打各2 min。均质液经无菌蛋白胨水稀释后涂布于TSA/Rif 平板,置于37 ℃恒温培养箱中培养24~48 h 后计数,单位为lg(CFU/g)或ln(CFU/g)。
1.6 数学建模和数值分析
1.6.1 初级模型和二级模型 本研究选取Huang模型[24]、Baranyi 模型[25]和Two-compartment 模型[26]作为初级模型来拟合三文鱼样品中单增李斯特菌的生长行为。
Huang 模型微分方程表达形式如式(1)所示:
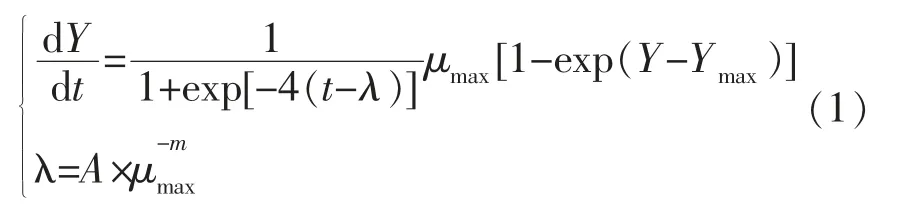
式中,Y、Ymax——细菌在t 时刻的浓度和最大生长浓度,ln(CFU/g);μmax——最大比生长速率,h-1;λ——迟滞期,h;A 和m 均为回归系数。
Baranyi 模型的微分方程表达形式如式(2)所示:
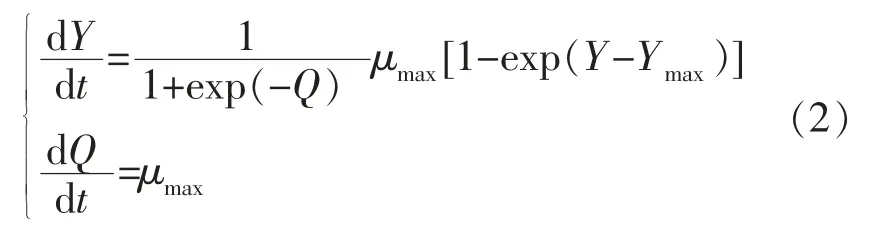
式中,Y、Ymax和μmax的含义与式 (1) 中的相同;Q——细菌所处的生理状态,初值为Q0。
Two-compartment 模型的微分方程表达形式如式(3)所示:
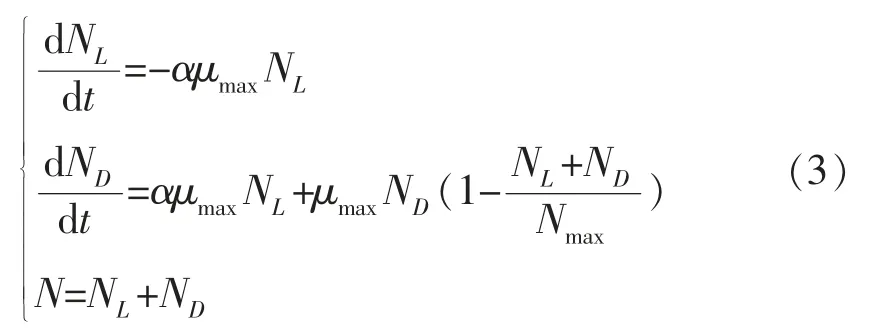
式中,μmax的含义与式(1)中的相同;N——细菌总量,CFU/g;NL、ND——休眠期和分裂期的细菌数量,CFU/g;Nmax——最大生长浓度,即系统的承载能力,CFU/g;α——决定休眠细胞离开休眠状态速率,其值介于0~1 之间。
本研究选取Huang Square-Root(HSR)模型作为二级模型,其表达式如式(4)所示:

式中,T、Tmin——细菌所处的环境温度和最低生长温度,℃;μmax的含义与式(1)中的相同;a——回归系数。
1.6.2 数值分析和非线性回归 本研究将3 组波动温度条件下的2 次独立重复试验数据合并,构成三文鱼中单增李斯特菌的生长数据集{Y},采用一步法对{Y}进行拟合分析,构建包含初级模型和二级模型的组合模型。数值分析过程中,通过四阶龙格-库塔法联合最小二乘法求解动力学参数,其中,Huang-HSR 模型的参数为{a,Tmin,A,m,Ymax},Baranyi-HSR 模型的参数为{a,Tmin,Ymax,Q0},Twocompartment-HSR (TC-HSR) 模型的参数{a,Tmin,Ymax,α}。上述数值分析方法均通过Matlab2018 软件编程实现。
1.7 模型评价与验证
通过计算模型的均方根误差(RMSE)【式(5)】及AIC 值【式(6)】,评价3 种组合模型的准确度及拟合优良性。此外,运用另设的6 组波动温度生长试验数据和文献报道的恒温试验数据,分别对模型及其参数估计值进行波温验证和恒温验证,计算其RMSE,以进一步评估模型的准确性;并考察试验实测值{Y}与模型预测值{Y^}的差异,通过Matlab2018 软件编程实现对误差的分布拟合。
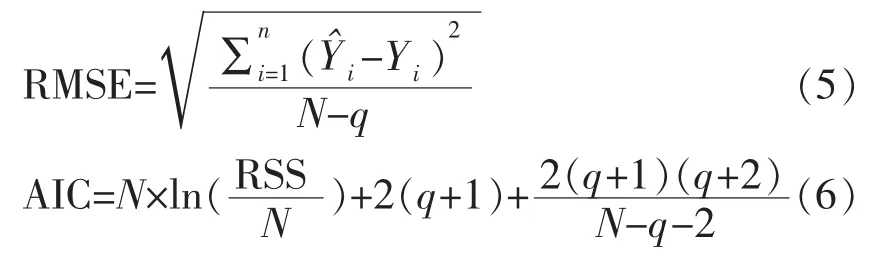
式中,N——观测值数量;q——参数数量;i——第i 个取样点。
1.8 波动温度条件下的模型应用与模拟
三文鱼加工及贮藏过程中,温度波动往往不可避免,因此,可运用上述构建的模型预测暴露于连续波动温度条件下三文鱼中单增李斯特菌的生长。本研究设置2~4 ℃,2~6 ℃,2~8 ℃,2~10 ℃共4组正弦波动温度变化程序,分别代表正常冷藏温度及失控温度场景,模拟150 h 内单增李斯特菌的生长行为,以显示模型的实用性和灵活性,其中,单增李斯特菌的初始浓度设为2.0 lg(CFU/g)。
2 结果与分析
2.1 数值分析及模型构建
本研究中,三文鱼样品的初始接种浓度为102.2~102.8CFU/g。图1a~1c 为3 组波动温度(DT1,DT2,DT3)条件下单增李斯特菌的生长曲线。3 组波动温度曲线的温度变化处于1~35 ℃,覆盖了三文鱼在运输、销售、贮藏等过程中可能经历的变化范围。
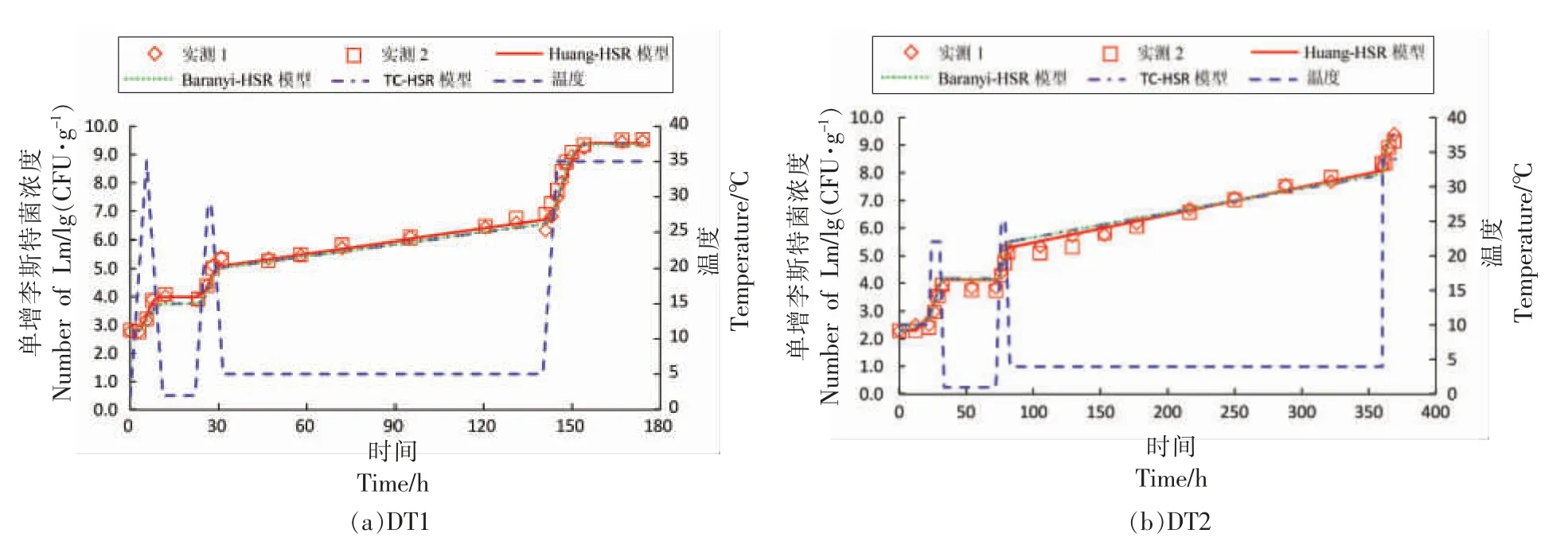
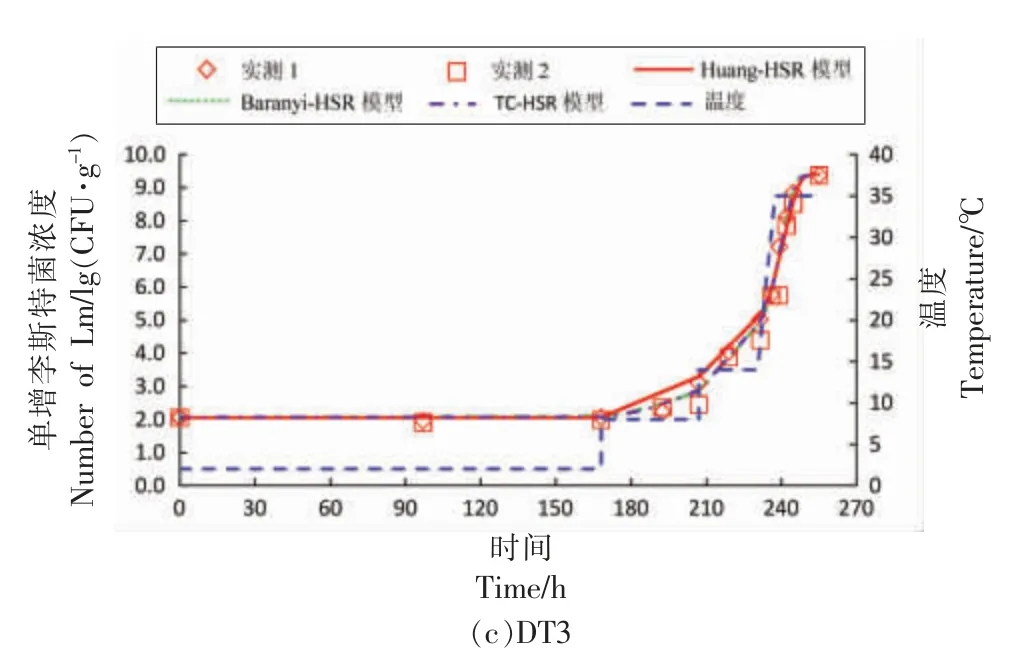
图1 波动温度条件下三文鱼中单增李斯特菌生长曲线一步法拟合分析Fig.1 One-step curve fitting of growth curves of Listeria monocytogenes in salmon under dynamic temperature condition
运用一步法对上述3 组波动温度生长数据(共计118 个数据点)进行数值分析,构建初级模型与二级模型的组合模型,求解模型动力学参数,统计分析和估计结果如表1、表2所示。由表1可知,Huang-HSR 模型、Baranyi-HSR 模型、Twocompartment-HSR 模型的均方根误差 (RMSE)分别为0.261,0.271,0.274 lg(CFU/g),P 值均远小于0.05,说明这3 种组合模型均能较准确描述波动温度条件下三文鱼中单增李斯特菌的生长;且三者的AIC 值分别为-309.39,-301.57,-299.42,相对差值在3.5%以内,可以认为3 种组合模型具有同等的拟合精度。如表2所示,由3 种模型估计的动力学参数均达到显著水平 (P<0.05);其中,由Huang-HSR 模型、Baranyi-HSR 模型、Two-compartment-HSR 模型的最低生长温度分别为0.51,1.21,1.20 ℃,这与Jia 等[20]报道的三文鱼中单增李斯特菌的最低生长温度相接近;由3 种模型估计的最大生长浓度分别为21.66,21.54,21.57 ln(CFU/g)【9.41,9.35,9.36 lg(CFU/g)】,差值介于0.03~0.12 ln(CFU/g)【0.01~0.06 lg(CFU/g)】,差异不显著。虽然上述3 种组合模型预估的单增李斯特菌的动力学参数均不存在显著差异,但其初级模型Huang 模型、Baranyi 模型及Two-compartment 模型对于细菌迟滞期的定义存在显著差别。Huang 模型通过式(1)中的方程以显函数的方式定义了细菌迟滞期,描述了迟滞期(λ)与最大比生长速率(μmax)的关系,由表2可知A、m 的值分别为1.094 和0.999;Baranyi 模型引入虚拟变量Q,以隐函数的方式定义迟滞期,通过求解式(2)获得其初值Q0(Q0=-1.637);Two-compartment模型将细菌划分为休眠期和分裂期2 个状态,以常数α(α=0.222)代表休眠细胞转化为分裂细胞的状态。
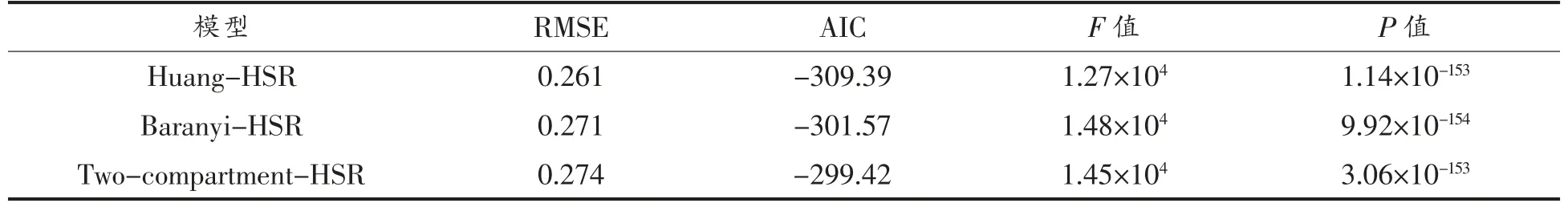
表1 一步法分析结果Table 1 Results of one-step approach analysis
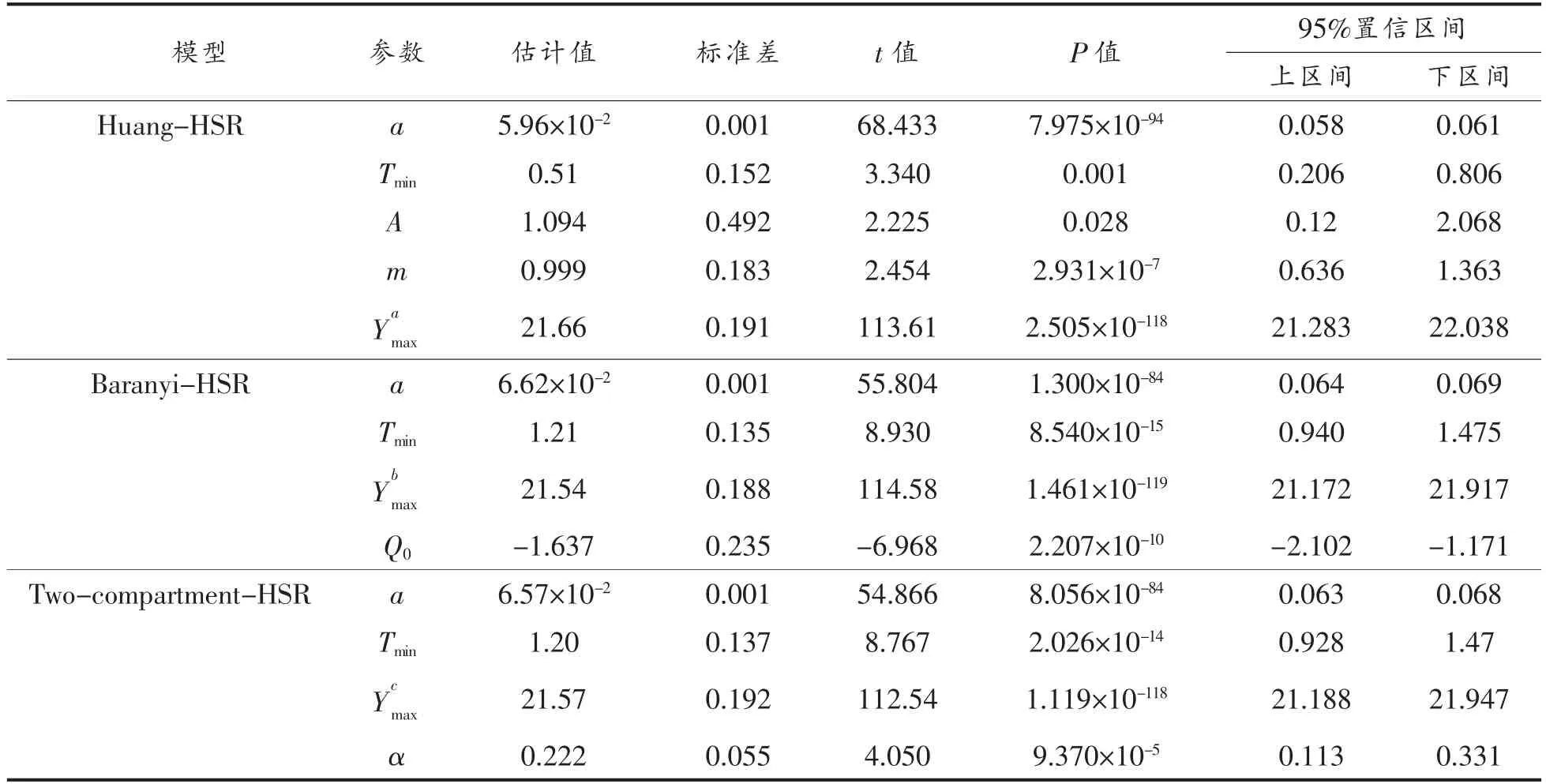
表2 3 种模型的动力学参数估计结果Table 2 Estimates of kinetic parameters of three models
温度对三文鱼中单增李斯特菌生长速率的影响如图2所示,随着温度的升高,生长速率增大,且由Huang-HSR 模型、Baranyi-HSR 模型、Twocompartment-HSR 模型估计的单增李斯特菌的生长速率相接近。同时,图2将本研究的结果与文献报道的结果进行对比。周晏等[4]研究了4,8,15,25,35 ℃条件下三文鱼生鱼片中单增李斯特菌的生长规律,通过传统的两步法分别构建了初级模型和二级模型,其报道的单增李斯特菌的生长速率显著低于本研究中单增李斯特菌的生长速率,这可能是由样品本身及的菌株差异所致。Jia 等[20]研究了恒温条件下三文鱼中的背景菌群对单增李斯特菌生长的影响,针对无菌三文鱼,构建了单增李斯特菌的非竞争生长模型;同时,针对存在背景菌群的生三文鱼,构建了单增李斯特菌-背景菌群竞争生长模型;本研究所使用的三文鱼样品经过无菌化处理,由3 种组合模型计算的单增李斯特菌的比生长速率与Jia 等[20]报道的在非竞争状态的下比生长速率一致,且大于其竞争状态下的比生长速率。综上所述,基于3 种组合模型对迟滞期的定义以及模型表达式的简洁程度,本研究建议选择Huang-HSR 模型作为组合模型来描述三文鱼中单增李斯特菌的生长。
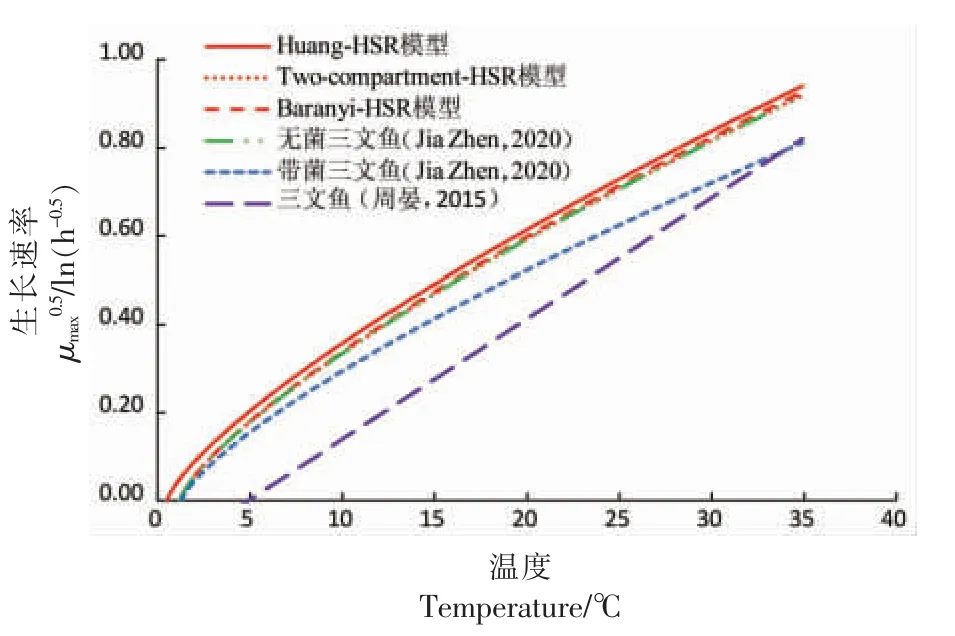
图2 温度对三文鱼中单增李斯特菌生长速率的影响Fig.2 Effect of temperature on growth rate (μmax)of Listeria monocytogenes in salmon
2.2 模型验证
2.2.1 波动温度模型验证 6 组波动温度(DT4,DT5,DT6,DT7,DT8,DT9)生长试验数据用于检验模型的准确性。因前述分析建议选择Huang-HSR模型为组合生长模型,故将6 组波动温度程度代入Huang-HSR 模型,经过正向计算,可获得各温度曲线下的单增李斯特菌生长预测曲线。图3a~3f将模型所得预测值与实测值进行比较,6 组验证试验的RMSE 分别为0.29,0.58,0.59,0.32,0.41,0.43 lg(CFU/g),结果表明该模型可以较为准确地预测动态条件下三文鱼中单增李斯特菌的生长。图4表明波动温度验证数据的残差服从正态分布,其均值为-0.01 lg(CFU/g),标准差为0.40 lg(CFU/g);其中,大约有79.4%的残差在-0.5~0.5 lg(CFU/g)之间,属于正常的试验误差范围,进一步表明模型具有较好的准确性。
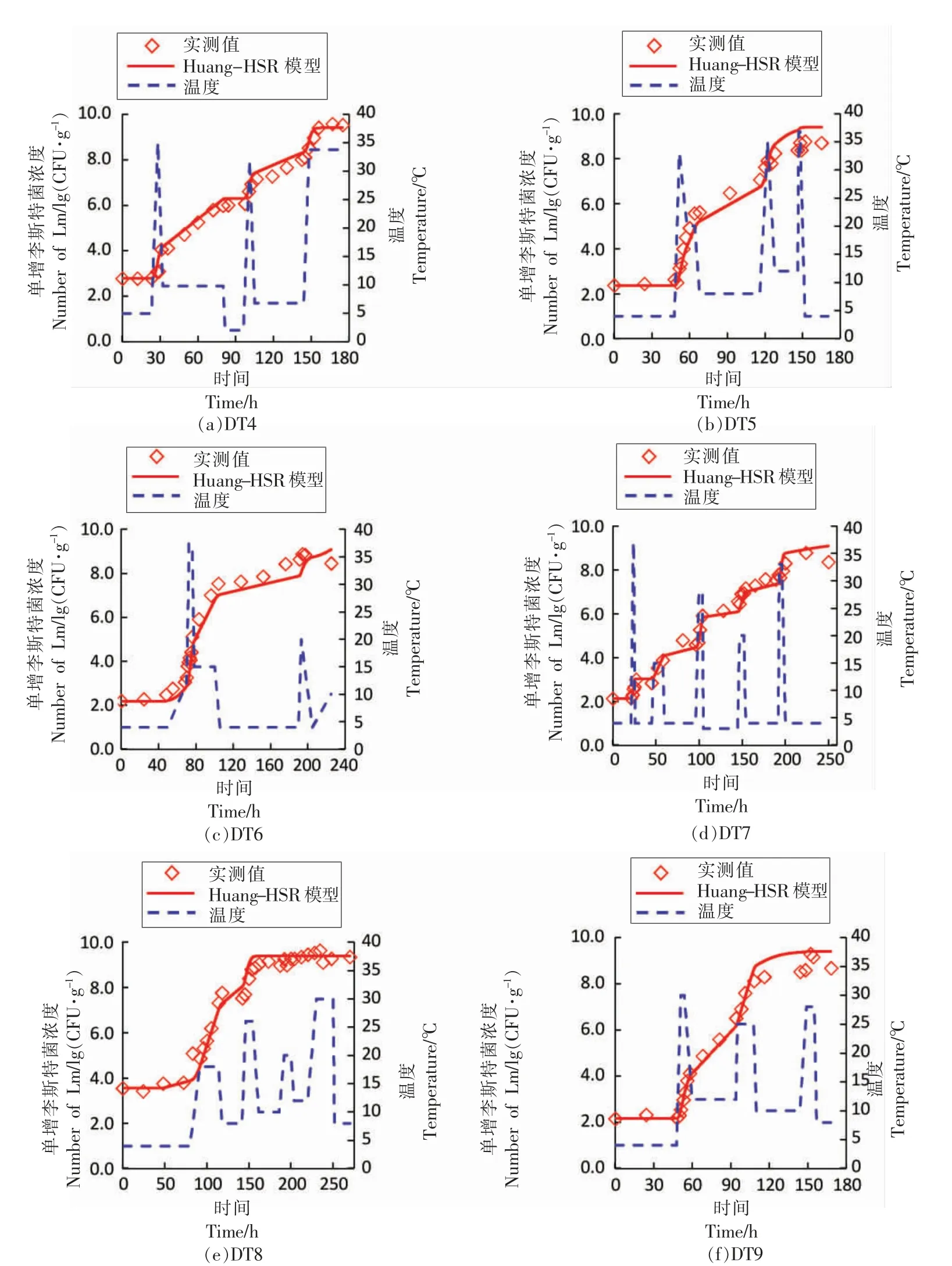
图3 波动温度条件下模型验证Fig.3 Model validation under dynamic temperature profiles
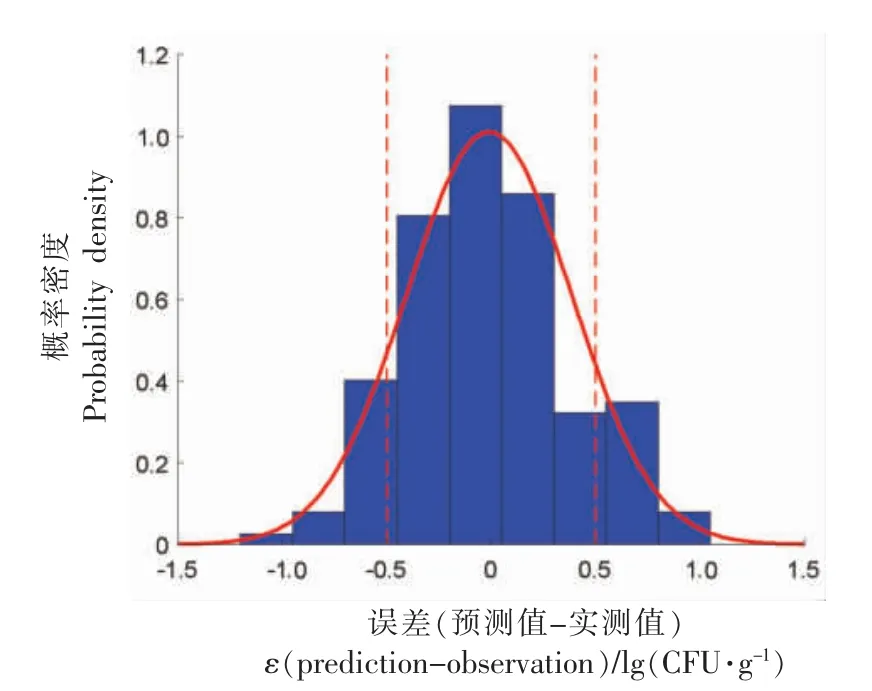
图4 波动温度模型验证残差分布Fig.4 The distribution of residual errors of dynamic validation
2.2.2 恒定温度模型验证 为了考察该模型在恒定温度状态下的准确性,本研究选取文献[20]报道的恒温(4,8,12,16,20,25,30,35 ℃)生长试验数据对模型进行验证。图5a~b 显示了在8 组恒定温度下三文鱼中单增李斯特菌的生长试验数据,以及Huang-HSR 模型预测的生长曲线。各温度下模型预测的RMSE 分别为0.44,0.64,0.65,0.60,0.28,0.59,0.84,0.85 lg(CFU/g)。总体上,由模型计算的预测曲线与文献实测数据较为符合,误差服从位置参数为-0.04 lg(CFU/g)和0.43 lg(CFU/g)的拉普拉斯分布,大约有68.8%的残差处于±0.5 lg(CFU/g)之间,仍处于正常的试验误差范围内。因此,本研究构建的预测模型同样适用于恒定温度条件下三文鱼中单增李斯特菌的生长预测。
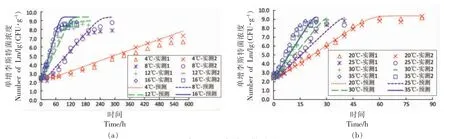
图5 恒定温度条件下模型验证Fig.5 Model validation under isothermal temperature profiles
2.3 波动温度下的模型应用与生长模拟
因单增李斯特菌在低温冷藏(0~4 ℃)条件下仍具有增殖能力,消费者从超市等零售终端购得生鲜三文鱼后,通常贮藏于冰箱冷藏层(0~4 ℃)。如果三文鱼在购买前本身被污染,或在家庭贮藏过程中被冰箱里可能存在的单增李斯特菌污染,经过一定时间的存放,消费者在食用时,将面临被感染的风险。通过构建模拟波动温度曲线下三文鱼中单增李斯特菌的生长模型,可为有效评估三文鱼食用风险提供指导。图7a~7d 模拟了时长为150 h,周期为8 h,不同振荡范围(2~4 ℃,2~6 ℃,2~8 ℃,2~10 ℃)的正弦波动温度条件下,三文鱼中单增李斯特菌的生长浓度变化情况。由图7可知,在2~4 ℃波动条件下单增李斯特菌的增长不明显;而在2~6 ℃,2~8 ℃,2~10 ℃波动条件下,其增长速度较快,72 h 内单增李斯特菌的浓度分别上升了约0.35,0.71,1.09 lg (CFU/g),150 h 内浓度分别上升了约1.14,1.93,2.78 lg(CFU/g),表明温度是影响单增李斯特菌生长的重要因素。同时,相同温度波动条件下,贮存时间越长,单增李斯特菌的浓度越高,这提示消费者在购买三文鱼后,应尽快食用,尽量避免温度在非正常范围内波动以及长时间贮藏。
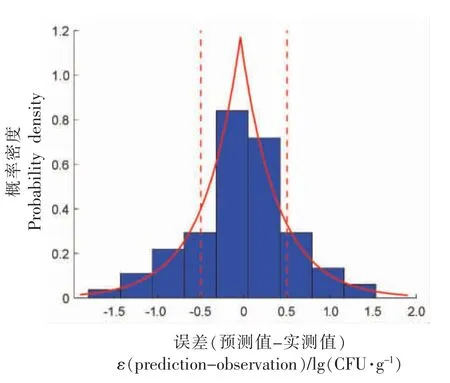
图6 恒定温度模型验证残差分布Fig.6 The distribution of residual errors of isothermal validation

图7 不同正弦波动温度条件下三文鱼中单增李斯特菌生长数值模拟Fig.7 Numerical simulation of the growth of Listeria monocytogenes in salmon under different sinusoidal temperature profiles
3 结论
本研究考察了连续波动温度(1~35 ℃) 条件下,单增李斯特菌在生鲜三文鱼中的生长,通过一步法构建Huang-HSR、Baranyi-HSR 和Two-compartment-HSR 3 种组合模型,求得最低生长温度分别为0.51,1.21,1.20 ℃,最大生长浓度分别为9.41,9.35,9.36 lg(CFU/g);3 种组合模型均适合用于描述三文鱼中单增李斯特菌的生长,然而基于对迟滞期的定义以及模型表达式的简洁程度,建议选择Huang-HSR 模型;波动温度和恒定温度条件下,验证试验数据的RMSE 分别为0.29~0.59 lg(CFU/g)和0.28~0.85 lg(CFU/g),表明构建的数学模型在波动温度或恒定温度条件下均适用;结合设置的4 组正弦波动温度,开展三文鱼中单增李斯特菌的生长数值模拟,证明了模型的实用性。
