樱桃花色苷对肥胖小鼠的降糖作用
2022-05-25宋海昭沈新春郑晓冬
宋海昭,沈新春,吴 涛,郑晓冬
(1 南京财经大学食品科学与工程学院 南京 210023 2 天津科技大学食品工程与生物技术学院 天津 300457 3 浙江大学生物系统工程与食品科学学院 杭州 310058)
樱桃是中国传统的药食两用浆果。现代营养学研究表明,樱桃不仅富含蛋白质、糖类、有机酸、维生素和矿物质等营养成分,还含有酚酸和黄酮类等生物活性物质,尤其是其特征性活性成分——花色苷的含量较高[1]。花色苷是一类由花色素与糖以糖苷键结合而成的化合物,具有抗氧化、抗癌、抗炎,降低血脂,延缓衰老和提高视力等生理活性[2-6],且花色苷安全无毒,在食品、化妆品和医药等领域有着巨大的应用潜力。樱桃具有明显的季节依赖性且贮藏期短,樱桃产业的发展也因此受到限制。提取樱桃特征性活性成分——花色苷,研究其生物活性,能够为樱桃高价值深加工与开发提供理论支持,推进樱桃精深加工与利用的进程。樱桃花色苷是樱桃果实中的主要呈色物质,研究表明,不同品种樱桃所含花色苷种类与含量稍有不同,其所含的花色苷主要类型为矢车菊-3-葡萄糖苷、矢车菊-3-葡萄糖基鼠李糖苷、矢车菊-3-槐糖苷和矢车菊-3-芸香糖苷[7-8]。目前关于樱桃花色苷的生理活性研究主要有:樱桃花色苷能够抗氧化应激,抑制COX1 和COX2 的生成,调节T 淋巴细胞亚群,显著降低炎症细胞因子水平,从而发挥抗炎镇痛作用[9-11];抑制肠道癌细胞的生长,降低患肠癌的危险[12-13];降低血液中甘油三酯和低密度脂蛋白胆固醇等含量水平,预防肥胖的发生[8]。此外,Wu 等[8]在研究膳食樱桃花色苷对肥胖的干预作用时发现,樱桃花色苷能有效降低肥胖小鼠血清中的胰岛素和血糖含量水平。体外实验研究发现樱桃花青素、花色苷作用于小鼠胰腺细胞时,无论在正常糖分或高糖环境,樱桃花色苷均能够显著促进胰岛素的分泌,尤其在高糖环境中,胰岛细胞的胰岛素分泌量增加了50%[14],且樱桃花色苷能够显著促进HepG2 的葡萄糖消耗水平[15]。然而,也有报道称在干预高脂膳食诱导的肥胖小鼠实验中,樱桃花色苷对餐后血浆胰岛素和空腹血糖含量水平无显著影响[16]。综上,樱桃花色苷虽具有良好的抗氧化、抗炎、抗肿瘤和降血脂等作用,但其是否具有良好的降糖活性存在分歧,其作用机制有待研究。本课题利用高脂饲料饮食诱导建立肥胖伴胰岛素抵抗小鼠模型,评价樱桃花色苷对肥胖伴随的高血糖和胰岛素抵抗等症状的干预作用。
1 材料与方法
1.1 材料与试剂
按照本课题组先前研究所报道的方法[8]制备得到樱桃花色苷,其主要含有矢车菊-3-O-2G-葡萄糖芸香糖苷 (39.4%)、矢车菊素-3-芸香糖苷(49.0%)和天竺葵素-3-芸香糖苷(2.6%)。30 只SPF 级4 周龄雄性C57BL/6 小鼠,体重17.2~20.9 g,上海斯莱克实验动物有限责任公司;纯化低脂饲料(含10%脂肪)、高脂饲料(含45%脂肪),江苏美迪森生物医药有限公司,饲料成分见表1。胰岛素检测试剂盒,美国R & D 公司;SYBRRGreen QPCR Master Mix,美国Roche 公司;cDNA 逆转录试剂盒,日本Takara 公司;PCR 引物由金斯瑞生物科技有限公司合成;其它试剂均为国产分析纯级。
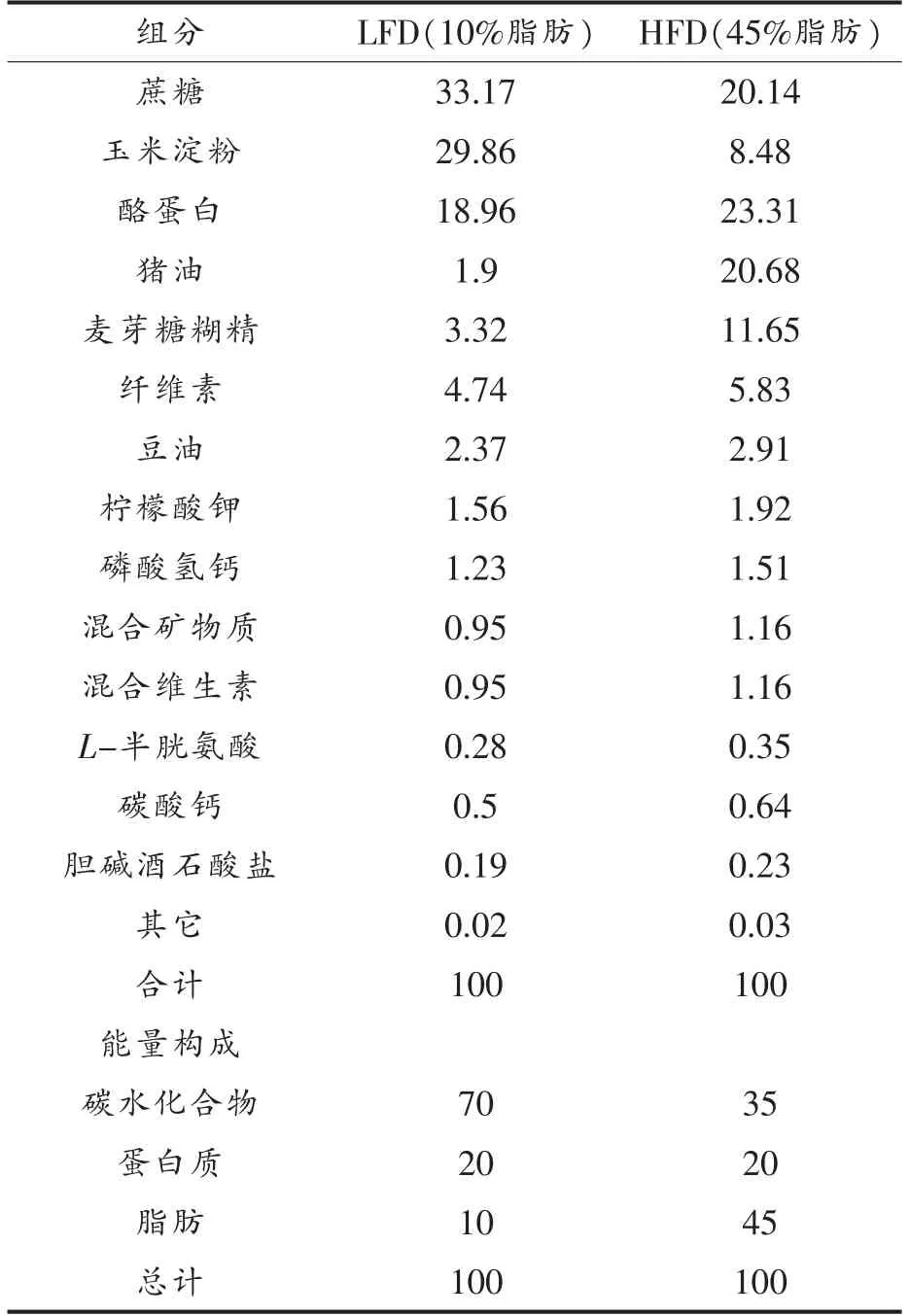
表1 饲料营养成分(%)Table 1 Ingredients of the purified diets (%)
1.2 主要仪器与设备
ACCUTE TBA-40FR 全自动生化分析仪,日本Toshiba 公司;Nanodrop 2000 核酸浓度测定仪,美国Thermo 公司;ABI 7500 system 实时荧光定量PCR 仪,美国ABI 公司。
1.3 实验方法
1.3.1 动物实验设计 C57BL/6J 小鼠在浙江大学动物实验中心喂养,饲养环境为12 h 光暗交替,环境温度为(23±3)℃,相对湿度为55%~60%。小鼠适应性喂养1 周后,将其随机分为3 组,每组10 只,组别分别设计为:低脂(LFD)对照组:饲喂含10%脂肪的低脂饲料;高脂(HFD)对照组:饲喂含45%脂肪的高脂饲料;樱桃花色苷(SWCN)处理组:饲喂含45%脂肪的高脂饲料,并每天给与小鼠灌胃樱桃花色苷,剂量为100 mg/kg。LFD 和HFD 组灌胃等量生理盐水。实验进行14 周,每周称量体重一次,实验期间小鼠自由进食和饮水,每3 d 记录一次摄食量和饮用水量。实验最后1 d 将小鼠禁食12 h 后称量体重,眼眶取血后将小鼠进行颈椎脱臼处死,快速摘取肝脏组织,液氮速冻后置于-80 ℃冰箱中保存。血液样品经2 500×g 离心15 min 后分离得到血清。
1.3.2 口服葡萄糖耐量实验 (Oral glucose tolerance test,OGTT) 在实验进行到第12 周时,每组随机选取6 只小鼠,禁食12 h 后给小鼠灌胃葡萄糖(2 g/kg),并分别在0,30,60,90,120 min 时通过尾静脉取血,以罗氏血糖仪测定血糖水平。应用Graphpad Prism 7.0 计算OGTT 曲线下面积(AUC)值。
1.3.3 胰岛素耐量实验 (insulin tolerance test,ITT) OGTT 实验完成3 d 后,每组随机选取6 只小鼠,禁食4 h 后通过腹腔注射胰岛素(0.5 U/kg),并分别在0,30,60,90,120 min 时通过尾静脉取血,测定血糖水平。应用Graphpad Prism 7.0 计算ITT 曲线下面积(AUC)值。
1.3.4 血清生化指标测定 血清葡萄糖含量利用东芝全自动生化分析仪进行测定,Elisa 法检测血清中胰岛素水平,并计算胰岛素抵抗指数(HOMA-IR)和胰岛素敏感指数(HOMA-IS),如式(1)和式(2)所示。


1.3.5 实时荧光定量PCR 检测肝脏中糖代谢相关基因的差异表达水平 采用Trizol 裂解法从肝脏中提取总RNA,并使用NanoDrop 2000 测定RNA 浓度和纯度。取1 μg RNA 利用逆转录试剂盒合成cDNA。采用SYBR Green QPCR Master Mix 在ABI 7500 PCR 仪进行实时荧光定量PCR。引物序列如下:IRS2 (正向):5′-GAG GACTTATTCCCTAACCACG-3′,IRS2 (反向):5′-GAGAGGCGACCTGAACTACC-3′[17];G6PC ( 正向):5′-TCAACCTCGTCTTCAAGTGGATT-3′,G6PC (反向):5′-GCTGTAGTAGTCGGTGTCCA GGA-3′[18];PEPCK (正向):5′-TGCGGATCATGA CTCGGATG-3′,PEPCK (反向):5′-AGGCC CAGTTGTTGACCAAA-3′[19]。
PCR 反应程序设置如下:50 ℃,3 min;95 ℃,10 min;95 ℃,15 s,60 ℃,60 s,持续31 个循环;95℃,60 s;50 ℃,20 s;95 ℃,20 s。以β-actin (正向:5′-GTGCTATGTTGCTCTAGACTTCG-3′,反向:5′-ATGCCACAGGATTCCATACC-3′) 为内参基因。各目标基因的相对表达量根据2-△△Ct计算方法计算得出。
1.3.6 统计分析 实验数据采用SPSS19.0 统计软件进行单因素方差分析(One-way ANOVA),用Duncan 多重比较进行组间差异分析,数据表示为“平均值±标准差”。P<0.05 表示差异显著。
2 结果
2.1 樱桃花色苷对小鼠体重及摄食量的影响
各组小鼠的初始体重不存在差异(图1a),经过14 周的高脂饮食诱导后,HFD 组小鼠体重增长(27.82±2.62)g,最终体重为(46.76±3.05)g,是LFD组小鼠体重(29.44±1.92)g 的1.59 倍,出现明显肥胖(图1b,1c)。与HFD 组相比,膳食樱桃花色苷处理组(SWCN)小鼠的体重(37.13±2.09)g 显著低于HFD 组(图1b)。此外,在HFD 组和SWCN 组之间不存在食物或热量摄入的差异(图1d,1e)。
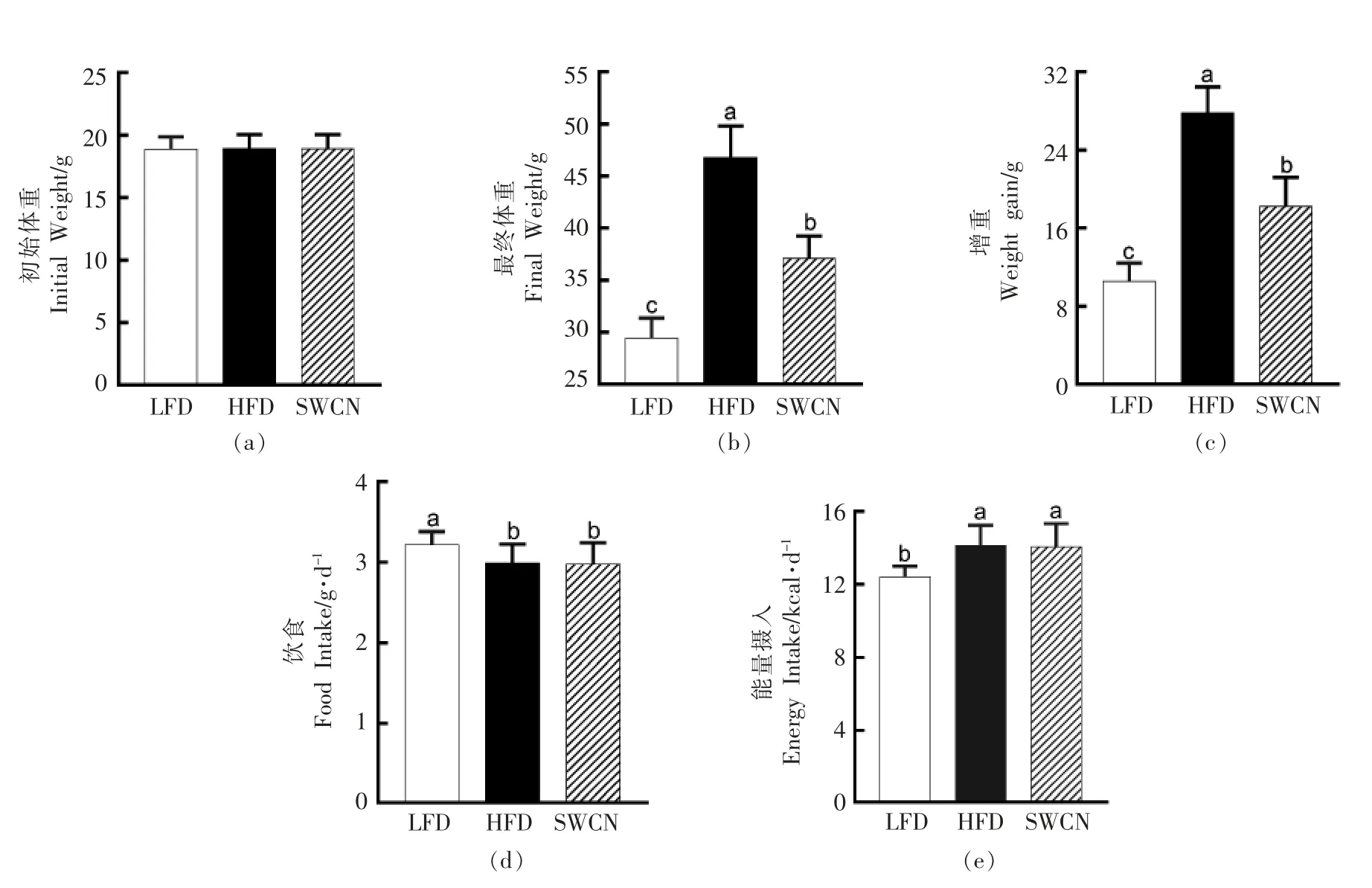
图1 樱桃花色苷对小鼠体重和摄食量的影响Fig.1 Effects of sweet cherry anthocyanins on the body weight and food intake of mice
2.2 樱桃花色苷对小鼠葡萄糖和胰岛素耐受性的影响
如图2a 所示,SWCN 组小鼠在0,60,90,120 min 的血糖水平显著高于LFD 组,低于HFD 组。SWCN 组AUC 值与HFD 组相比显著减小,然而没有恢复到LFD 组的水平(图2b)。如图2c 所示,SWCN 组小鼠在30,60,90,120 min 的血糖水平显著高于LFD 组,而低于HFD 组小鼠。SWCN 组AUC 值低于HFD 组,高于LFD 组 (图2d)。由OGTT 和ITT 结果可知SWCN 组小鼠的葡萄糖变化水平与恢复速度虽弱于LFD 组但明显优于HFD 组。

图2 樱桃花色苷对葡萄糖耐量和胰岛素耐量的影响Fig.2 Effects of sweet cherry anthocyanins on glucose tolerance and insulin tolerance
2.3 樱桃花色苷对肥胖小鼠空腹血糖、胰岛素、胰岛素敏感指数和胰岛素抵抗指数的影响
如图3所示,HFD 组与LFD 相比,小鼠空腹血糖、胰岛素水平和胰岛素抵抗指数显著升高,胰岛素敏感指数降低,而膳食樱桃花色苷能够显著降低高脂喂养小鼠的血糖、胰岛素水平和胰岛素抵抗指数,提高小鼠的胰岛素敏感指数。

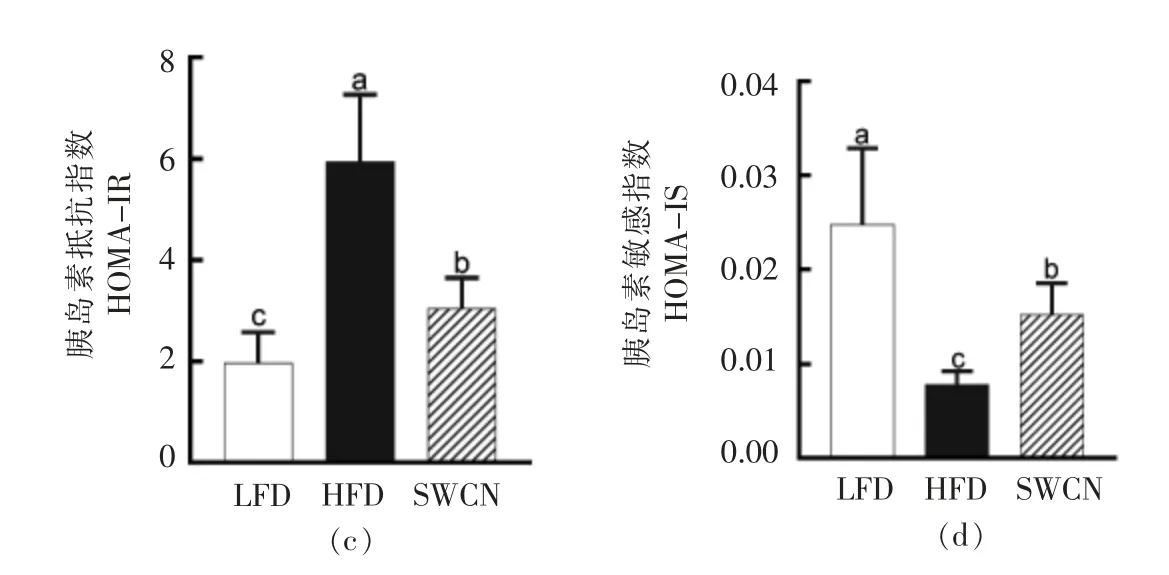
图3 樱桃花色苷对葡萄糖和胰岛素含量及胰岛素抵抗指数和敏感指数的影响Fig.3 Effects of SWCN on serum glucose and insulin,HOMA-IR and HOMA-IS
2.4 樱桃花色苷对小鼠糖代谢基因mRNA 表达的影响
与HFD 组相比,膳食SWCN 显著下调PEPCK 基因转录水平,是HFD 组小鼠的0.6 倍,LFD 组小鼠的1.4 倍 (图4a);HFD 组小鼠肝脏G6PC 转录水平明显上调,是低脂对照组小鼠的3.47 倍(图4b),膳食SWCN 后小鼠G6PC 基因的转录水平显著下降,是HFD 组小鼠的0.56 倍,是LFD 组小鼠1.96 倍;膳食SWCN 显著上调IRS2基因转录水平,是HFD 组小鼠的1.86 倍,是LFD组小鼠的0.67 倍(图4c)。
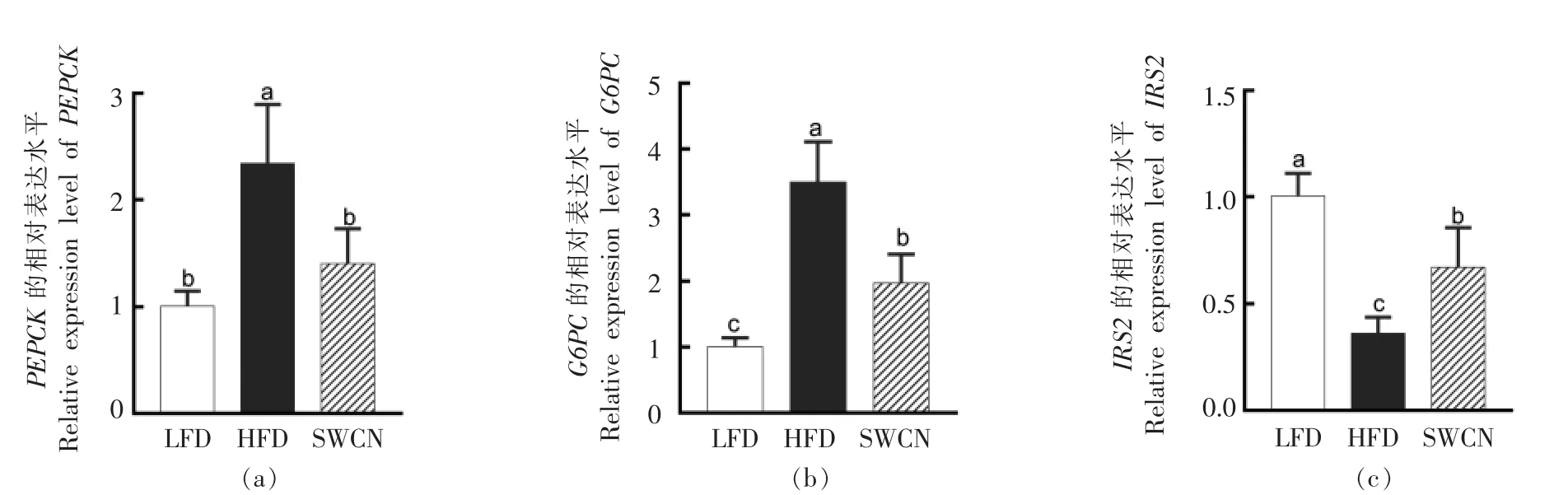
图4 樱桃花色苷对肝脏糖代谢基因表达的影响Fig.4 Effects of SWCN on the genes involved in glucose metabolism in livers
3 讨论
大量研究表明花色苷具有广泛的生物活性,如抗肿瘤、抗氧化、抗病毒和降脂等[6],然而关于樱桃花色苷是否具有降低血糖的生物功效尚存在分歧。本课题以高脂膳食诱导的肥胖小鼠为模型,研究樱桃花色苷对高血糖和胰岛素抵抗等肥胖并发症的改善作用,明确樱桃花色苷的糖代谢调节功能,并初步探明其作用机制。
机体内血糖的稳定是糖代谢处于动态平衡的结果。OGTT 是评估糖代谢功能的常用方法。口服葡萄糖后的血糖-时间变化曲线,依赖于肠道对葡萄糖的吸收率和肝脏对葡萄糖的代谢率。研究表明,糖尿病患者口服葡萄糖后,肝脏对葡萄的吸收利用率下降会导致大部分葡萄糖直接进入体循环,加之肝脏中葡萄糖的合成不能被抑制,OGTT响应值会大幅降低[20]。本实验结果显示,肥胖小鼠对血糖的响应程度较弱,而膳食SWCN 组小鼠对OGTT 响应度明显提升。本实验研究结果提示膳食SWCN 对肥胖小鼠的糖代谢紊乱具有显著的改善作用,且SWCN 对肝脏糖代谢功能具有重要意义。
胰岛素是由胰脏的胰岛β 细胞分泌的一种蛋白质激素,它能够促进全身组织细胞对葡萄糖的摄取和利用,促进糖原合成,抑制糖异生和糖原分解,使血糖降低,从而调节糖代谢,是机体内唯一能够降低血糖的激素。若外周组织细胞对胰岛素的敏感性下降,胰岛素信号传导途径发生障碍,机体就会出现胰岛素抵抗状态[21-22]。ITT 是一种简单、快速而又安全、可靠地评估胰岛素抵抗的方法。本实验通过给小鼠注射胰岛素后发现HFD 组小鼠的血糖水平对胰岛素的敏感性明显弱于LFD组,提示肥胖小鼠的胰岛素敏感性降低,呈现胰岛素抵抗状态。膳食SWCN 组小鼠的胰岛素响应水平虽弱于LFD 组,但已显著强于HFD 组。空腹胰岛素水平、胰岛素抵抗指数和胰岛素敏感指数也是评价胰岛素抵抗水平的重要指标。本研究结果表明,与HFD 组小鼠相比,膳食SWCN 组小鼠的胰岛素水平和胰岛素抵抗指数显著降低,胰岛素敏感指数显著上升。该研究结果提示膳食SWCN能够改善肥胖小鼠的胰岛素抵抗状态,提高其胰岛素敏感性。
肝脏是调节血糖的主要器官。当血糖浓度升高时,肝脏能够利用血糖合成糖原(肝糖原约占肝重的5%),同时肝脏能够将过多的血糖转变为脂肪,以及通过加速磷酸戊糖循环等,来提高葡萄糖的利用度,维持血糖浓度的稳定。当血糖浓度降低时,肝脏通过分解肝糖原,加强糖异生作用生成葡萄糖,从而提高血糖浓度,其中糖异生途径是肝脏补充葡萄糖或恢复糖原含量的重要途径[23-24]。糖异生(Gluconeogenesis)是指非糖类前体物质,如甘油、乳酸、糖氨基酸和烯丙醇等转变为葡萄糖或糖原的过程。体内近一半葡萄糖的消耗和主要器官的能量供应都依赖于糖异生作用。G6PC 和PEPCK 是糖异生途径的关键酶[25]。
G6PC 特异性存在于肝脏组织中,主要分布在肝细胞内质网膜上。G6PC 主要功能结构为转运亚基P46 和催化亚基P36。P46 为葡萄糖-6-磷酸的特异转运体,能够将胞浆中的葡萄糖-6-磷酸转运至内质网;P36 为非特异性磷酸水解酶,能够将葡萄糖-6-磷酸水解为磷酸和葡萄糖[26-27]。由此可见,G6PC 在水解葡萄糖-6-磷酸为葡萄糖的过程中发挥主要作用,其在肝脏组织中的表达量及活性的变化将直接影响肝脏内葡萄糖的产生。PEPCK 是催化糖异生第一步反应的关键酶,与血糖控制有直接的相关性。抑制PEPCK 的表达能够增强肝脏、肌肉及脂肪组织胰岛素信号转导水平,下调肝脏糖异生通路中关键基因FoxO1、HNF4α 和PGC-1α 的表达及G6PC 的转录,从而极大改善高血糖和高胰岛素血症[28]。本实验研究结果发现肥胖小鼠肝脏中PEPCK 和G6PC 的基因转录水平显著上升,该结果提示肥胖小鼠的糖异生作用加强,葡萄糖的合成量增加,这可能是导致血糖浓度升高与胰岛素抵抗的机制之一。与HFD 组小鼠相比,SWCN 组小鼠的PEPCK 和G6PC 的基因转录水平显著降低,该结果表明SWCN 能够下调糖异生关键基因的转录,从而抑制糖异生途径。IRS2是胰岛素信号转导通路中的重要信号蛋白。IRS2在肝脏内特异性高表达,其表达量在外源干涉下的变化较为显著。IRS2 能够有效促进肝糖原合成以及抑制肝脏中葡萄糖的转运,其功能异常会诱发胰岛素抵抗(主要是肝脏胰岛素抵抗),并减弱肝脏对葡萄糖转运的抑制作用,导致机体的糖代谢障碍[29-30]。与前述研究结果一致,本实验研究结果发现肥胖小鼠肝脏中IRS2 的基因转录水平与LFD 组相比显著下降,并伴随发生胰岛素抵抗,而膳食SWCN 可以促进肝IRS2 基因的转录表达,从而改善胰岛素抵抗,降低血糖。
4 结论
樱桃花色苷通过上调肝脏胰岛素信号通路中IRS2 的表达,来促进肝脏对葡萄糖的摄取和利用,同时通过抑制PEPCK 和G6PC 的转录水平来减少糖异生,从而降低肥胖小鼠的血糖及胰岛素的含量水平,增强其糖耐量和胰岛素敏感性,改善胰岛素抵抗状态。本研究阐明了樱桃花色苷的降糖活性,为樱桃作为降糖和预防胰岛素抵抗的功能性农产品的开发和深加工及樱桃产业链的延伸,提高樱桃产业的附加值,提供了理论基础。
