牛蒡多糖与绿原酸对斑马鱼氧化损伤的协同抗氧化作用
2022-05-25朱文卿朱姗姗何秋霞郑振佳
朱文卿,朱姗姗,何秋霞,郑振佳*
(1 山东农业大学食品科学与工程学院 山东省高校食品加工技术与质量控制重点实验室 山东 泰安 271018 2 齐鲁工业大学(山东省科学院)生物研究所 济南 250103)
多糖作为天然高分子物质,常被用于结合活性物质以改善食品的质地、可加工性和稳定性等,也被用作稳定剂、药物载体和某些疾病的辅助治疗剂[3]。将多糖与活性物质结合制备复合物,不仅能够实现目标组分的靶向递送,而且有助于活性成分发挥协同作用。常见的菊糖、葡聚糖、果胶、变性淀粉等多糖可与黄酮、单宁等多酚类构建复合物,发挥协同降血糖、抗菌和改善肠道环境的作用[4-5]。然而,目前多糖与多酚协同发挥抗氧化作用的研究报道较少。研究多糖与多酚的协同抗氧化作用,有针对性地探究科学配比,是获取新型抗氧化剂的重要方法。
牛蒡中含有丰富的多糖和多酚。牛蒡多糖中含量较高的是菊糖,约占牛蒡干重的34%[6-7]。菊糖为线性直链结构,主要由12 个呋喃型的果糖以β-2,1-糖苷键相连[8]。研究表明牛蒡多糖具有抗氧化,降血糖,免疫调节等多种生理功能,且易于制备,安全性和稳定性良好,在食品及医药领域有广泛的应用前景[9-11]。牛蒡中多酚类物质主要为咖啡酰奎宁酸类,包括咖啡酸、绿原酸和异绿原酸等[12],其中绿原酸含量较高[13],该成分具有良好的抗氧化,抗菌、消炎、抗病毒、降血糖、降血压等多种生物活性,在食品和医药方面应用广泛[14]。
基于牛蒡多糖与绿原酸均具有良好的体内抗氧化作用,本研究推测两者复合后可能有体内协同抗氧化的作用,并进行验证。研究通过构建斑马鱼氧化损伤模型,筛选体内协同抗氧化作用最强的牛蒡多糖-绿原酸复合物比例,并对该复合物进行结构表征与体内、外抗氧化活性评价。
1 材料与方法
1.1 材料与试剂
材料:牛蒡,江苏沛县轶伟食品有限公司;绿原酸,成都曼斯特生物科技有限公司;转基因皮肤荧光斑马鱼CY17(krt4-NTR:GFP),山东省科学院生物研究所。
试剂:氯仿、正丁醇、无水乙醇,天津凯通化学试剂有限公司;甲硝唑,上海阿拉丁生化科技股份有限公司;1,1-二苯基-2-苦基肼自由基(DPPH),梯希爱 (上海) 化成工业发展有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸二胺盐(ABTS)、水杨酸,源叶生物科技有限公司;过硫酸钾、硫酸亚铁,国药集团化学试剂有限公司;Tris-HCl 缓冲液,鼎国昌盛生物技术有限责任公司;邻苯三酚,索莱宝科技有限公司;BCA 蛋白浓度测定试剂盒,碧云天生物技术有限公司;SOD 测试盒、CAT 测试盒、MDA 测试盒,南京建成生物工程研究所。
1.2 仪器与设备
Olympus IX53 显微镜,日本Olympus 公司;Centrifuge 5804R 冷冻离心机,Eppendorf 德国专业生命科学公司;HPG-280BX 恒温培养箱,哈尔滨市东联电子技术开发有限公司;SPECTRO star Nano 全波长酶标仪,广州伯齐生物科技有限公司;UV2450 分光光度计,日本岛津公司;Nicolet iS 10 傅里叶变换红外光谱,美国赛默飞世尔科技公司;Zetasizer-Nano-ZS 激光纳米粒度仪,英国马尔文公司;SUPRATM55 扫描电子显微镜,德国蔡司公司;EMPYREAN 锐影X 射线衍射仪,荷兰帕纳科公司。
1.3 方法
1.3.1 牛蒡多糖-绿原酸复合物体内协同抗氧化的最佳比例筛选 通过构建甲硝唑诱导的斑马鱼CY17氧化损伤模型,筛选复合物协同抗氧化作用最强的组合比例。
首先,目前高校和包括社区在内的行政部门在推进创新创业过程中更多在扮演“独角戏”的角色,教师和学生却因为激励机制不足而参与度不高。其次,在调度各方创新创业积极性上存在制度性壁垒,创新创业生态链条上针对各方的协同机制不健全。最后,目前多以政策驱动等外在因素为主导,各方内生动力不足,没有形成适合创新创业的整体生态文化。
样品处理:牛蒡多糖的制备参考并改进Li等[15]的方法。以甲硝唑溶液(5 mmol/L)为溶剂,按照牛蒡多糖∶绿原酸(g∶g)为1∶0,3∶1,1∶1,1∶3,0∶1 的比例配制不同质量浓度(1,10,50,100 μg/mL)的样液。
斑马鱼氧化损伤模型的构建:斑马鱼的养殖参考并改进Westerfield 等[16]的方法,选择成熟的斑马鱼CY17,按照雄鱼∶雌鱼为3∶2 或者2∶2 的比例放入繁殖缸内,次日清晨收集受精卵,于28 ℃培养箱中培养24 h。24 h 后,将受精卵脱去外层卵膜,按照15 个胚胎/孔加入24 孔板中,分别在2 mL 甲硝唑溶液(5 mmol/L)、养殖水以及不同质量浓度的样液(1,10,50,100 μg/mL)中孵育。维生素C(200 μmol/L)为阳性对照。孵育24 h,用质量分数0.1%的三卡因溶液将斑马鱼胚胎麻醉,然后利用显微镜观察并拍照。利用Image Pro-Plus 软件对斑马鱼的荧光细胞数进行计数,并用GraphPad Prism 8 软件绘图。根据荧光细胞数最多的样品,确定复合物的最佳比例。
1.3.2 牛蒡多糖-绿原酸复合物的制备 首先将300 mg 多糖溶解于50 mL 去离子水中,溶解完全后,于10 000 r/min 下离心10 min,取多糖上清液。根据最佳比例,加入绿原酸水溶液。混合均匀后,于10 000 r/min 下离心10 min,上清液即为牛蒡多糖-绿原酸复合物分散液,冷冻干燥后得复合物粉末。
1.3.3 结构表征
1.3.3.1 紫外光谱 使用全波长紫外-可见光分光光度计对样品进行全波长扫描,波长范围为200~900 nm。
1.3.3.2 傅里叶变换红外光谱 通过傅里叶变换红外光谱分析样品,在4 000~500 cm-1波长范围内进行扫描分析,扫描次数64 次,分辨率4 cm-1。
1.3.3.3 粒径 采用激光纳米粒度分析仪测量样品的粒径大小,设定散射角为90°,折光指数1.330,测定温度25 ℃,保温2.0 min[17]。
1.3.3.4 Zeta 电位 Zeta 电位样品质量浓度为1 mg/mL,测量温度25 ℃,折射率设置为1.330[18]。
1.3.3.5 形貌观察 采用扫描电子显微镜观察样品的微观形态。将测试样品粘在扫描电镜观察台上,用溅射仪在真空条件下对样品喷金。扫描电镜图像是在加速度电压5 kV,放大倍数500 的条件下得到的[19]。
1.3.3.6 X-射线衍射分析 X-射线衍射仪配备Cu 靶陶瓷X 光管,加速电压40 kV,电流40 mA,在2θ=5°~80°范围内,测定样品的X 射线衍射强度[20]。
1.3.4 体内抗氧化活性评价 为比较多糖、复合物、绿原酸在斑马鱼体内的抗氧化酶水平,测定了三者的总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和丙二醛(MDA)活力。斑马鱼的养殖和孵育同1.3.1 节方法,孵育24 h,清洗幼鱼3 次,吸干水分,收集并称重。根据斑马鱼∶生理盐水(g∶mL)=1∶9 的比例加入生理盐水,破碎。之后,匀浆在3 000 r/min,4 ℃下离心20 min,取上清。分别按照T-SOD、CAT、MDA 试剂盒说明书方法测定上清中T-SOD、CAT 与MDA 活力。
1.3.5 体外抗氧化活性评价 研究了多糖、复合物和绿原酸的体外抗氧化能力,测定了三者的DPPH、ABTS+、OH-、O2-自由基清除率。DPPH 自由基清除率的测定参考Tan 等[21]的方法,ABTS+自由基清除率按Huang 等[22]方法测定,OH-自由基清除率的测定参考并改进Sun 等[23]的方法,O2-自由基清除率的测定参考并改进Wu 等[24]的方法。
1.4 数据分析
所有数据均为至少3 次测量的“平均值±标准差”。使用Origin 2018 和GraphPad Prism 8 软件绘图,并进行差异性分析(*P<0.05,**P<0.01)。
2 结果与分析
2.1 复合物最佳组合比例的筛选
斑马鱼CY17是将荧光蛋白标记在角质细胞上,荧光显微镜下可观察到斑马鱼的皮肤上显示许多绿色的荧光亮斑点,其最外层鱼皮对外部刺激非常敏感,添加甲硝唑后引起皮肤表层细胞凋亡,使荧光斑点消失。当添加抗氧化物质后,表皮细胞的损伤程度有所降低,荧光斑点数目会恢复,即荧光细胞数量增加[25]。图1显示了不同样品处理后斑马鱼CY17的荧光细胞数。从图中可以看出,空白组荧光细胞数约270 个,模型组显著降低至约50 个,表明甲硝唑成功诱导斑马鱼表皮细胞减少,荧光细胞数量降低。与预期的一样,样品组的斑马鱼荧光细胞数较模型组均有不同程度的恢复,各样品均表现出良好的抗氧化能力。在低质量浓度时(1,10 μg/mL)3 种不同比例的复合物荧光细胞数虽高于绿原酸,但稍低于多糖,表明低质量浓度限制了复合物体内协同抗氧化作用的发挥。在高质量浓度下(50,100 μg/mL),当牛蒡多糖与绿原酸的比例为1∶1 和1∶3 时,复合物荧光细胞数明显多于2 种单体,表明2 种比例的复合物在高浓度条件下产生了增强的抗氧化效果。尤其当复合物比例为1∶3 时,协同抗氧化效果更强,因此确定复合物的最佳比例为牛蒡多糖∶绿原酸(g∶g)=1∶3,后续用于结构表征与抗氧化活性评价。

图1 不同样品处理后斑马鱼的皮肤荧光细胞数(n=15)Fig.1 The fluorescent cell count in zebrafish treated with different samples (n=15)
2.2 结构表征分析
2.2.1 紫外光谱结果 牛蒡多糖、复合物与绿原酸的紫外光谱如图2所示,可以观察到牛蒡多糖在260~280 nm 波长范围内没有吸收峰,证明牛蒡多糖中几乎不含核酸和蛋白质。绿原酸属于酚类物质,含有苯环、双键、羰基等不饱和结构,在219 nm 和323 nm 波长处有紫外吸收峰[26]。复合物在波长219 nm 和323 nm 处出现了与绿原酸一致的吸收峰,表明复合过程中多糖与绿原酸没有形成新的双键。

图2 多糖、复合物和绿原酸的紫外光谱图Fig.2 Ultraviolet spectra of polysaccharide,complex and chlorogenic acid
2.2.2 粒径与Zeta 电位结果 多糖、复合物与绿原酸的粒径大小如图3a 所示。多糖的平均粒径约为160~170 nm,而复合物与绿原酸的平均粒径约为50~60 nm。显然,复合物的粒径显著减小,说明多糖和绿原酸成功复合在一起使得粒径减小。Zeta 电位可以度量颗粒在水系中相互吸引或相互排斥的强度,Zeta 电位的绝对值越高,体系越稳定,粒子越不容易聚集[27]。如图3b 所示,多糖、复合物和绿原酸的Zeta 电位分别为 (-15.23±0.47)mV,(-6.36±0.80)mV 和(-4.44±0.05)mV。可以看出牛蒡多糖与绿原酸均带负电荷,可能由于它们含有丰富的羟基[28],这有助于两者之间形成氢键,且复合物的Zeta 电位绝对值高于绿原酸,表明复合物的形成可以提高绿原酸的稳定性[29]。

图3 多糖、复合物和绿原酸的粒径图(a)与Zeta 电位图(b)Fig.3 Particle size(a),Zeta potentials(b) of polysaccharide,complex and chlorogenic acid
2.2.3 傅里叶变换红外光谱结果 图4表征了多糖、复合物与绿原酸在4 000~500 cm-1频率范围内的红外光谱。多糖在3 310 cm-1处出现羟基的伸缩振动峰,说明存在分子间氢键[30]。在2 930 cm-1和2 880 cm-1处出现-CH、-CH2和-CH3基团的C-H伸缩振动峰[31],1 030 cm-1处对应吡喃糖环C-O-C的伸缩和变角振动峰[32]。绿原酸具有酚羟基(3 469,3 324 cm-1)、亚甲基(2 960 cm-1)、羰基(1 683 cm-1)、苯环(1 596,1 515 cm-1)的典型吸收峰[26]。复合物形成后,羟基峰发生明显移动,移至3 674,3 391 cm-1处,这两处分别对应游离羟基峰与羟基形成氢键的缔合峰,这表明多糖与绿原酸之间形成了氢键[33]。C-H 伸缩振动峰由2 930,2 880 cm-1分别移至2 984,2 898 cm-1,且吸收强度明显增强,也表明多糖与绿原酸之间发生了强烈的氢键反应[34]。在2 000~500 cm-1区域内,复合物虽保留了多糖与绿原酸的某些特征吸收峰,但峰强度和位置有所改变,表明多糖与绿原酸产生了相互作用,而复合物在扫描范围内没有出现新的吸收峰,说明复合物的形成并没有生成新的双键[35],这也符合紫外光谱的测定结果。因此推断复合物的形成主要是氢键作用的结果。

图4 多糖、复合物和绿原酸的红外光谱图Fig.4 Infrared spectra of polysaccharide,complex and chlorogenic acid
2.2.4 X 射线衍射分析 如图5所示,X-射线衍射图谱显示了复合物的结晶状态。一般来讲,晶体表现为尖而窄的特征峰,而非晶态物质表现为宽而弥散的衍射峰[36]。多糖与绿原酸复合后在2θ 为6.27°和18.54°处出现了较宽的衍射峰,表明复合物具有一定的结晶特性,然而结晶度较低,以一种无定形状态存在[37]。Liu 等[38]也观察到了类似的结果,即将多酚接枝到多糖上导致了非晶态结构的增加。

图5 复合物的X-射线衍射图谱Fig.5 X-ray diffraction pattern of complex
2.2.5 扫描电镜分析 图6显示了500 倍数下多糖和复合物的扫描电镜图像。可以观察到多糖结构较为松散,具有许多孔隙,而多糖与绿原酸复合后孔隙消失,呈现出大小不一、棱角分明、质地相对密实的无定型片状结构,这与XRD 分析得出的“复合物以一种无定形状态存在” 的结论一致,也证实了多糖与绿原酸之间具有较强的相互作用力,成功地复合在一起。

图6 多糖(a)与复合物(b)的扫描电镜图(500×)Fig.6 Scanning electron microscope images of polysaccharide (a) and complex (b) (500×)
2.3 体内抗氧化酶活力测定
SOD 可以清除活性氧自由基,能够将超氧自由基转换为氧气和过氧化物,进而对机体起到保护作用[39]。CAT 可以催化生物体内的H2O2发生反应,使其转化为分子氧和水,可保护机体免受H2O2诱导的氧化损伤[40]。如图7a 和7b 所示,T-SOD 活力与CAT 活力遵循一样的趋势。模型组的T-SOD活力、CAT 活力较空白组均显著降低,表明甲硝唑对机体造成了氧化损伤,而加入各样品后,T-SOD与CAT 活力均表现出不同程度的增强,表明机体的氧化损伤得到缓解。尤其是复合物的T-SOD、CAT 活力更高,表明其具有更强的体内抗氧化作用。MDA 反映了机体内脂质过氧化的程度,含量越高,表明机体的氧化损伤越严重。图7c 为MDA含量测定结果。与空白组相比,模型组的MDA 含量显著升高,证实了甲硝唑对斑马鱼造成了严重的氧化损伤。样品处理后,与预期结果一样,复合物的3 种浓度的MDA 含量均呈极显著下降趋势,说明复合物降低氧化损伤的能力更强。上述数据证实牛蒡多糖-绿原酸复合物可以有效增加机体中T-SOD 与CAT 活力并降低MDA 含量,进而抑制机体的氧化损伤。

图7 不同样品处理后的斑马鱼体内T-SOD(a)、CAT(b)、MDA(c)活力Fig.7 T-SOD (a),CAT (b),MDA (c) activity of zebrafish exposed to different samples
2.4 体外抗氧化活性评价
图8a 和8b 分别为各样品对DPPH 和ABTS+自由基的清除能力。可以观察到复合物和绿原酸对两种自由基的清除率呈现相似的趋势,复合物的最高清除率与绿原酸十分接近。经过计算,复合物和绿原酸清除DPPH 自由基、ABTS+自由基的IC50分别为0.095,0.087 mg/mL 和0.35,0.28 mg/mL,表明复合物清除DPPH 和ABTS+自由基的能力与绿原酸相当。而多糖的DPPH 自由基清除能力有所下降,约从10%增至70%;对ABTS+自由基的清除能力显著降低,仅为10%左右。图8c 和8d分别显示了各样品对OH-和O2-自由基的清除率。复合物对两种自由基的清除率均稍低于绿原酸而明显强于多糖。经计算,复合物和绿原酸清除OH-自由基、O2-自由基的IC50分别为1.06,0.86 mg/mL和0.73,0.54 mg/mL,表明复合物清除OH-和O2-自由基的能力稍弱于绿原酸。而多糖对两种自由基的清除能力均较低,清除率仅为15%~20%左右,且与浓度无明显关联。综上所述,复合物的体外抗氧化能力显著优于多糖,且与绿原酸较为接近。
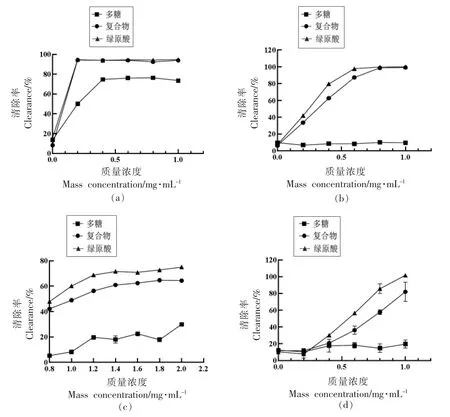
图8 不同样品的DPPH(a)、ABTS+(b)、OH-(c)、O2-(d)自由基清除率Fig.8 DPPH (a)、ABTS+ (b)、OH- (c)、O2- (d) free radical clearance rate of different samples
3 结论
本研究通过构建斑马鱼氧化损伤模型,筛选了体内协同抗氧化作用最佳的牛蒡多糖-绿原酸复合物比例,制备了牛蒡多糖-绿原酸复合物,并对其进行结构表征及体内、外抗氧化活性评价。斑马鱼的氧化损伤模型结果表明,牛蒡多糖-绿原酸复合物发挥协同抗氧化的最佳比例为多糖∶绿原酸=1∶3。该比例下的复合物平均粒径约为50~60 nm,Zeta 电位为(-6.36±0.80)mV。红外光谱和扫描电镜结果显示多糖与绿原酸之间形成了质地紧密的无定形片状结构,氢键可能是复合物形成的主要作用力。此外,复合物可以显著提高机体的T-SOD 活力和CAT 活力,降低MDA 含量,有效抑制机体的氧化损伤,且具有良好的清除DPPH、ABTS+、OH-、O2-自由基的能力。以上研究表明牛蒡多糖-绿原酸复合物可以作为一种新型抗氧化剂协同发挥抗氧化作用,为抗氧化产品的研发提供理论支撑和技术支持。
