雌二醇对绵羊输卵管上皮细胞pik3r3、Akt、mapk3基因mRNA 及蛋白表达的影响
2022-05-25李秀男曹贵方乌达巴拉何亭漪李彩新杨燕燕
李秀男,曹贵方,乌达巴拉,田 瑛,何亭漪,李彩新,杨燕燕
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018;3.内蒙古赤峰市喀喇沁旗河北街道管理办公室,内蒙古 赤峰 024400)
输卵管作为生殖系统的重要组成部分, 是配子运输、受精和早期胚胎发育的场所,在生殖过程中的功能越来越受到重视。 输卵管炎是一种由多种病原微生物感染引起的生殖道疾病, 可造成黏膜损伤和免疫功能失调,导致雌性动物生产、生殖能力下降以及引发恶性肿瘤等。 现已有大量研究显示雌激素对生殖道炎症损伤起到保护作用,并能够介导输卵管上皮内淋巴细胞的过度增殖[1-2]。
雌激素在不同组织器官中具有多种作用,大多依赖雌激素受体α、 雌激素受体β 和G 蛋白偶联受体激活细胞内各种信号通路, 主要包括MAPK 通路、PI3K/AKT 通路、Notch 通路等[3-5],而pik3r3、Akt、mapk3 作为PI3K/AKT、MAPK 通路上的主要调控因子,对细胞的生长、生存和增殖分化都具有调控作用[6-10]。 然而对于雌激素能否调节pik3r3、Akt、mapk3 的表达尚不甚了解, 需要进一步研究。 该试验通过qPCR 和蛋白质印记法研究雌二醇对输卵管上皮细胞中pik3r3、Akt、mapk3 基因mRNA 及蛋白表达的影响,进一步探究pik3r3、Akt、mapk3 在输卵管组织中的生理作用。
1 材料与方法
1.1 试验材料
1.1.1 主要材料
绵羊输卵管组织在内蒙古自治区呼和浩特市托克托县永圣域试验基地获取,保存在37 ℃生理盐水中带回实验室。
1.1.2 主要试剂
Anti -PIK3R3 rabbit polyclonal antibody(D261373)、Anti-MAPK3 rabbit polyclonal antibody(D260316)、Anti-GAPDH rabbit polyclonal antibody(D110016),购自生工生物工程(上海)股份有限公司;Rabbit Anti-AKT1/2/3 antibody(bs10724R),购自北京博奥森生物技术有限公司; 青霉素、 链霉素、DMEM/F12 培养基, 美国Gibco 公司产品;胰蛋白酶、乙二胺四乙酸(EDTA),美国Amresco 公司产品;胎牛血清,美国Hyclone 公司产品;反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser、 荧 光 定 量 酶SYBR Premix Ex TaqTMKit、RNA 提取试剂盒RNA fast 200, 购自上海飞捷生物科技有限公司;哺乳动物蛋白抽提试剂盒,购自康维世纪生物有限公司;BCA 蛋白浓度测定试剂盒(P0010S),购自上海碧云天生物技术有限公司;雌二醇,美国Sigma 公司产品。
1.2 试验方法
1.2.1 绵羊输卵管上皮细胞的培养
将绵羊输卵管带回实验室后,挑选出健康的输卵管,用眼科剪和眼科镊剔除输卵管多余脂肪组织。 用含有1%双抗的无菌DPBS 缓冲液冲洗输卵管2~3 次, 然后用眼科剪沿输卵管一侧纵向剪开,露出输卵管内膜,再用含有1%双抗的无菌DPBS 缓冲液冲洗2~3 次后,将输卵管放入经高压灭菌的5 mL 离心管, 并向离心管内加入1.5 mL 0.25%的胰蛋白酶, 放入细胞培养箱消化5~10 min。消化后,将离心管内的输卵管和胰蛋白酶一同倒入含有完全培养基的培养皿,然后用无菌细胞刮刀轻轻刮取输卵管内膜, 使内膜上皮细胞脱落, 用1 mL 移液器反复吹打培养基直至将上皮细胞团吹散成为单细胞悬液。 将吹散的细胞悬液移入无菌的5 mL 离心管, 放入水平离心机1 300 r/min 离心5 min, 离心后弃去上清液,加入DPBS 缓冲液,吹打成单细胞悬液,然后再次进行离心,反复冲洗2~3 次,冲洗干净后,彻底去除上清液, 加入1 mL 含有10%血清的完全培养基,吹打成单细胞悬液, 按1×105个/mL 的细胞浓度,传代于细胞培养瓶,37 ℃、5%CO2培养,每2 d 换液1 次。
当原代细胞在培养瓶内汇合达到80%左右时,吸出培养瓶内完全培养基,并用DPBS 缓冲液冲洗细胞2~3 次, 然后加入1.5 mL 0.25%的胰蛋白酶,放置于培养箱内消化5~7 min,当细胞大部分变成圆形时,加入3 mL 完全培养基并反复吹打培养瓶内的贴壁细胞,直至变成单细胞悬液后,放入水平离心机1 300 r/min,离心5 min,弃去上清液,反复冲洗2~3 次后,直至上清液澄清,彻底移除上清液,加入完全培养基,将细胞吹散至单细胞悬液,按1×106个/mL 的细胞浓度接种于细胞培养瓶或者6 孔板内,进行传代培养。
1.2.2 雌二醇对输卵管上皮细胞pik3r3、Akt、mapk3 基因mRNA 表达量的影响
1.2.2.1 引物的设计与合成
同理,如果基层工作也免除了那无事忙的“五怕”,有点抵制“痕迹主义”的自由,少点瞎折腾,我们的中国梦是不是也能早点实现?
依据美国国立生物技术信息中心 (NCBI)中GenBank 公布的绵羊pik3r3、Akt、mapk3 基因以及绵羊管家基因β-肌动蛋白基因(β-Actin)序列,使用Primer 6.0 软件设计所需引物,并交由北京六合华大基因科技股份有限公司合成PAGE 级别纯化引物。 引物信息见表1。
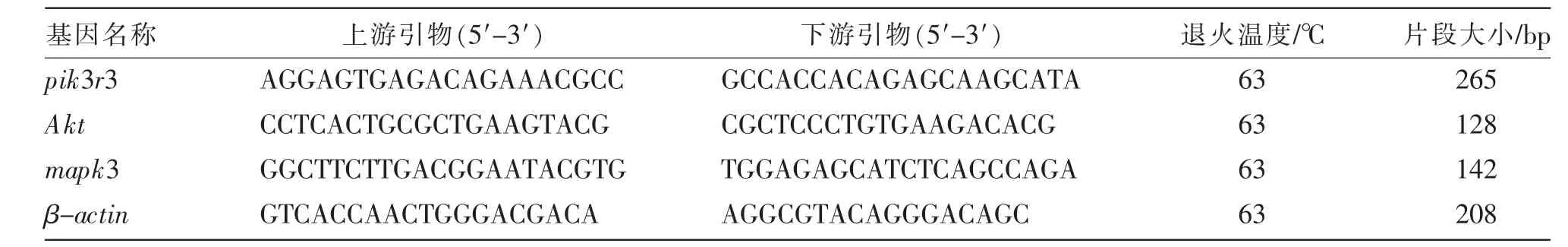
表1 引物信息
1.2.2.2 RNA 提取、RT-PCR 及qPCR
按照RNA fast 200 总RNA 极速提取试剂盒说明进行总RNA 提取。 并按照PrimeScriptTMRT reagent Kit with gDNA Eraser 说明书将总RNA 反转录为cDNA,-20 ℃保存, 用于后续常规PCR 和荧光定量PCR。
20 μL RT-q PCR 反应体系:2×SYBR Premix Ex Taq 10 μL,上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,cDNA 模板2 μL,ddH2O 7 μL。 根据引物退火温度,确定qPCR 反应条件:95℃30 s,95 ℃10 s,63 ℃30 s,72 ℃10 s,40 个 循环;分别在65~95 ℃以0.5 ℃为1 个单位采集荧光信号,绘制熔解曲线。
1.2.2.3 雌二醇对输卵管上皮细胞pik3r3、Akt、mapk3 基因mRNA 表达的影响
对绵羊输卵管上皮细胞进行12 h 饥饿处理后添加10-8mol/L 的雌二醇,体外刺激细胞0、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 h,并以等量培养基替代雌二醇作为对照组(Control 组)。 在各时间点提取细胞总RNA, 通过qPCR 反应检测pik3r3、Akt、mapk3 表达量的变化,每组重复3 次。
1.2.3 雌二醇对输卵管上皮细胞pik3r3、Akt、mapk3 蛋白表达的影响
根据康维世纪生物有限公司哺乳动物蛋白抽提试剂盒进行总蛋白提取,根据碧云天BCA 蛋白浓度测定试剂盒(P0010S)说明书进行蛋白质浓度测定。
1.2.3.2 蛋白质的Western blot 分析
将同一次体外培养的原代细胞进行消化后,充分吹打后使其成为细胞悬液, 然后接种到6 孔板内培养,每隔1 d 进行1 次换液,直至细胞生长到6 孔板90%左右时,充分吸出完全培养基后,加入不含血清的F12 培养基,细胞饥饿处理12 h。添加10-8mol/L 雌二醇, 体外刺激细胞1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 h,并将不含雌二醇、其余成分均与试验组相同的培养基培养的细胞作为对照组。 然后,进行细胞总蛋白的提取,经Western blot 检测添加雌二醇后细胞质内pik3r3、Akt、mapk3 蛋白表达水平的变化。
1.2.4 统计学方法
利用SPSS 22.0 软件对试验数据进行统计学分析,多组比较采用单因素方差分析。
2 结果与分析
2.1 雌二醇对输卵管上皮细胞pik3r3、Akt、mapk3 基因mRNA 表达量的影响
为了检测引物的特异性和qPCR 产物的特异性和数据的真实性, 对绵羊输卵管上皮细胞内pik3r3、Akt、mapk3 基 因 的qPCR 反 应 产 物 进 行2%琼脂糖凝胶电泳检测。 如图1 所示,pik3r3、Akt、mapk3 与β-actin 基因具有清晰、单一的产物条带,所在位置在引物预期片段大小附近,空白对照无扩增产物条带, 说明各基因引物特异性高,qPCR 产物符合要求,数据结果真实有效,可以进行下一步分析实验。
对绵羊输卵管上皮细胞体外添加10-8mol/L的雌二醇,通过实时荧光定量技术对pik3r3、Akt、mapk3 表达量进行检测, 随着时间不断延长,3 种基因表达量的变化如图2 所示: 随着雌二醇作用时间的延长,3 种基因的表达量整体呈先升高、后降低趋势;pik3r3 表达量在雌二醇作用1.5 h 时达到最高峰,与0 h 相比差异极显著(P<0.01);Akt、mapk3 表达量在雌二醇作用2.5 h 时达到最高峰,与0 h 相比差异极显著(P<0.01)。 雌二醇作用3 h时,pik3r3、Akt、mapk3 表达量相比0 h 都有显著(P<0.05)提高,4 h 后表达量与0 h 无明显差异。 根据该结果可以确定后续研究雌二醇对细胞内pik3r3、Akt、mapk3 蛋白表达量影响的作用时间长度为0~4 h。
2.2 雌二醇对细胞内pik3r3、Akt、mapk3 蛋白表达量的影响
对绵羊输卵管上皮细胞体外添加10-8mol/L的雌二醇,提取各时间段细胞总蛋白,利用Western blot 技术对pik3r3、Akt、mapk3 蛋白量进行检测,随着时间不断延长,3 种蛋白表达量的变化如图3、图4 所示。 灰度值分析后发现,添加雌二醇后细胞内pik3r3 蛋白在1.5 h 后迅速升高,同0 h相比差异显著(P<0.05),随后逐渐降低,在4.5 h后同对照组无显著(P>0.05)差异。 添加雌二醇后细胞内Akt 蛋白表达量逐渐升高, 在2.5 h 最高,同0 h 相比差异显著(P<0.05),随后呈下降趋势,在4 h 后与对照组无显著(P>0.05)差异。添加雌二醇后细胞内mapk3 蛋白表达量逐渐升高,在2.5 h 最高,同0 h 相比差异显著(P<0.05),后呈下降趋势, 在5 h 后同对照组无显著差异(P>0.05)。
3 讨论
雌激素作为一种类固醇化合物, 能够活化雌激素受体进而活化胞内相关通路。有研究显示,小鼠输卵管中发现有pik3r3、Akt、mapk3 的表达,并可能与细胞增殖分化及免疫功能有关[7,11];同时有研究证明卵巢组织中pik3r3、Akt、mapk3 的表达受到雌激素受体抑制剂的调控[10]。 以上试验研究仅仅基于小鼠的卵巢与输卵管,pik3r3、Akt、mapk3在绵羊输卵管内的表达情况鲜有报道。 通过该试验研究发现体外绵羊输卵管黏膜上皮细胞中也有pik3r3、Akt、mapk3 的表达, 并且这种基础表达受到雌激素的影响。 该试验发现高浓度雌二醇(10-8mol/L)能够诱导pik3r3、Akt、mapk3 在输卵管上皮细胞中高表达。综上所述,可以认为雌激素对输卵管的局部免疫起到调控和平衡作用[1-2],且这种平衡作用可能通过调控pik3r3、Akt、mapk3 的表达来实现, 因此, 进一步关注雌激素对pik3r3、Akt、mapk3 的表达调控机制, 以及它们对输卵管功能的影响及其分子机制, 可以帮助人们进一步研究雌激素对生殖系统免疫的分子调控机制, 并为研究人类的生殖系统疾病、 机体自身免疫等奠定研究理论基础。
4 结论
该试验通过qPCR、Western blot 技术检测了雌二醇诱导pik3r3、Akt、mapk3 基因mRNA 和蛋白表达的变化情况,得出如下结论:①雌二醇可诱导绵羊输卵管上皮细胞pik3r3、Akt、mapk3 基因的表达。 ②体外添加雌二醇后pik3r3、Akt、mapk3 基因mRNA 及蛋白的表达量逐渐上升, 但维持时间较短,随后表达水平逐渐下降。
