秦川牛CAP2 基因CDS 区克隆及表达谱分析
2022-05-25高玉红户春丽马燕芬汪书哲
高玉红,户春丽,马燕芬,汪书哲,马 云
(宁夏回族自治区反刍动物分子细胞育种重点实验室/宁夏大学农学院,宁夏 银川 750021)
牛肉是目前人们消费的主要肉产品之一,且经常食用牛肉有助于防止糖尿病、 心血管疾病的发生[1]。 脂肪细胞增殖、分化过程涉及转录因子的表达、信号传导及网络式调控[2-3]。 CAP2 蛋白是蛋白环化酶相关蛋白 (adenylate cyclase-associated protein,CAP)家族的成员之一,CAP 蛋白在酿酒酵母中被鉴定为腺苷酸环化酶结合蛋白[4],其功能丰富, 含有2 个功能结构域,CAP2 基因的缺失可导致传导异常和扩张型心肌病(dilated cardiomyopathy,DCM)以致心脏猝死[5-7],肌原纤维分化延迟和新生骨骼肌的运动功能缺陷[8]、先天性异常、心脏缺陷等[9]。 此外,CAP2 基因的有害突变,导致严重的DCM 和致命的充血性心力衰竭[10]。 CAP2基因调控肌原纤维肌动蛋白细胞骨架分化, 对骨骼肌结构和功能发挥至关重要的作用[8]。 CAP2 蛋白磷酸化影响能量代谢, 影响脂肪沉积[11], 推测CAP2 基因与脂肪细胞分化有关, 但尚未报道CAP2 基因在牛上的功能机制。该研究选择秦川牛脂肪组织为材料, 扩增CAP2 基因的编码区序列(CDS),利用生物信息学方法分析CAP2 基因编码蛋白的理化性质,应用qPCR 方法探析CAP2 基因在秦川牛组织和原代脂肪细胞中的时序表达,为进一步探索CAP2 基因调控秦川牛特有的脂肪发育的功能提供基础数据。
1 材料与方法
1.1 试验材料
1.1.1 组织及细胞来源
秦川牛各组织由宁夏回族自治区反刍动物分子细胞育种重点实验室采集冻存, 该试验采用秦川牛心、肝、脾、肺、肾、脂肪和肌肉组织为材料;秦川牛原代脂肪细胞来自牛背部脂肪组织, 现用现分离。
1.1.2 主要试剂
Trizol 试剂、 反转录试剂盒、2×phanta max master mix、2×SYBRRPremix Ex TaqTM(2×)、pMD-18T 载体购自Takara 公司;DL 2 000 DNA Marker、胶回收试剂盒购自OMEGA 公司;DH5α 感受态细胞购自北京索莱宝科技有限公司;DMEM 高糖培养基、Ⅰ型胶原酶、青霉素/链霉素抗体、胰蛋白消化酶、1×PBS 购自海克隆生物化学制品(北京)有限公司;胎牛血清购自赛默飞世尔科技(中国)有限公司; 罗格列酮、 地塞米松和IBMX 均购自Singma 公司;国产无水乙醇、异丙醇、氯仿、甲醛等试剂均为分析纯。
1.2 试验方法
1.2.1 牛CAP2 基因CDS 区克隆
依据GenBank(登录号:NC_037350.1)上公布的牛CAP2 基因序列, 设计CAP2 基因特异性引物。 提取脂肪组织和细胞总RNA,检测总RNA 的质量及浓度,根据反转录试剂盒将总RNA 反转录成cDNA, 于-20 ℃冰箱保存。 以脂肪组织cDNA原液为模板进行基因扩增,引物信息见表1。 PCR扩增体系15 μL:2×phanta max master mix 7.5 μL,上、下游引物各1 μL,cDNA 模板1.5 μL,ddH2O 4 μL。 运用Touch down PCR 反应程序: 预变性3 min (95 ℃),变性30 s(95 ℃),复性30 s(62 ℃),退火30 s (72 ℃),28 个循环;变性45 s(95 ℃),延伸35 s (52 ℃),退火30 s(72 ℃),延伸10 min(72℃)。 用1.5%琼脂糖凝胶电泳检测PCR 产物以验证扩增条带, 胶回收纯化后用pMD18-T 载体16℃连接4 h, 将产物转化至DH5α 感受态细胞,选取阳性菌液送至北京奥科鼎盛生物科技有限公司进行测序验证,运用DNAMAN 软件进行序列比对分析[12-14]。

表1 引物信息
1.2.2 牛CAP2 基因生物信息学分析
通过NCBI 中的BLAST 模块将克隆得到的牛CAP2 基因序列进行同源性分析。 运用ProtPram(https://web.expasy.org/protparam/) 分 析CAP2 蛋白质理化性质; 运用ProtScal(https://web.expasy.org/protscale/) 分析CAP2 蛋白的亲疏水性; 运用TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)预测CAP2 蛋白质的跨膜结构; 运用NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/)预测CAP2 蛋白中潜在的磷酸化位点;运用SOPMA分析CAP2 蛋白二级结构;运用SWISSMODEL 分析CAP2 蛋白三级空间构型。
1.2.3 牛CAP2 基因组织表达模式
以各组织样品cDNA(原液稀释10 倍)为模板,以GAPDH 基因为内参进行qPCR, 检测牛CAP2基因在秦川牛7 种组织中的表达水平, 引物信息见表1,体系参照文献[13]。 反应程序:95 ℃3 min;95 ℃5 s,60 ℃30 s,39 个循环;95 ℃30 s,95 ℃15 s。 每组待测样品设置3 个重复。
作为中国钾肥事业的参与者、传播者和守望者,中国农资传媒“钾肥观察家”对于当前中国钾肥市场也有一定的思考。我们认为,钾肥联合谈判机制是中国市场的必然选择,应当由各行业组织牵头,以听证会的方式进行摸底,听取下游用户企业建议,形成共识、协调采购。供给方面跟踪国内资源勘探信息、采集国内钾肥企业产量化数据,需求方面了解复合肥企业采购意愿、针对生产规模调研和摸底。
1.2.4 牛原代脂肪细胞分离培养和诱导分化
采用组织块分离法分离培养牛脂肪细胞,具体操作步骤如下: 样品运回实验室后需行无菌操作,剥除外层表皮、表皮膜、肉眼可见的结缔组织及血管;将脂肪组织分离成直径4~5 mm 黄豆大小的组织块,接种于90 mm 细胞培养皿,将培养皿倒置,放入37 ℃含5% CO2的培养箱培养6 h;加入8 mL 含10%FBS 血清、1%双抗的DMEM 高糖培养基,继续培养10 d;约10 d 后观察组织块附近是否游离出大量细胞; 去除组织块,PBS 冲洗,胰蛋白酶消化5 min,1 000 r/min 离心5 min,根据试验需要进行传代或冻存。具体方法参照文献[15]。对其进行诱导:细胞密度达到约90%时,更换诱导分化培养基; 诱导2 d 后, 更换维持分化培养基; 接下来每隔2 d 需要更换1 次维持分化培养基。 并收集诱导0、2、6、8、10 d 的细胞用于qPCR分析,方法参照文献[14]。
1.2.5 油红O 染色
牛原代脂肪细胞诱导分化结束后,10%福尔马林室温固定5 min;弃原有福尔马林,加入等量的10%福尔马林,室温孵育30 min;弃福尔马林,60%异丙醇清洗,静置干燥培养皿;避光加入抽滤过的提前配制好的油红O 工作液, 室温孵育20~30 min; 弃油红O 染液,PBS 立即清洗3~4 次,显微镜下观察拍照。 具体方法可以参照文献[16]。
1.2.6 细胞总RNA 的提取及CAP2、FABP4 和PPARγ 基因时序表达谱分析
细胞总RNA 的提取、检测及保存方法同组织提取法。 采用qPCR 技术检测牛脂肪细胞分化0、2、6、8、10 d 中CAP2、FABP4 和PPARγ 基因的相对表达水平。
1.2.7 数据分析
利用2-ΔΔCt法分析qPCR 的结果,数据以“平均值±标准误”的形式表示。运用SPSS 18.0 统计学软件进行单因素方差分析 (One-Way ANOVA)和Student′s t 检验,P<0.01 为差异极显著,P<0.05 为差异显著。
2 结果与分析
2.1 牛CAP2 基因CDS 区分析
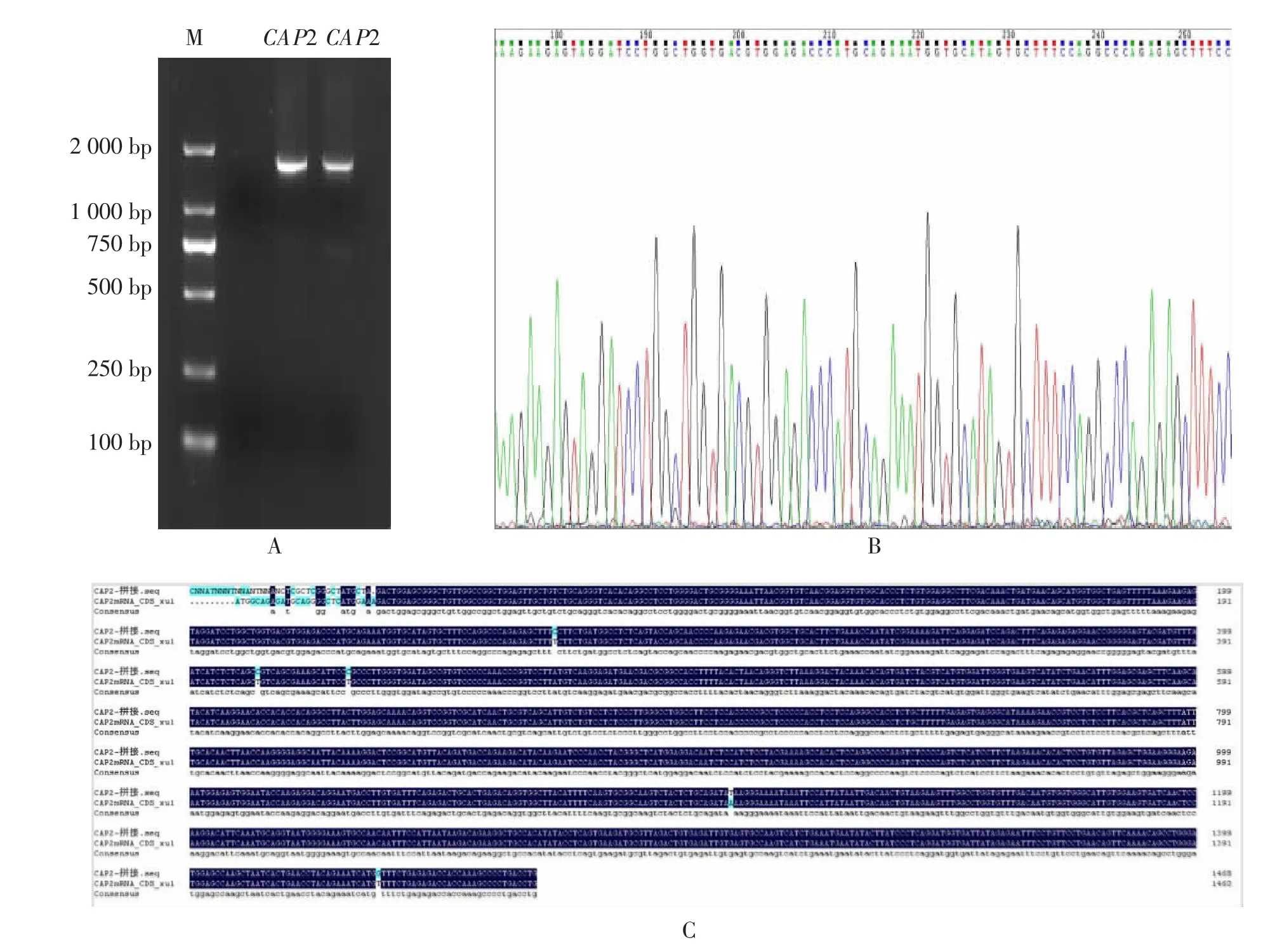
图1 秦川牛CAP2 基因克隆
2.2 秦川牛CAP2 基因与不同物种CAP2 基因同源性分析
利用ProtPram 分析可知, 克隆得到的秦川牛CAP2 基因CDS 区全长为1 461 bp,编码486 个氨基酸(见表2)。将秦川牛CAP2 基因及氨基酸序列与北美野牛(Bison)、水牛(Bubalus bubalis)、羚羊(Oryx dammah)、骆驼(Camelus ferus)、猪(Sus scrofa)、人(Homo sapiens)和家鼠(Mus musculus)等物种进行同源性分析, 发现在家畜中该基因与水牛(Bubalus bubalis)、 羚羊 (Oryx dammah)、 骆驼(Camelus ferus)等的同源性都很高,核苷酸和氨基酸同源性达90 %以上;与斑马鱼(Danio rerio)同源性较低,核苷酸同源性为54%,氨基酸同源性为65%(见表3)。同时根据氨基酸序列,构建物种进化树(见图2),与序列比对结果一致,在家畜中秦川牛与北美野牛(Bison)的亲缘关系最近,与斑马鱼(Danio rerio)的亲缘关系最远。
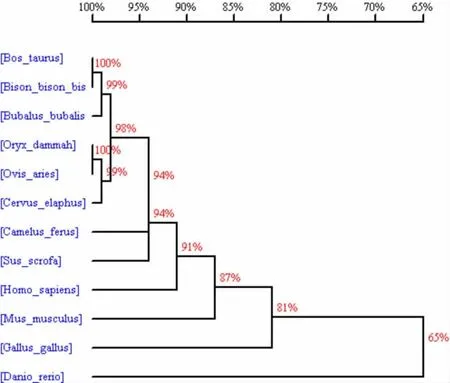
图2 秦川牛与其他物种CAP2 基因的系统进化树
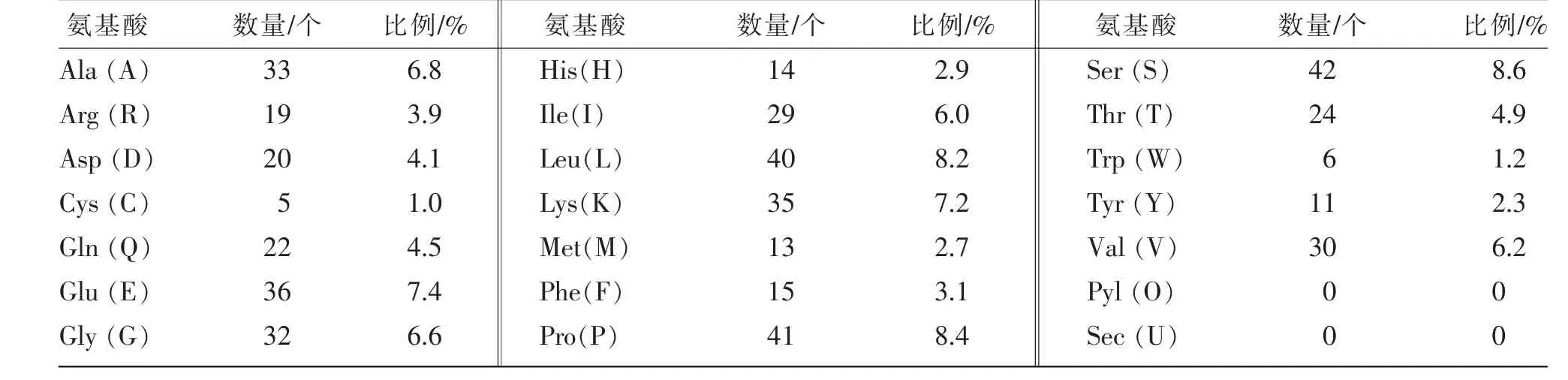
表2 CAP2 的氨基酸组成
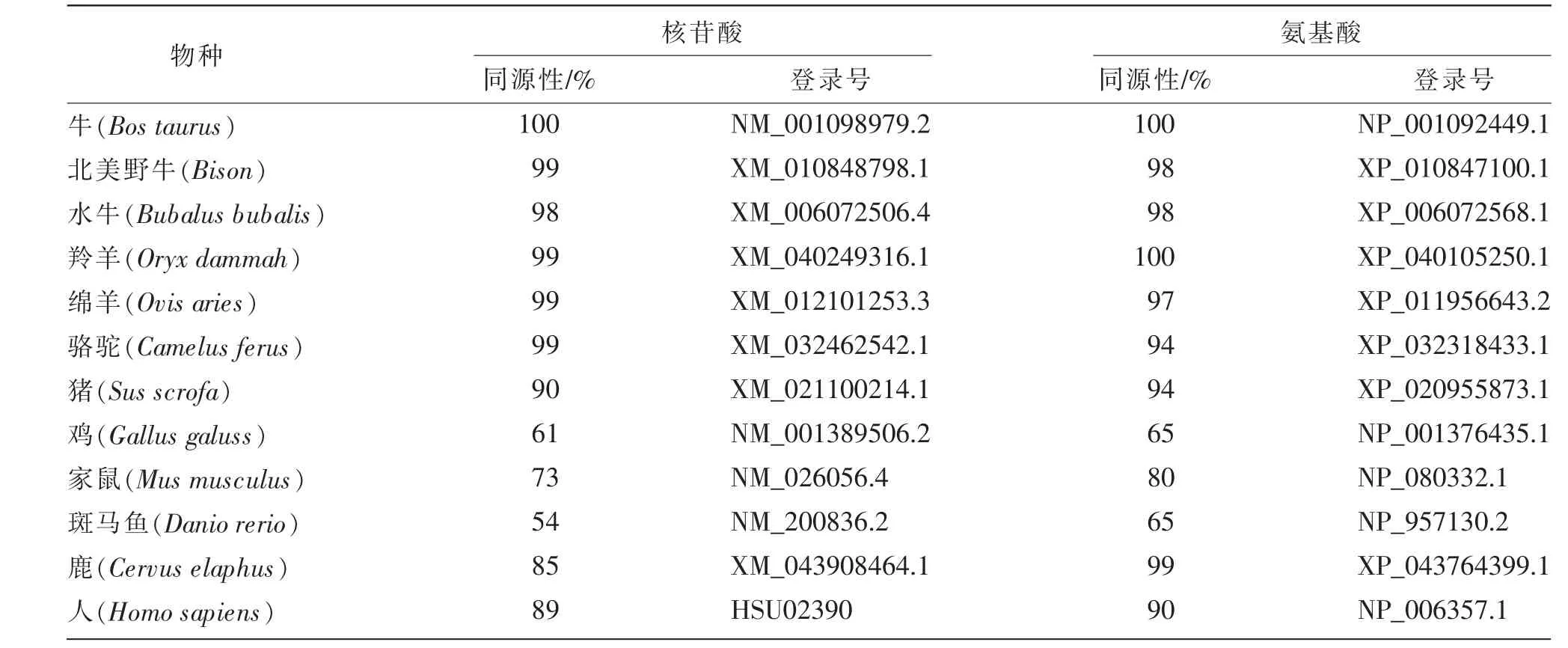
表3 秦川牛CAP2 基因与其他已知物种的核苷酸、氨基酸序列比对结果
2.3 牛CAP2 蛋白质理化性质及结构的预测
运用ProtPram 在线分析发现该基因的氨基酸主要为疏水性残基(见图3A),说明该蛋白结构稳定;TMHMM 2.0 Server v. 分析结果显示,CAP2 基因的编码产物不存在跨膜螺旋(TMHs)结构(见图3B);NetPhos 3.1 Server 分析发现CAP2 蛋白中存在46 处潜在的磷酸化位点, 包括Ser22、Thr73、Tyr95 等(见图3C)。运用SOPMA 在线软件分析发现CAP2 蛋白序列的二级结构主要为α-螺旋(alpha helix, 蓝色长竖线区) 和无规则卷曲(random coil,紫色短竖线区),分别占比36.63%、44.24%;延伸链(extended strand,红色竖线区)和β-转角(beta turn,绿色竖线区)占15.02 %、4.12 %(见图3D)。 运用SWISSMOD-EL 软件进一步预测CAP2蛋白的三级结构(见图3E),分析发现该蛋白质主要由无规则卷曲和α-螺旋构成,与二级结构预测结果一致。
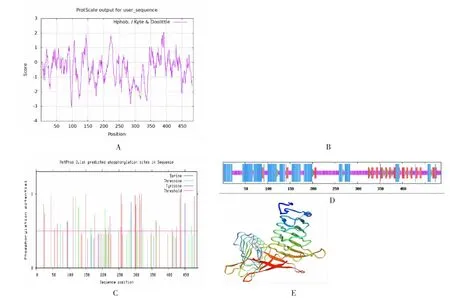
图3 牛CAP2 蛋白质理化性质和结构预测结果
2.4 牛CAP2 基因在不同组织中的表达分析
以秦川牛肝脏平均Cq 值为对照, 检测CAP2基因在秦川牛各组织中的相对表达水平。 结果表明(见图4):CAP2 基因在各组织中都表达,其中在脂肪组织中表达量最高(P<0.01),心组织次之(P<0.05)。
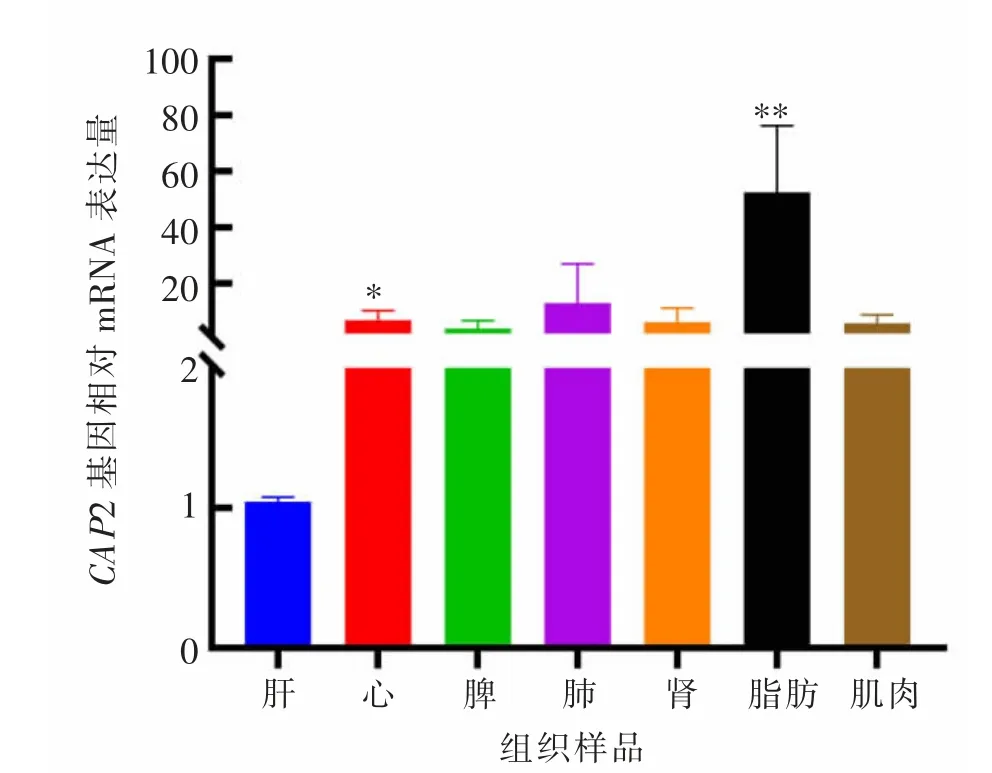
图4 秦川牛CAP2 基因组织表达分析
2.5 牛原代脂肪细胞的分离培养及诱导分化
采用组织块法分离培养牛脂肪细胞, 将组织块接种至90 mm 培养皿,9 d 后可观察到组织块周围游离出大量细胞(见图5A),随即消化、融合培养细胞,待密度达到90%以上(见图5B)后冻存,备用。 试验细胞继续传代培养6 d(见图5C)后将二代细胞传代继续培养至融合度达到90%以上,然后传代至90 mm 培养皿中,继续培养3 d 后(见图5D)细胞基本融合用于诱导分化。

图5 牛原代脂肪细胞分离培养(40×)
2.6 牛原代脂肪细胞诱导分化鉴定及CAP2、PPARγ 和FABP4 基因细胞时序表达分析
油红O 结果显示,诱导分化组(见图6A)比对照组(见图6B)脂滴数增加,说明牛脂肪细胞诱导成功。 qPCR 检测PPARγ、FABP4 和CAP2 基因在牛脂肪细胞分化过程中的表达 (见图6C~E)。CAP2 基因随细胞分化时间的推移,表达量逐渐上升,第10 天时表达量达到最大(P<0.001);PPARγ和FABP4 表达量也随时间上调(P<0.01)。 三者表达趋势一致, 说明CAP2 基因可能促进牛脂肪细胞分化。
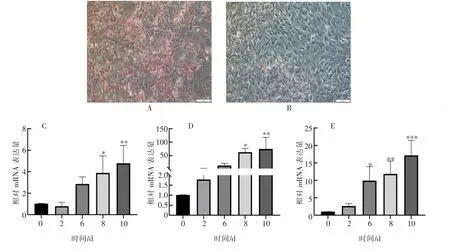
图6 牛原代脂肪细胞分化过程中PPARγ(C)、FABP4(D)和CAP2(E) 基因的表达量
3 讨论
CAP2 基因最初是在酵母中发现的,能够调控信号转导及细胞骨架,与细胞迁移相关,是肿瘤发生、转移的基础,能为分子靶向治疗提供依据[17]。在肝细胞癌(hepatocellular carcinoma,HCC)、乳腺癌中CAP2 基因均呈高表达[17], 且在HCC 中上调,参与HCC 的发展过程,可作为HCC 诊断的分子标记物[18]。 研究表明CAP2 基因在恶性黑色素瘤中过表达,参与了恶性黑色素瘤的侵袭行为,是其预后的一种新标志物[19]。系统进化树显示,从秦川牛中获得的CAP2 基因序列与水牛(Buffalo)同源相近,与同为反刍动物的骆驼(Camelus ferus)、绵 羊(Ovis aries)和 鹿(Cervus elaphus)同 源 性 达90%以上,与家鼠(Mus musculus)同源性达80%以上,如果蛋白质功能类似,那么可以将小鼠作为模式动物, 进一步探索CAP2 在脂肪沉积中的调控作用。 蛋白编码分析显示CAP2 基因共编码486个 氨 基 酸,Ala、Glu、Gly、His、Met 的 占 比 超 过 了5%;CAP2 基因编码蛋白的分析显示,CAP2 蛋白属于疏水性蛋白,不具有膜蛋白信号转导的功能;磷酸化位点分析后显示,牛CAP2 蛋白存在46 处潜在的磷酸化位点。研究报道,大部分蛋白可通过磷酸化与去磷酸化的方式实现核质穿梭等亚细胞定位的改变[20]。 综上所述,秦川牛CAP2 基因在物种间高度保守,可将小鼠作为模式动物,进一步挖掘CAP2 基因在脂肪代谢中的调控作用。
CAP2 基因在心、脑、肌肉等组织中表达较高且在心肌细胞中具有关键功能并能调节细胞增殖活性[21-22],这与该研究组织表达结果基本一致。 还有研究表明,CAP2 基因通过促进LRP5/6 磷酸化,参与Wnt 信号调节。 Wnt 基因是调控脂肪细胞分化增殖的调节因子, 推测CAP2 基因对脂肪发育起重要作用, 但目前CAP2 基因研究主要集中在疾病方面, 还未见关于CAP2 基因在脂肪生成作用上的报道,因此,该试验分离培养牛原代脂肪细胞,并进行诱导分化,检测CAP2 和成脂标志基因PPARγ 和FABP4 基因在细胞分化过程中的表达量, 结果显示,CAP2 基因在诱导分化的0 d 表达较低,此后表达量逐渐上升,于第10 天表达量最高(P<0.01),由此推测,细胞内脂滴聚集可能导致CAP2 基因的高表达。 PPARγ 和FABP4 基因的表达量随牛脂肪细胞分化逐渐增加, 且在分化的第10 天达到最大(P<0.01)。 这与先前有研究者报道得到的结果一致[23]。 综上所述,CAP2 基因在牛脂肪组织中特异性高表达的转录调控机制将是后续研究的重点。
4 结论
该试验成功克隆出了秦川牛CAP2 基因全长1 461 bp 的编码区,共编码486 个氨基酸。 利用生物信息学分析发现CAP2 蛋白是一种无规则卷曲和α-螺旋、磷酸化的疏水性结构蛋白。 同时利用qPCR 技术检测了CAP2 基因在秦川牛心、 肝、脾等7 个组织和牛脂肪细胞中的表达量, 分析发现CAP2 基因在牛脂肪组织中以较高水平表达,在脂肪细胞分化过程中呈现逐渐上升的变化趋势,揭示了CAP2 基因可能参与脂肪生成与分化过程,为进一步挖掘秦川牛CAP2 基因在脂肪发育和能量代谢方面的功能提供前期基础。
