基于网络药理和分子对接探究山柰酚治疗抵抗性前列腺癌的机制*
2022-05-25毛正谭武宾陈贵恒郑珏陈昊李铁求杨科
毛正 谭武宾 陈贵恒 郑珏 陈昊 李铁求# 杨科
(1 湖南省长沙县人民医院 长沙 410100;2 湖南省人民医院 长沙 410002)
在我国前列腺癌的发病率和死亡率虽然远低于欧美国家,但近年来其增长速度在老年男性常见恶性肿瘤中位居第一,成为危害老年男性健康的第二常见肿瘤[1~2]。较多前列腺癌患者早期对雄激素剥夺治疗有效,但大多数终将从激素敏感进展为去势抵抗性前列腺癌(CRPC)[3]。CRPC 是一种致死率较高的前列腺癌,超过84%的患者会有转移[4]。目前,阿比特龙、恩扎卢胺等新型内分泌药物和紫杉醇类的化疗药物成为治疗CRPC 的药物,在一定程度上能够延长患者生存获益[5]。但是一旦进入CPRC,其生存中位数只有20个月[6]。虽然近年来新的化疗药物、化疗方案不断改进,抗前列腺癌药物仍然普遍存在药物靶向性差和全身毒性问题,限制了药物疗效的发挥和长期使用,而前列腺癌表现出的多药耐药性也一直是肿瘤复发、转移乃至治疗失败的主要原因[7]。因此,寻找新的药物对治疗CRPC 具有重要意义。
山柰酚是一种十分常见的苷元黄酮类化合物,不仅存在于日常蔬菜水果中,还广泛存在于白芍、柴胡、杜仲、甘草等中药中[8]。山柰酚及其糖基化衍生物具有保护心脏、抗炎、抗糖尿病、抗氧化和抗肿瘤活性[9]。据报道,山柰酚具有多种抗肿瘤活性,可作用于肿瘤的多个环节,包括抑制肿瘤细胞增殖、侵袭,诱导凋亡、抑制血管生成等方面[10]。一项荷兰队列研究显示,摄入总儿茶素、表儿茶素、山柰酚和杨梅素以及饮用红茶与Ⅲ/Ⅳ期或Ⅳ期前列腺癌风险呈负相关[11]。此外,山柰酚通过抑制增殖和转移、诱导细胞周期停滞、促进细胞凋亡和抑制血管生成发挥抗肿瘤作用[11~13]。然而,山柰酚治疗CRPC 的分子机制尚未完全明确。网络药理学作为全新的药理学方法,为复杂疾病的药物发现和选择提供了新的思路[14]。本研究采用网络药理学和分子对接的方法探讨山柰酚治疗CRPC 的作用机制,为今后的临床应用和基础研究提供参考。现报道如下:
1 工具与方法
1.1 山柰酚治疗靶点的收集 通过在药物数据库PubChem (https://pubchem.ncbi.nlm.nih.gov/) 及ChEMBL (https://www.ebi.ac.uk/chembl/) 中 输 入“kaempferol”获取山柰酚标准的2D 分子结构图以及规范的SMILSES 结构信息,利用Swiss ADEM 数据库(http://www.swissadme.ch/)分析山柰酚的药代动力学。通过Swiss Target Prediction 数据库(http://www.swisstargetprediction.ch/)收集山柰酚治疗靶点,在 Uniprot 数据库(https://www.uniprot.org/)中校正靶点。
1.2 CRPC 相关基因的收集 在DisGeNET 数据库(https://www.disgenet.org/) 中 输 入“castration resistant prostate cancer”收集CRPC 相关的目标基因。利用韦恩图工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)将山柰酚预测靶点映射到CRPC靶标中获得山柰酚治疗CRPC 的关键靶点。
1.3 蛋白互作网络分析及核心靶点筛选 在“STRING”数据库(https://string-db.org/)的“Multiple proteins”窗口中,输入靶点蛋白名称,Organism 选择“Homo sapiens”,其余参数保持默认设置不变,结果保存为TSV 文本输出,在Cytoscape3.7.2 软件中进行网络拓扑学分析,获取潜在作用靶标之间的连接度(Degree 值),并根据Degree 值绘制潜在作用靶标相互作用网络图,使用MCODE 插件对蛋白群进行蛋白聚类分析,以K-core=2 为条件,并且使用cytoHubba 插件筛选出核心靶点。
1.4 GO 基因本体和KEGG 通路富集分析 使用R studio 中的“clusterProfiler”以及“org.Hs.eg.db”软件包(R3.6.3 for Windows)使用bitr 函数将目标靶标转换为ENTREZID ids 进行GO 功能富集分析和KEGG 通路富集分析,其中GO 分析包括生物学过程(BP)、细胞学组分(CC)、生物学功能(MF),设置P<0.01 为具有统计学意义的富集结果,将结果以柱形图和气泡图展示。
1.5 分子对接分析 分别在PDB 数据库(https://www.rcsb.org/) 和 TCMSP 数据库(https://tcmsp-e.com/) 下载相应蛋白和小分子药物,利用AutoDockTools-1.5.6 软件对蛋白进行去水、加氢以及计算电荷处理等处理,利用插件“autogrid”及“autodock”进行活性位点对接,对接过程中使用Lamarckian genetic algorithm(LGA)算法。计算结合能(Binding Energy,BE)(Kj/mol)来评估成分小分子与蛋白之间的结合活性,一般小于-5.0 kal/mol 的对接结合能被认为具有良好的结合相互作用。最后运用PyMOL2.4.0 软件展示其结构模式。
2 结果
2.1 山柰酚基本信息 从PubChem 及数据库ChEMBL (https://www.ebi.ac.uk/chembl/) 中 输 入“kaempferol”获取山柰酚标准的2D 分子结构图和规范的SMILSES 结构信息。见图1。从Swiss ADEM数据库分析山柰酚的药代动力学。见表1。
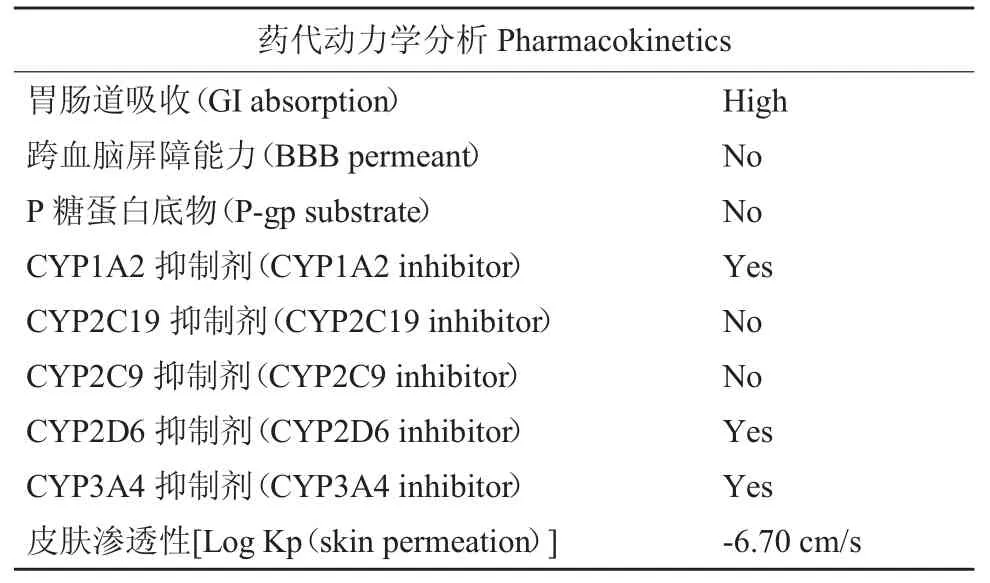
表1 山柰酚的药代动力学分析表

图1 山柰酚的标准2D 分子结构图及SMILSES 结构式
2.2 CRPC 基因 在 DisGeNET 数据库中输入“castration resistant prostate cancer”或“castration resistant prostate tumor”,共收集到683个具有代表性基因。
2.3 山柰酚治疗CRPC 靶点的蛋白-蛋白相互作用网络 将获得的103个预测靶点蛋白通过韦恩图工具映射至CRPC 靶点基因获得29个靶点蛋白,将这一部分称之为关键靶点。见图2。将以上关键蛋白输入到“STRING”数据库“Multiple proteins”窗口中,Organism 选择“Homo sapiens”,最低交互分数“minimum required interaction score”设置为0.400,PPI 网络分析得出,该网络共有28 节点,其中有1个靶点未在该网络中,127 条边,平均节点度值为9.07,将结果以TSV 格式输出保存。将文件导入Cytoscape7.1.0 软件中,进行拓扑学分析,计算度值,其 中 度 值 大 小 依 次 为 ESR1(Degree=21)、SRC(Degree=18)、EGFR(Degree=17)、AKT1(Degree=17)、PTGS2(Degree=15),根据度值呈现出 PPI 网络图,使用软件中MCODE 插件对蛋白群进行蛋白聚类分析,构建功能模块,得到3个蛋白聚类群。见图3。聚类1 平均度值为8.6,聚类2 平均度值为3,聚类3平均度值为3。分别对3个聚类的蛋白基因进行KEGG 通路富集分析,设置P<0.01 为具有统计学意义的富集结果。结果见图4。发现聚类1 主要富集的通路有癌症中的蛋白多糖、雌激素信号通路、膀胱癌、卵巢类固醇生成、黏着斑、Rap1 信号通路、VEGF信号通路等信号通路,聚类2 主要富集的通路有PI3K-AKT 信号通路、癌症的途径、ErbB 信号通路、轴突引导、趋化因子信号通路、癌症中的蛋白多糖通路等,聚类3 主要富集的通路有卵巢类固醇生成,类固醇激素生物合成通路。

图2 山柰酚与CRPC 关键靶点韦恩图

图3 山柰酚治疗CRPC 关键靶点蛋白PPI 网络图

图4 3个蛋白聚类群通路富集分析
2.4 GO 基因本体和KEGG 通路富集分析 使用R的 clusterProfiler 软件包(R4.0.2 for Windows)进行GO 富集分析和KEGG 通路富集分析,其中GO 分析包括生物学过程(BP)、细胞学组分(CC)、生物学功能(MF),设置P<0.01 为具有统计学意义的富集结果。共富集到511个条目,其中BP 共470 条,涉及肽基丝氨酸修饰、蛋白质自身磷酸化、活性氧反应、药物反应、细胞周期调节等方面;CC 共3 条,包括蛋白激酶复杂、丝氨酸/苏氨酸蛋白激酶复合物、转移酶复合物;MF 共38 条,涉及酪氨酸激酶活性、转录因子活性、丝氨酸/苏氨酸激酶活性、热休克蛋白结合、雌激素受体结合、氧化还原酶活性等方面。具有代表性的GO 富集分析结果见图5。为进一步揭示山柰酚抗CRPC 的潜在药理机制,进行KEGG通路分析,探索山柰酚发挥作用的潜在通路。设置P<0.01 为具有统计学意义的富集结果,有42 条具有差异的富集通路。具有代表性的前25 条富集通路见图6。结果表明,内分泌抵抗通路、EGFR 酪氨酸激酶抑制剂耐药性、蛋白聚糖在癌症、PI3K-AKT 信号通路、雌激素信号通路富集明显。上述分子功能和生物学过程与CRPC 的发生发展密切相关,表明山柰酚可以通过多靶点、多途径的方式治疗CRPC。
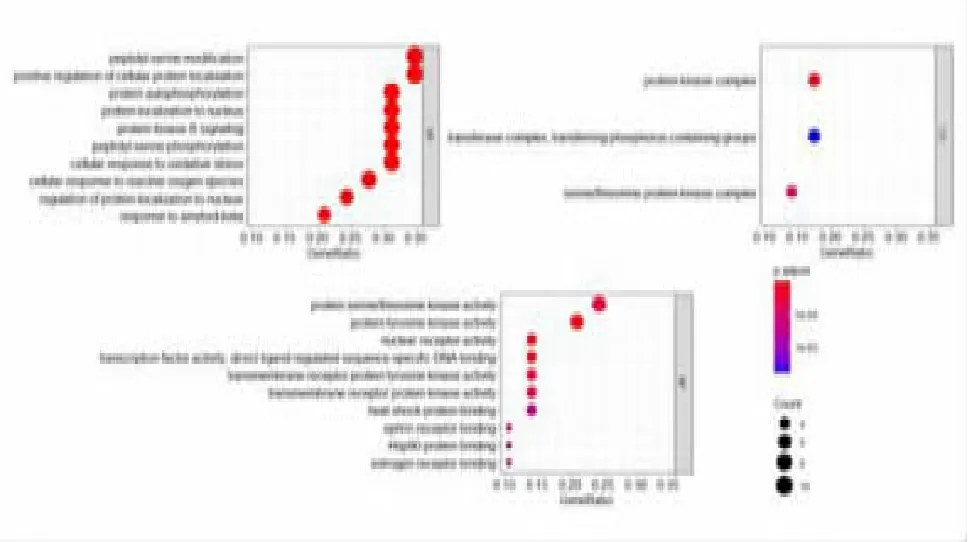
图5 山柰酚治疗CRPC 关键基因GO 基因本体富集气泡图

图6 山柰酚治疗CRPC 关键基因KEGG 通路富集气泡图(前25)
2.5 山柰酚与核心靶点的分子对接 选择山柰酚治疗CRPC 靶点的前10个作为核心靶点,分别是ESR1、SRC、EGFR、AKT1、PTGS2、CYP19A1、MMP9、ABCG2、ESR2、IGF1R,运行 AutoDock 软件进行 10次分子对接。具体对接结合结果见表2。由表可知,山柰酚与 AKT1 结合能最低,其次是MMP9、CYP19A1、PTGS2,对接结合能越低表明山柰酚与这些靶点结合亲和力越高,提示其有更大可能作用于这些靶点,影响靶点结构发生变化,进而调控相应的信号通路。山柰酚与靶点AKT1 对接结构图见图7。由图可知,山柰酚与AKT1 的TYR-272 残基有苯环共扼 π 键,与 LEU-295、LYS-297、LYS276 等残基有氢键相连,进一步说明分子与蛋白之间结合紧密。进而表明,山柰酚抗CRPC 主要是通过调节这些核心靶点来实现。

表2 山柰酚与CRPC 核心靶点分子对接结合能(kJ/mol)
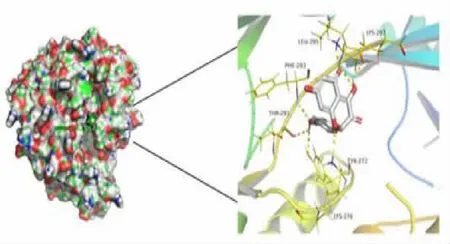
图7 山柰酚与核心靶点AKT1 分子对接结构图
3 讨论
黄酮类化合物在自然界中无处不在,存在于较多水果、蔬菜和农作物中,且浓度较高,特别是山柰酚和芹菜素,两者具有雌激素样作用,说明在本质上,山柰酚可以通过某些途径调节前列腺癌的发生发展,这也是以素食为主的亚洲男性前列腺癌发病率要低于以肉食为主的欧美男性的原因之一[15]。网络药理学是一种依附系统生物学、生物信息学、药理学、计算机科学等学科理论,研讨“化合物-蛋白质/基因-疾病”之间的网络关系的一门学科[16]。为发现山柰酚治疗CRPC 的作用机制,本研究整合网络药理学的方法,PPI 网络分析鉴定出治疗靶点,GO 和KEGG 分析作用机制,并结合分子对接进行分析验证 。 筛 选 出 ESR1、SRC、EGFR、AKT1、PTGS2、CYP19A1、MMP9、ABCG2、ESR2、IGF1R 等 10个靶点作为山柰酚抗CRPC 的核心靶点。
AKT1 是PI3K/AKT 信号通路中核心调控因子,参与肿瘤的多种生物学过程。在前列腺癌中,基于基因组和转录组谱发现,有多达42%的原发性前列腺癌和100%的转移性前列腺癌样本检测出PI3K途径成分的遗传变异和基因表达失调[17]。研究报道,磷酸化AKT 的水平与Gleason评分高低成正比,AKT 的水平可能成为预测根治性前列腺切除患者生化复发的指标[18]。雌激素相关受体ESR1、ESR2 在前列腺癌中可能显著影响前列腺癌的发展和进展[19],Wang 等[20]进行亚洲人群前列腺癌全基因组研究提出,ESR2 可作为亚洲人的前列腺癌风险相关变异基因位点。有研究表明,CYP17A1、LHCGR 和ESR2基因的遗传变异,与前列腺癌的侵袭性疾病进展有关[21]。研究发现,EGFR(表皮生长因子受体)表达增加或激活在前列腺癌患者中占相当大的比例,且与高复发率、不良预后和去势抵抗进展密切相关[22],EGFR 表达增加(逃逸雄激素调控)是CRPC 的潜在分子开关[23]。PTGS2 又称为环氧合酶 2(COX-2),研究结果表明,PTGS2 在前列腺癌细胞中高表达,COX-2/Mattritase 信号通路参与了COX-2 过表达的CRPC 细胞的侵袭、肿瘤生长和转移[24]。Src(一种原癌基因酪氨酸蛋白激酶)参与前列腺肿瘤骨转移进展,具有驱动增殖、存活、迁移和向雄激素依赖性生长转变的作用。且研究报道,Src 抑制剂比如达沙替尼、波沙替尼的临床前和临床研究中已经获得了令人鼓舞的结果[25]。较多研究表明,基质金属蛋白酶(MMPs) 在CRPC 转移机制中发挥重要的作用,MMP2 和MMP9 蛋白与转移性CRPC 密切相关,下调MMP2 和MMP9 蛋白水平可以减少CRPC 细胞的侵袭和转移[26]。MMP 活性受其相关基因表达和酶促反应的介导和控制,有研究证明AKT 信号通路可影响MMP2 和MMP9 的表达,从而导致CRPC 的进展[27]。胰岛素样生长因子1 受体(IGF1R)在肿瘤的增殖、凋亡、血管生成中发挥重要作用,Ahearn 等[28]学者通过预后模型和免疫组化检测IGF1R、IR 和ERG 的蛋白表达发现,IGF1R 的表达可能在前列腺癌向致命的表型发展过程中发挥作用。ATP 结合盒亚家族 G 成员 2(ABCG2),有研究表明 ABCG2 的变异可能与前列腺根治性切除术后PSA 复发的前列腺癌患者生存机制有关[29]。本研究结果基本与目前研究报道相一致,更加提示,山柰酚可能通过作用于这些靶点发挥抗CRPC 作用。
为进一步说明山柰酚对CRPC 的生物学效应,我们通过靶蛋白进行GO 富集分析和KEGG 通路富集分析。GO 分析表明,核心靶点的生物学过程主要集中在肽基丝氨酸修饰、蛋白质自身磷酸化、活性氧反应、药物反应、细胞周期调节等方面上。KEGG分析表明,富集通路与内分泌抵抗通路、EGFR 酪氨酸激酶抑制剂耐药性、蛋白聚糖在癌症、PI3K-AKT信号通路、雌激素信号通路富集明显和其他癌症途径有关。根据对文献的分析,内分泌抵抗是前列腺癌发展为CRPC 的必经之路,CRPC 可涉及多种非互斥机制,包括AR 依赖性和非依赖性机制,AR 依赖性机制涉及基因扩增、突变、调节因子改变等,AR非依赖性机制涉及凋亡抵抗、人第10 号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)失活等,激酶依赖性信号通路、肿瘤免疫、肿瘤干细胞、非编码RNAs(non-coding RNAs,ncRNAs)的改变等也参与了CRPC 的发生发展[30]。相关研究数据表明,前列腺癌向CRPC 进展过程中,磷脂酰肌3-激酶(PI3K)/丝氨酸 - 苏氨酸蛋白激酶(AKT) 信号通路(PI3K/AKT 信号通路)扮演者重要角色,PI3K/AKT信号通路可作为CRPC 潜在的生物标志物[31],该通路相关的抑制剂现已进行临床试验,并且取得可观的疗效[32]。现代中药药理学研究发现,一些天然药物可作用于PI3K/AKT 信号通路发挥抗前列腺癌效果。研究发现,异鼠李素可显著抑制雄激素非依赖性前列腺癌细胞DU145 和PC3 的生长[33],被认为是一种选择性PI3K/AKT/mTOR 途径抑制剂;将丹皮酚作用于前列腺癌DU-145 细胞株、PC-3 细胞株以及DU-145 荷瘤小鼠,发现丹皮酚抗增殖作用可能与其外在和内在凋亡途径的激活以及PI3K/AKT 途径的抑制密切相关[34]。Li 等[35]通过苦参碱处理前列腺癌DU-145 和 PC-3 细胞,提出苦参碱可能通过PI3K-AKT-FOXO 信号通路抑制前列腺癌细胞的增殖、迁移和侵袭并诱导其凋亡。
综上所述,本研究可以推测山柰酚通过调节CRPC 细胞中预测靶点、通路和生物学过程而发挥有效的抗癌作用。预测的靶点也可作为抗CRPC 的潜在分子标志物。通过网络药理学途径和分子对接技术产生的药理和分子机制具有良好预测性,该方法的准确性和实用性为进一步探索山柰酚治疗CRPC 的药理靶点和分子机制奠定了良好的基础。
