苦参碱对胃癌化疗后不良反应及炎症标志物PLA2、SAA 的影响*
2022-05-24达春和胡杰亮屈蕾蕾张媛媛
王 艳,达春和,胡杰亮,屈蕾蕾,张媛媛,包 丽,张 强
甘肃中医药大学第三附属医院,甘肃 白银 730900
化疗在杀伤肿瘤细胞的同时对机体的正常器官、组织也有较大的损伤。损伤达到一定程度将促使细胞释放大量的炎症因子入血,引发全身出现炎症级联样反应。患者出现高热、呕吐、呼吸急促等急性症状[1]。有学者认为,苦参碱具有减轻炎性反应及化疗增敏作用[2]。因此,本研究拟通过在胃癌化疗过程中联用苦参碱,评估患者化疗后副反应发生率及苦参碱对磷脂酶A2(phospholipaseA2,PLA2)、血 清 淀 粉 样 蛋 白A(serum amyloid A,SAA)两项反应炎症程度的指标和治疗后血清中肿瘤标志物CEA、CA199、CA724 水平是否存在影响,以了解苦参碱是否具有缓解胃癌化疗引起的全身炎症反应及是否具有化疗增敏作用,并探讨其作用机制。
1 资料与方法
1.1 临床资料选择2017年2月至2019年12月甘肃中医药大学第三附属医院收治的Ⅱ~Ⅲ期胃癌术后患者138 例,按随机数字表法将患者随机分为观察组和对照组,最终完成随访患者共126例。观察组70 例,其中男38 例,女32 例;平均年龄(60.98±1.17)岁。对照组56例,其中男34例,女22 例;平均年龄(60.48±1.41)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准纳入:1)入选病例通过临床诊断及胃镜取材病理学检查,诊断结果与国际中晚期胃癌临床诊断标准[3]相符者;2)预计生存期>6个月,且功能状态评分(KPS)≥70分[4]者;3)该研究得到医学伦理委员会的认可,入组患者均对研究知情、同意,并按照要求在知情同意书上签字。
1.3 排除标准排除:1)伴随严重脏器疾病及肝肾功能不全者;2)认知功能障碍及智力障碍者;3)临床资料不全者;4)既往接受过化疗者;5)既往存在药物过敏史者。
1.4 治疗方案对照组给予单纯FOLFOX 化疗方案。FOLFOX 方案:(奥沙利铂+亚叶酸钙+5-Fu):采用双周方案。奥沙利铂(上海叶源生物科技公司,批号:S24033,25 mg/支)85 mg/m2,静脉滴注;亚叶酸钙(江苏恒瑞医药股份有限公司,国药准字H32022391,100 mg/支)200 mg/m2,静脉滴注;氟尿嘧啶(天津金耀药业有限公司,国药准字H12020959,250 mg/支)600 mg/m2,静脉滴注。以上药物均每日1 次。观察组在对照组治疗基础上给予苦参碱注射液(内蒙古爱普尔药业有限责任公司,国药准字H15021078,100 mg/支)20 mL+生理盐水250 mL静脉滴注,每日1次,连用21天[5]。
1.5 评价指标
1.5.1 不良反应 观察两组患者恶心、腹泻、发热、脱发、口腔溃疡、静脉炎等不良反应发生率。
1.5.2 炎症标志物检测 采集患者静脉血清,采用酶联免疫吸附法,检测血清PLA2、SAA水平。
1.5.3 肿瘤标记物检测 采集患者静脉血清,采用化学发光免疫分析法,检测化疗后胃肠道特异性肿瘤标记物CEA、CA199、CA724水平。
1.6 统计学方法采用SPSS 17.0统计软件进行数据分析,计量资料以±s表示,采用t检验,多样本均数比较,采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 不良反应恶心、脱发、腹泻、发热、口腔溃疡、静脉炎等不良反应发生情况两组比较,差异有统计学意义(P<0.05)。见表1。
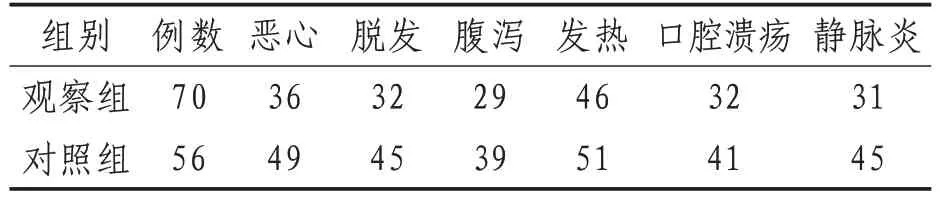
表1 两组不良反应发生情况比较 例
2.2 血清中PLA2、SAA 水平观察组的PLA2、SAA水平分别为6.39 U/mL、11.27 mg/mL,对照组分别为8.55 U/mL、14.62 mg/mL,两组比较,差异有统计学意义(P<0.05)。
2.3 肿瘤标记物两组CEA-3、CEA-6、CEA12、CA199-3、CA199-6、CA199-12、CA724-3、CA724-6、CA724-12等肿瘤标记物水平比较,差异有统计学意义(P<0.05)。见表2。
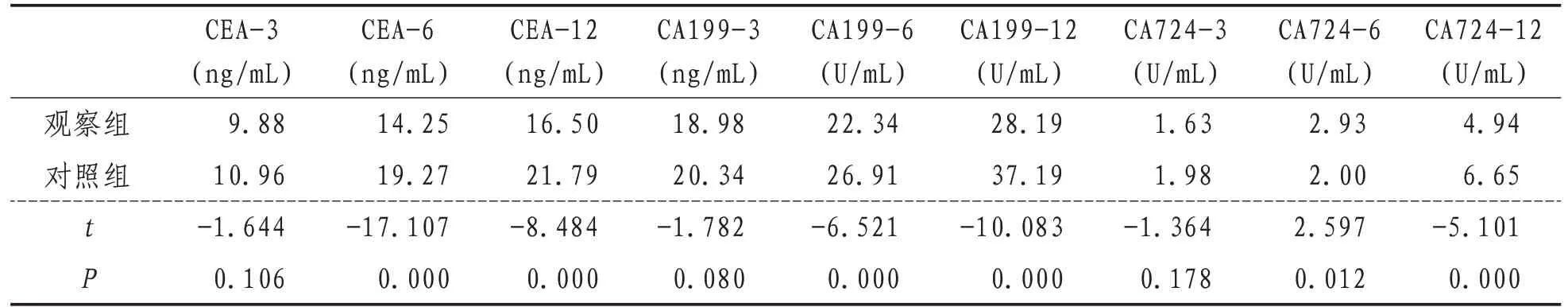
表2 两组肿瘤标记物平均值比较
3 讨论
苦参碱具有明显的抗肿瘤作用,可诱导肿瘤细胞凋亡且无明显毒副作用[6]。有研究[7]经体外细胞实验证实,苦参碱主要作用于肿瘤细胞的G1/S期转换点,使肿瘤细胞G1期发生阻滞,抑制其增殖。并且这种抑制作用呈时间-剂量依赖型[8]。另外还有研究[9]证实,苦参碱抑制了端粒酶的活性及下调周期素PCNA。同时一些体外研究发现,苦参碱作用于肿瘤细胞后,可促进细胞体积缩小、染色质聚集、胞浆中出现颗粒、核仁消失,并且抑制了蛋白络氨酸激酶活性,促进了周期蛋白依赖激酶抑制剂细胞周期蛋白p27kipl的表达[10-11]。
本研究对化疗患者进行为期8 个月的随访。结果显示,观察组在化疗开始后,恶心、脱发、腹泻、发热等不良反应发生率低于对照组。笔者认为,这是由于苦参碱对肝细胞的保护作用引起的。肝细胞是人体最重要的解毒器官,目前主要的化疗药物,其毒性反应主要通过肝细胞进行代谢清除。由于苦参碱在患者体内逐步形成稳定的高血药浓度,促进了患者体内对细胞毒性药物的解毒作用,总体上减轻了化疗带来的副作用[12-13]。治疗后,观察组血清中PLA2、SAA 水平明显低于对照组,可见苦参碱可以显著降低炎症标志物水平和全身炎症综合征的发生率。近年有研究发现,Oxy和苦参碱Mat 有抗过敏作用,可抑制炎症介质的释放,调节大鼠腹腔肥大细胞组织胺释放,可有效抑制IgE 交联及组胺、白三烯等介质释放,并具有稳定细胞膜、减轻炎症的作用[14]。同时苦参碱可抑制肿瘤产生的各类毒性炎症介质的释放,减轻炎症介质引起的全身级联反应[15]。另外,化疗后,两组肿瘤标记物水平呈现逐步下降趋势,且观察组降低程度优于对照组。这可能是因为苦参碱的效能由时间-剂量依赖特性决定,随着化疗后时间的延长,苦参碱在患者体内开始显现协同增敏效应,从而抑制肿瘤细胞多重耐药基因P-gp 和MRP基因的表达,促进肿瘤细胞内奥沙利铂及5-Fu 的高浓度,促进患者肿瘤细胞的坏死和凋亡[16-17]。
综上所述,苦参碱联合FOLFOX 化疗方案治疗胃癌,可以增强化疗效果,起到协同增效作用,且随着时间的逐步延长,有效降低了肿瘤细胞的多重耐药性[18-19],减轻了恶心、腹泻、发热等不良反应的发生率[20-21]。但本课题研究中尚存在一定不足,由于随访时间较长,部分患者失去随访,一定程度上降低了结果的准确性。且随访时间越长,难度越大,妨碍了课题组进行更为长期的密切跟踪调查。今后,我们将进一步延长术后随访时间。另外,更应开展体外细胞实验,探究苦参碱对肿瘤细胞作用的具体分子生物学机制。
