全容积ADC 直方图参数联合MRI 征象鉴别低分化胰腺导管腺癌与G3 胰腺神经内分泌肿瘤的价值
2022-05-24周永进江春燕舒恩芬蓝传强王祖飞纪建松
周永进,江春燕,舒恩芬,蓝传强,王祖飞,纪建松
(1.浙江省丽水市中心医院放射科,浙江 丽水 323000;2.浙江省影像诊断与介入微创研究重点实验室,浙江 丽水 323000;3.浙江省松阳县人民医院放射科,浙江 松阳 323400)
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是胰腺最常见的恶性肿瘤,病理分化程度越低,恶性程度越高,发生转移风险越高,预后也越差[1-2]。2010 年WHO 将胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumor,pNET)分为G1、G2、G3级[3],病理级别越高,恶性程度越高[4],而G3 pNET即使发生远处转移,仍可行手术治疗,且预后也好于胰腺癌[2]。低分化PDAC 与G3 pNET 均为低分化肿瘤,影像学上两者均表现为乏血供强化特征,治疗前难以对两者进行区分,因此,准确鉴别低分化PDAC和G3 pNET 具有重要的临床意义[5]。目前,PDAC 和乏血供pNET 的鉴别研究多为基于CT 增强扫描的定性或定量评估[6-7],而基于DWI 的定量分析研究尚少,且DWI 评估采用的是通过在肿瘤单一层面绘制ROI 获取ADC 平均值,无法更全面地反映肿瘤整体内部特征。本研究通过基于肿瘤全容积感兴趣区(volume of interest,VOI)勾画方式,获取肿瘤的ADC直方图特征参数联合常规MRI 征象鉴别低分化PDAC 与G3 pNET,为临床治疗及预后提供更多的参考信息。
1 资料与方法
1.1 一般资料 回顾性分析2014 年6 月至2021 年4 月丽水市中心医院经穿刺活检或手术病理证实的低分化PDAC 患者30 例(低分化PDAC 组)与G3 pNET 患者13 例(G3 pNET 组)。纳入标准:①经穿刺活检或手术病理证实为低分化PDAC 或G3 pNET;②治疗前常规行MRI 平扫、增强扫描及DWI 检查;③检查前未行放化疗;④乏血供肿瘤标准为MRI 增强扫描动脉期强化幅度低于或等于正常胰腺实质[8]。排除标准:①MRI 资料或病理资料不全或图像质量无法满足诊断要求;②DWI 图像伪影较重,软件无法进行后处理;③病灶过小(直径<1 cm),无法勾画病灶的VOI。
本研究通过丽水市中心医院伦理委员会的批准。
1.2 仪器与方法 所有患者均在治疗前行常规上腹部或胰腺MRI 平扫和增强扫描。采用Philips Ingenia 3.0 T MRI 扫描仪,体部专用32 通道相控阵线圈。扫描序列与参数:脂肪抑制T1WI 序列,采用多回波Dixon 技术进行,TR 3.71 ms,TE 0 ms,视野380 mm×300 mm,层厚4.0 mm,矩阵256×256;T2WI,TR 3 000 ms,TE 77.69 ms,视野360 mm×300 mm,层厚5.0 mm,矩阵276×276;DWI,TR 2 499.99 ms,TE 62.59 ms,视野360 mm×320 mm,层厚3.0~5.0 mm,b 值选取0、800 s/mm2;增强扫描采用mDixon 序列,TR 3.71 ms,TE 0 ms,视野380 mm×300 mm,层厚3.0 mm,矩阵244×180。常规放置静脉留置针,对比剂为钆双胺(欧乃影),剂量0.1 mmol/kg 体质量,使用高压注射器经肘静脉以流率2.0 mL/s 团注,使用2.0 mL 生理盐水冲管,对比剂注射后15、30、90 s 行动脉期、门静脉期、平衡期扫描。
1.3 图像分析与后处理
1.3.1 常规MRI 图像评估 由2 名经验丰富的高年资医师采用盲法对MRI 图像进行分析,遇到分歧时经商议达成一致意见。评估内容包括肿瘤部位、大小、质地(实性或囊实性)、边缘(清晰或模糊)、胰周侵犯、上游主胰管扩张、强化模式、胰周淋巴结及肝转移情况。肿瘤质地评估:实性为强化实质≥90%,囊实性为强化实质<90%;胰管扩张标准为直径>3 mm;强化模式包括门脉期高强化或延迟期等高强化、门脉期低强化或延迟期渐进性强化、持续低强化[8]。
1.3.2 DWI 图像后处理 使用Firevoxel 软件分析b=800 s/mm2的DWI 图像。由1 名有8 年腹部MRI工作经验的放射科诊断医师逐层手动定义病灶ROI,每层ROI 尽可能包括更多的肿瘤组织,包括囊变、坏死及出血成分,使得DWI 能更好地评估肿瘤的异质性,为减小部分容积效应,ROI 勾画范围稍小于实际肿瘤范围(图1)。

图1 男,67 岁,G3 级胰腺神经内分泌肿瘤(G3 pNET)图1a b=800 s/mm2 时勾画容积感兴趣区(VOI)示意图图1b Firevoxel 软件生成的ADC 图
使用Firevoxel 软件生成整个肿瘤容积,以体素为单位勾画出肿瘤VOI 后自动计算出每个体素的ADC 值,从而生成全容积ADC 直方图,得到多个ADC 直方图参数,包括ADC 最小值(ADCmin)、ADC平均值(ADCmean)、ADC 最大值(ADCmax)、ADC 第10 百分位数(ADC10%)、ADC 第50 百分位数(ADC50%)、ADC第90 百分位数(ADC90%)、偏度系数、峰度系数、熵。
1.4 统计学分析 采用SPSS 26.0 及MedCalc 19.0软件进行统计学分析。采用Shapiro-Wilk 检验确定计量资料是否符合正态分布,符合正态分布时以表示,组间比较行独立样本t 检验;偏态分布则以M(QR)表示,组间比较行秩和检验(Mann-Whitney U检验)。2 组计数资料比较行χ2检验或Fisher 确切概率法。采用单因素和多因素二元Logistic 回归分析筛选出独立预测因子,构建诊断模型。使用ROC 曲线确定MRI 征象及ADC 直方图参数的诊断效能,同时计算最佳临界点、敏感度和特异度。以P<0.05 为差异有统计学意义。
2 结果
2.1 2 组临床及MRI 征象比较(表1)2 组年龄、性别、肿块最大径、边缘情况、病灶质地、胰周淋巴结转移情况差异均无统计学意义(均P>0.05);强化模式、胰周侵犯、上游主胰管扩张及肝脏转移情况差异均有统计学意义(均P<0.05)。低分化PDAC 及G3 pNET 的MRI 及病理学图片见图2,3。
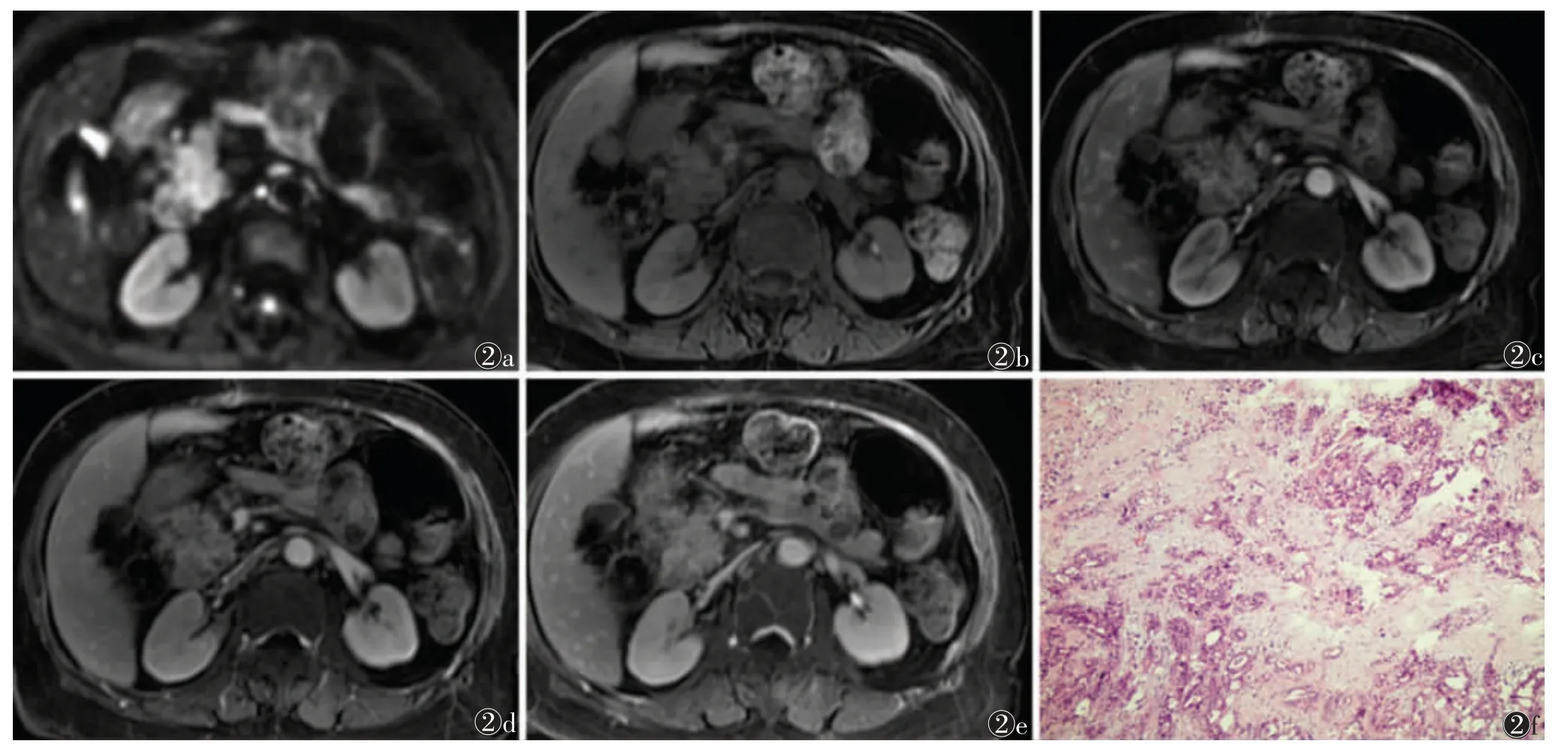
图2 男,59 岁,低分化胰腺导管腺癌(PDAC),肿瘤位于胰头,最大径2.9 cm图2a DWI(b=800 s/mm2)示肿瘤扩散受限图2b MRI 平扫呈稍低信号,胰周组织侵犯图2c~2e 动脉期、门脉期、延迟期图像,肿瘤呈持续低强化图2f 病理学图片示肿瘤细胞异型性表达,细胞核深染,大小不一,细胞排列呈腺管状、条索状(HE,低倍放大)
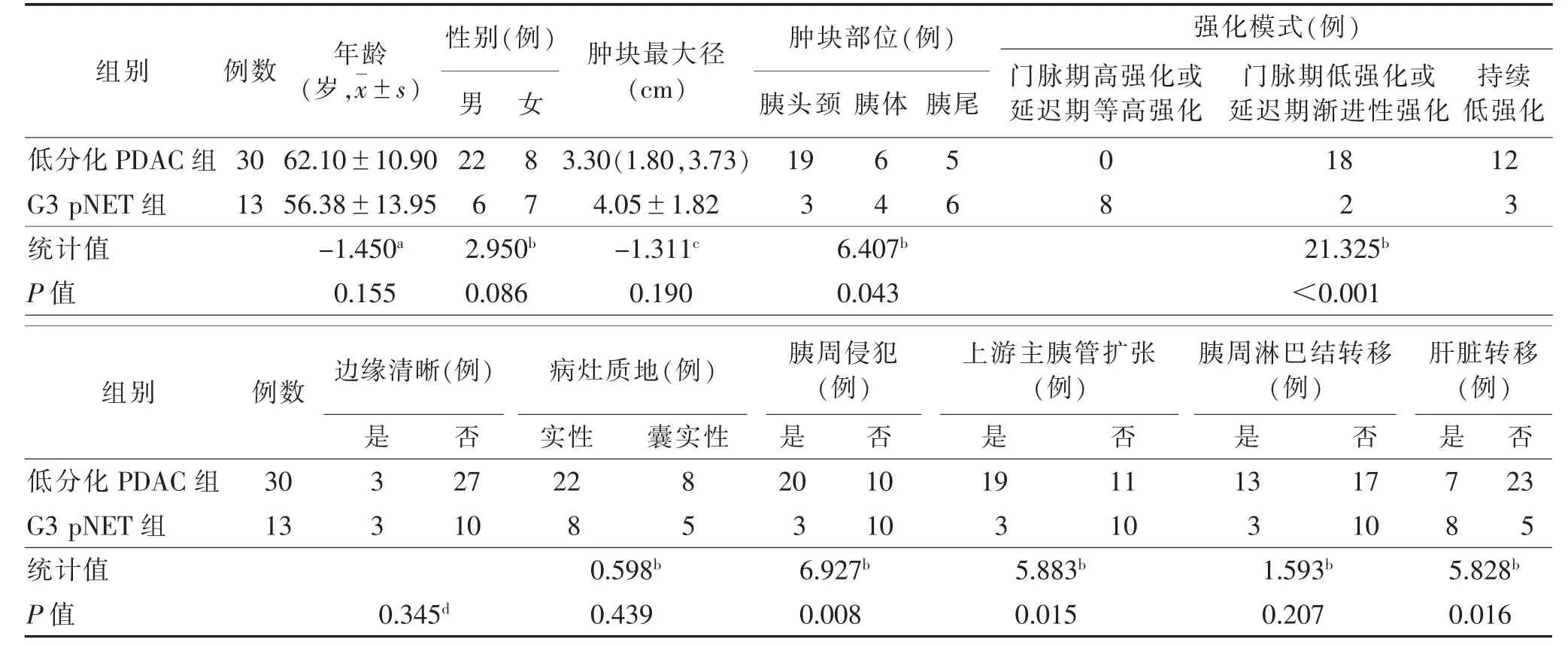
表1 2 组临床及MRI 征象比较
2.2 2 组ADC 直方图参数比较(表2)低分化PDAC组ADCmean、ADCmin、ADCmax、ADC10%、ADC50%、ADC90%均高于G3 pNET 组,差异均有统计学意义(均P<0.05);偏度系数、峰度系数及熵值在2 组间差异均无统计学意义(均P<0.05)。

表2 2 组ADC 直方图参数比较
2.3 MRI 征象与ADC 直方图参数的预测效能(表3,4)ROC 曲线分析表明,MRI 征象对低分化PDAC和G3 pNET 的鉴别诊断效能中,强化模式的AUC最大,敏感度61.54%,特异度100.00%(图4)。ADC直方图参数中ADCmean的AUC 最大,敏感度96.67%,特异度61.54%(图5)。MRI 征象和ADC 直方图参数构建的二元Logistics 回归联合模型显示,胰周侵犯、上游主胰管扩张、肝脏转移、ADCmean、ADC90%为独立预测因子,该模型诊断效能最佳,AUC 为0.977,特异度100.00%,敏感度86.67%(图6)。

图4 单个MRI 征象鉴别低分化PDAC 和G3 pNET 的ROC 曲线图5 ADC 直方图参数鉴别低分化PDAC 和G3 pNET 的ROC 曲线图6 联合ADC 直方图参数和MRI 征象鉴别低分化PDAC 和G3 pNET 的ROC 曲线

表3 MRI 征象鉴别低分化PDAC 和G3 pNET 的效能
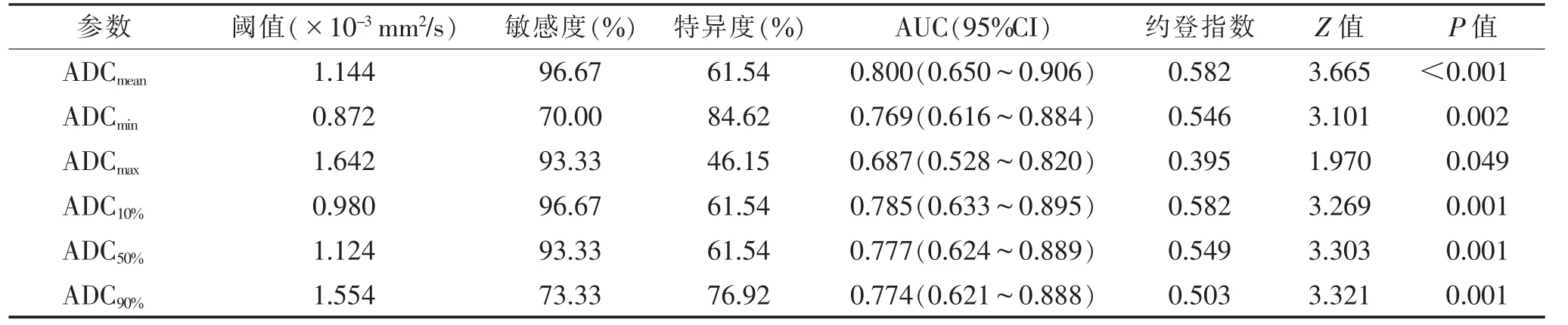
表4 ADC 直方图参数鉴别低分化PDAC 和G3 pNET 的效能
3 讨论
PDAC 和pNET 是胰腺最常见的肿瘤,其病理类型与患者生存预后相关,PDAC 的5 年生存率仅4.2%,pNET 则可达49.2%[9]。PDAC 是典型的乏血供肿瘤,恶性程度高,发现时常伴胰周及远处侵犯。研究表明,pNET 随病理级别增加,病灶强化程度减弱[10],G3 pNET 因恶性程度高亦表现为乏血供,且发现时肿块常较大,可合并胰管扩张、胰周组织受累或肝转移等,与PDAC 相似,因此两者区分存在困难。本研究中,MRI 征象包括肿瘤强化模式、胰周侵犯、上游主胰管扩张及肝脏转移情况,可鉴别低分化PDAC和G3 pNET。ADC 直方图参数包括ADCmean、ADCmin、ADCmax、ADC10%、ADC50%、ADC90%6 个参数可鉴别两者,其中以ADCmean的诊断效能最高(AUC=0.800),敏感度96.67%,特异度61.54%,鉴别最佳临界值为1.144×10-3s/mm2。联合ADC 直方图参数和MRI 征象进行鉴别诊断,AUC 为0.977,特异度100.00%,敏感度86.67%。以上结果表明,ADC 直方图参数、MRI征象能较好地鉴别低分化PDAC 和G3 pNET,以ADC 直方图参数与MRI 征象联合诊断效能最高。
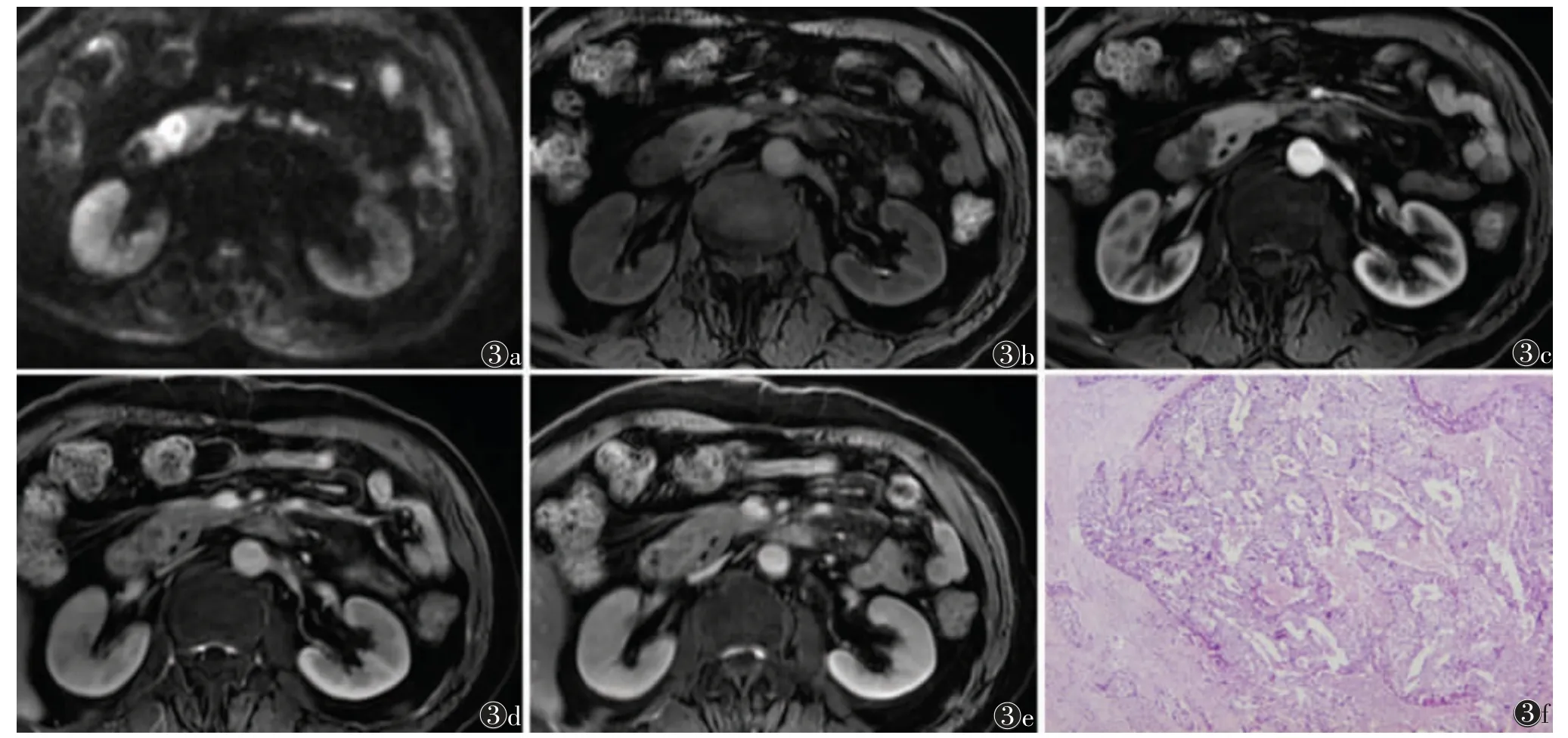
图3 男,67 岁,G3 pNET,肿瘤位于胰头,最大径2.1 cm图3a DWI(b=800 s/mm2)示肿瘤扩散受限图3b MRI 平扫呈低信号,胰周组织未见受侵图3c~3e 动脉期、门脉期、延迟期图像示肿瘤动脉期低强化,门脉期呈稍高强化,延迟期进一步强化图3f 病理学图片示肿瘤细胞呈巢状排列,胞核染色质细腻(HE,低倍放大)
本研究显示,低分化PDAC 和G3 pNET 患者的性别、年龄、肿块最大径差异无统计学意义,与Jeon等[8]的结果一致,提示这些临床指标对两者的鉴别诊断价值不大。病灶边缘清晰与否及肿瘤质地的差异无统计学意义,这与两者均为低分化肿瘤、恶性程度较高、病灶侵袭性较强而使肿瘤包膜完整性下降有关[11],同时高级别pNET 及低分化PDAC 均易出现坏死、囊变[1,12]。PDAC 具有更强的侵袭性,常呈浸润性生长,易累及周围组织、血管。本研究中低分化PDAC 和G3 pNET 患者胰周侵犯情况差异有统计学意义。上游主胰管扩张在低分化PDAC 更明显,差异有统计学意义,与PDAC 肿瘤起源于导管上皮、破坏胰管形成肿块阻塞胰管、引起上游胰管扩张有关,而pNET 起源于胰岛细胞,其出现的胰管扩张常为肿块较大而致的压迫性扩张[1,13]。
低分化PDAC 和G3 pNET 常表现为乏血供,动脉期肿瘤强化程度低于周围正常胰腺实质,但两者门静脉与延迟期强化特征差异有统计学意义,低分化PDAC 主要表现为门脉期低强化及延迟期渐进强化或持续低强化,而G3 pNET 门脉期及延迟期表现为高或等强化,这与Jeon 等[8]报道的结果一致。G3 pNET 因病理级别高往往侵袭性更高,发生肝脏转移的情况更常见,而PDAC 亦常出现肝脏转移。本研究中,G3 pNET 肝转移率较低分化PDAC 更高,这可能与纳入的低分化PDAC 患者的分期不一致相关,部分PDAC 患者虽为低分化,但仍属于早期,尚未发现肝转移。
基于DWI 图像计算的ADC 值是评估组织内水分子扩散程度最常用且稳定的参数,可区分良恶性病变及不同恶性程度的组织,对胰腺肿瘤进行全容积ADC 直方图分析,可提取较平均ADC 值更全面的信息。本研究结果显示,2 组ADC 直方图参数ADCmean、ADCmin、ADCmax、ADC10%、ADC50%、ADC90%差 异有统计学意义,与Kim 等[14]的研究结果一致,而与王英伟等[15-16]的结果相反,需注意的是上述研究均未对pNET 进行病理分级分析,而本研究仅纳入了G3 pNET 患者,可解释结果不一致的原因。pNET 是一类异质性明显的肿瘤,Wang 等[17-18]研究证实,随病理级别增高,水分子扩散受限程度增加,以G3 pNET 扩散受限最显著,其肿瘤细胞排列更密实,胞核胞质比增加,因而水分子扩散受限程度更显著。而马露等[19]研究表明,PDAC 的体素内不相干运动成像参数D值高于乏血供pNET,认为与PDAC 肿瘤内腺管样结构增生、水分子扩散自由度增加、肿瘤扩散受限下降有关,可解释本研究中G3 pNET 组ADC 直方图参数值明显低于低分化PDAC 组的结果。
本研究的局限性:①为单中心研究且样本量较小,未纳入pNET 其他级别乏血供肿瘤,而G3 pNET发病率低,这可能会对结果产生偏差,有待通过多中心大样本对结果进一步验证;②未对患者血液肿瘤指标,如CA19-9 等进行分析,这些亦是两者的影响因素。
综上所述,全容积ADC 直方图参数和多种MRI征象可鉴别低分化PDAC 和G3 pNET,MRI 征象中强化模式、ADC 直方图参数中ADCmean对两者鉴别诊断效能较高,而以ADC 直方图参数联合MRI 征象效能最高,可为两者鉴别提供更有价值的参考信息。
