Pin1相互作用的长非编码RNA lncPIL-1调控乳腺癌恶性表型的研究
2022-05-24赵炜罗曼莉
赵炜,罗曼莉
乳腺癌是目前全世界范围内发病率最高的恶性肿瘤之一。尽管由于新辅助化放疗的应用,乳腺癌患者5 年生存率略有升高,但统计数据显示,在20 至59 岁的女性中,乳腺癌仍排在癌症导致死亡的首位,同时,在60 岁以上女性人群中,其在癌症死亡原因中的排位仅次于肺癌[1]。肿瘤耐药、复发和转移是导致恶性肿瘤患者死亡的重要原因,统计数据显示目前乳腺癌患者中40%会复发,其中10%~20%是局部复发,60%~70%是远处转移[2]。肿瘤干细胞是存在于恶性肿瘤中的一类具有强大的成瘤能力、自我更新能力和多向分化潜能的细胞,其在肿瘤的发生发展、耐药和复发转移过程中起着不可忽视的作用[3]。寻找新的分子靶点对乳腺癌患者的治疗及预后有着重要的临床意义。
发生于蛋白丝/苏-脯氨酸基序的磷酸化在蛋白调节细胞生长和转化中起着重要作用。这些发生磷酸化的蛋白丝/苏-脯氨酸基序存在顺反两种构型,而细胞中起着重要作用的激酶、磷酸酶等只能识别某种特异构型的底物[4]。肽基脯氨酰顺反异构酶Pin1(Peptidylprolyl Cis/Trans Isomerase,NIMA-Interacting 1)则可催化磷酸化的该基序发生顺反异构从而影响蛋白的细胞定位、活性、稳定性及与其他蛋白的相互作用。这些被Pin1 调控的磷酸化蛋白的改变与细胞存活、凋亡、增殖、代谢、迁移、周期进展和肿瘤发展密切相关[5]。Pin1 在人类乳腺癌中过表达,它的过表达可导致细胞周期蛋白D1 的上调并协同促进乳腺上皮细胞的转化,而抑制Pin1 则可抑制乳腺上皮细胞的转化[6]。有研究显示敲除Pin1 可有效抑制小鼠肝癌细胞增殖和肿瘤生长[7,8]。还有研究显示抑制Pin1 表达能有效减少胃肿瘤干细胞,并抑制其自我更新和体内外致瘤能力,并且与这些表型相一致,Pin1 在生化上靶向上皮间质转化和肿瘤干细胞中的多个信号分子和生物标志物[9,10]。
长非编 码RNA(Long non-coding RNAs,lncRNAs)指的是长度在200 个核苷酸以上、不编码功能性蛋白质的RNA,其广泛存在于基因组中[11]。LncRNA 的表达具有组织和时空特异性,且其在发挥作用时,不论是哪种形式,常常是调控某种功能相关的少数基因表达或几个相关蛋白在具体细胞事件中的功能[12]。尽管lncRNA 在乳腺癌中的生物学作用及临床意义仍尚未知,但已有研究显示LncRNA ANCR 可以通过介导EZH2 的降解减弱乳腺癌的转移能力[13];此外,lncRNA AGAP2-AS1 在乳腺癌中表达上调,并与曲妥珠单抗耐药相关[14]。由于此种对特定细胞功能的调控的高特异性,LncRNA 具有极高的成为高特异性低副作用的治疗靶点的潜力,因此成为我们的主要实验对象。
鉴于Pin1 在肿瘤发生发展中的重要作用,本研究拟找寻与Pin1 特异性结合的lncRNA,并初步探索与Pin1 相互作用的lncRNA 对乳腺癌细胞增殖、迁移能力及肿瘤干细胞表型的影响,为寻找乳腺癌新的治疗靶点提供了新的依据。
1 材料与方法
1.1 主要材料与试剂
乳腺癌细胞系MDA-MB-231、MDA-MB-468、MCF-7、BT549 购于ATCC。
1.2 方法
1.2.1 细胞培养和细胞转染 所有细胞培养均使用含10%胎牛血清的DMEM 培养基,培养箱条件设置在37℃恒温、5%CO2。转染时取适量细胞种于六孔板中,待其处于对数生长期时,分别加入si-NC(阴性对照si-RNA)和si-lncPIL-1 与LipofectamineTM2000 的混合液,转染48 h 后进行后续实验。
1.2.2 建立lncPIL-1 过表达细胞系 根据lncPIL-1全长序列设计引物,可通过NCBI 中的Gene 数据库获得基因序列,克隆到过表达载体pc DNA 3.1中,由此合成过表达质粒。将空载载体及过表达载体包裹成慢病毒后转染细胞,使用嘌呤霉素对细胞进行筛选。
1.2.3 平板克隆 以适当的细胞密度种于六孔板中,在培养箱中孵育7 d 后,将培养液吸出,用PBS小心清洗1 次,用4%多聚甲醛固定10 min,去固定液后用0.005%龙胆紫染色15 min,然后去除染液,干燥后进行观察。
1.2.4 Transwell 侵袭迁移实验 消化计数细胞,用无血清1640 培养基重悬,下室加600 μL 血清,上室加100 μL 细胞悬液,每孔约10 000~15 000 细胞,1~2 h 后检查小孔下是否有小气泡,12~20 h 后取出上室,用棉球蘸PBS 轻轻擦洗上室5 次,用甲醇固定20 min,去除固定液后用结晶紫染色5 min,水洗3~5 次。在显微镜下拍摄至少三个随机视野,对细胞进行计数统计。
1.2.5 RNA 提取及qRT-PCR 检测 用Trizol 提取RNA,使用Evo M-MLV 反转录试剂将其逆转录为cDNA,再用PCR 仪进行PCR 反应扩增,计算RNA的相对表达水平。lncPIL-1 引物序列为上游:5′TTTCCTGGCTGTTTTCCCCA3′;下 游:5′ACGAATGAGTGAACTCCTGGC3′。
1.2.6 RNA 结合蛋白免疫沉淀(RIP)和紫外交联免疫沉淀(CLIP)及深度测序 收集细胞后使用加入了蛋白酶抑制剂、EDTA 以及RNA 酶抑制剂的IP lysis buffer 裂解细胞。离心蛋白裂解液,取上清蛋白液,分作Flag 组、HA 组和IgG 组。加入磁珠预清洗30 min 后,分别加入Flag 抗体或HA 和IgG 抗体,室温旋转混合4h,然后加入磁珠,室温旋转混合2 h。磁力架上吸除上清,并用IP lysis buffer 洗涤磁珠。加入蛋白酶K 去除蛋白后,加Trizol LS 提取RNA,进行后续分析。总RNA 送安诺基因公司进行Illumina 高通量测序。
做CLIP 实验时,在裂解细胞前先进行紫外交联,条件设置为254 nm 紫外线,150 mJ/cm2,40 s,后续步骤同上。
1.2.7 ALDEFLUOR 试剂分选ALDH1+细胞 消化获取细胞,调整细胞浓度,加入5 μL Aldefluor 反应剂,充分混匀;取另一干净EP管,加入5 μL Aldefluor反应抑制剂DEAB,将上述加了5 μL Aldefluor 反应剂的细胞悬液500 μL 加到该EP 管中,充分混匀,37 ℃水浴锅中孵育40 min 后离心,加入200 μL Aldefluor 缓冲液,用流式细胞仪进行分选。
1.3 数据分析
用GraphPad Prism 9 软件对本实验所得结果进行统计学分析及绘图,实验结果的组间对比采用t检验,若P<0.05 则认为差异具有统计学意义。
2 结 果
2.1 lncPIL-1 与Pin1 特异性结合并在乳腺癌细胞中高表达
为了检测与Pin1 特异结合的lncRNA,我们首先在乳腺癌细胞MCF-7 内过表达Flag-Pin1 或HAPin1,分别使用Flag 和HA 的特异性抗体进行免疫沉淀实验,获得与Flag-Pin1 或HA-Pin1 结合的RNA,然后实施高通量测序即RIP-seq策略。通过对Flag-Pin1 或HA-Pin1 富 集到的RNA 与IgG 组对比,我们发现了一批与Pin1 存在相互作用的lncRNA,按其富集丰度排列选取排名前40 位的lncRNA 进行初步的探索(表1)。接下来我们做了进一步的RNA 结合蛋白免疫沉淀(RIP)实验,通过qRT-PCR方法验证(表2)。并进一步通过紫外交联处理再进行免疫沉淀(CLIP),找寻与Pin1 直接结合的lncRNA(表3)。同时,我们查阅TANRIC 数据库得到这些lncRNA 的生存曲线信息,如图1 所示,Log-Rank 检验P 值小于0.05,说明高、低表达两组生存曲线差异具有统计学意义,提示此lncRNA 与乳腺癌患者预后不良有着极高的相关性。因此,综合考虑以上结果,我们选取这条lncRNA,将其命名为lncPIL-1(Pin1-interacting LncRNA-1),作为后续研究的主要对象。
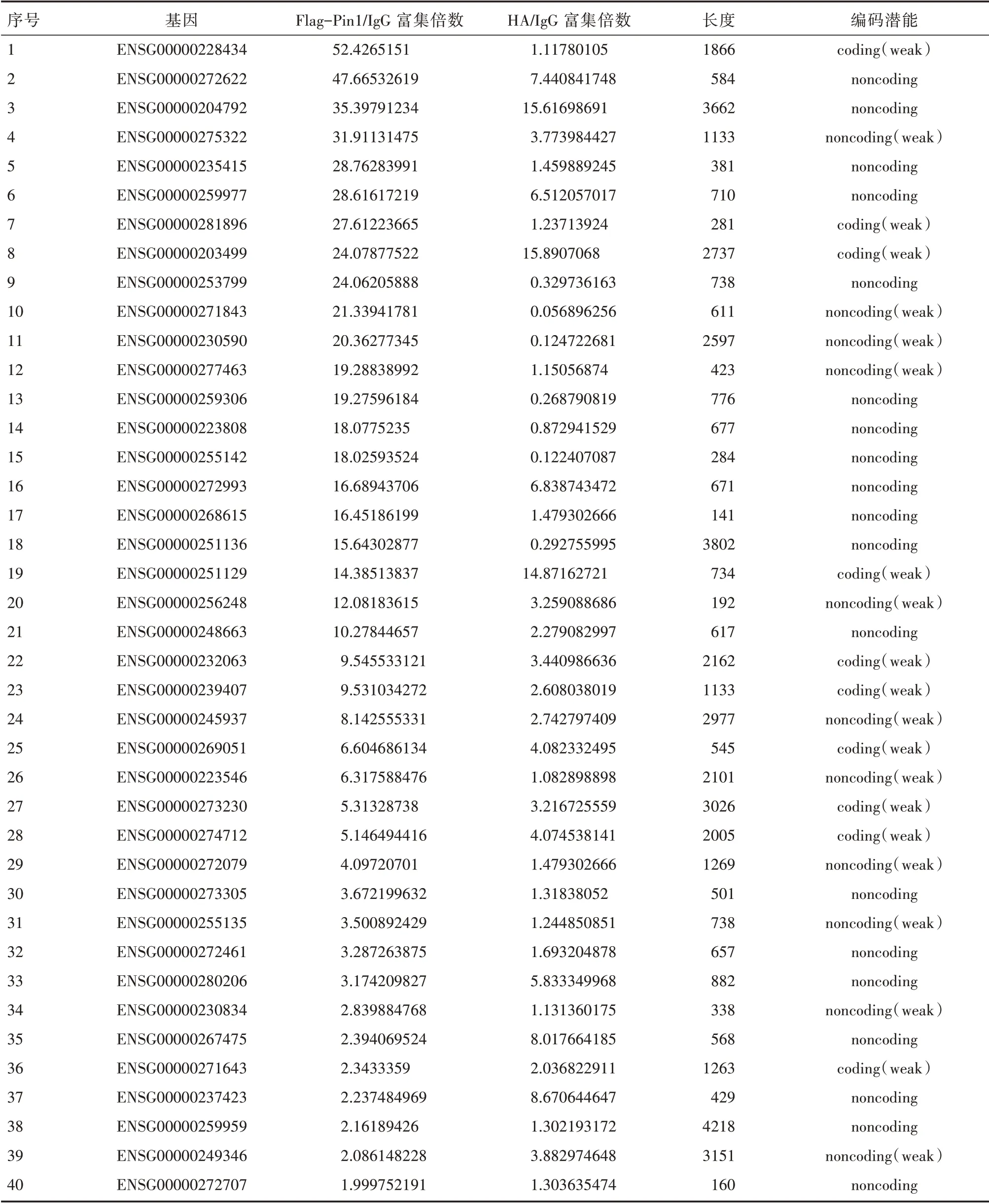
表1 RNA 免疫沉淀联合深度测序(RIP-seq)结果
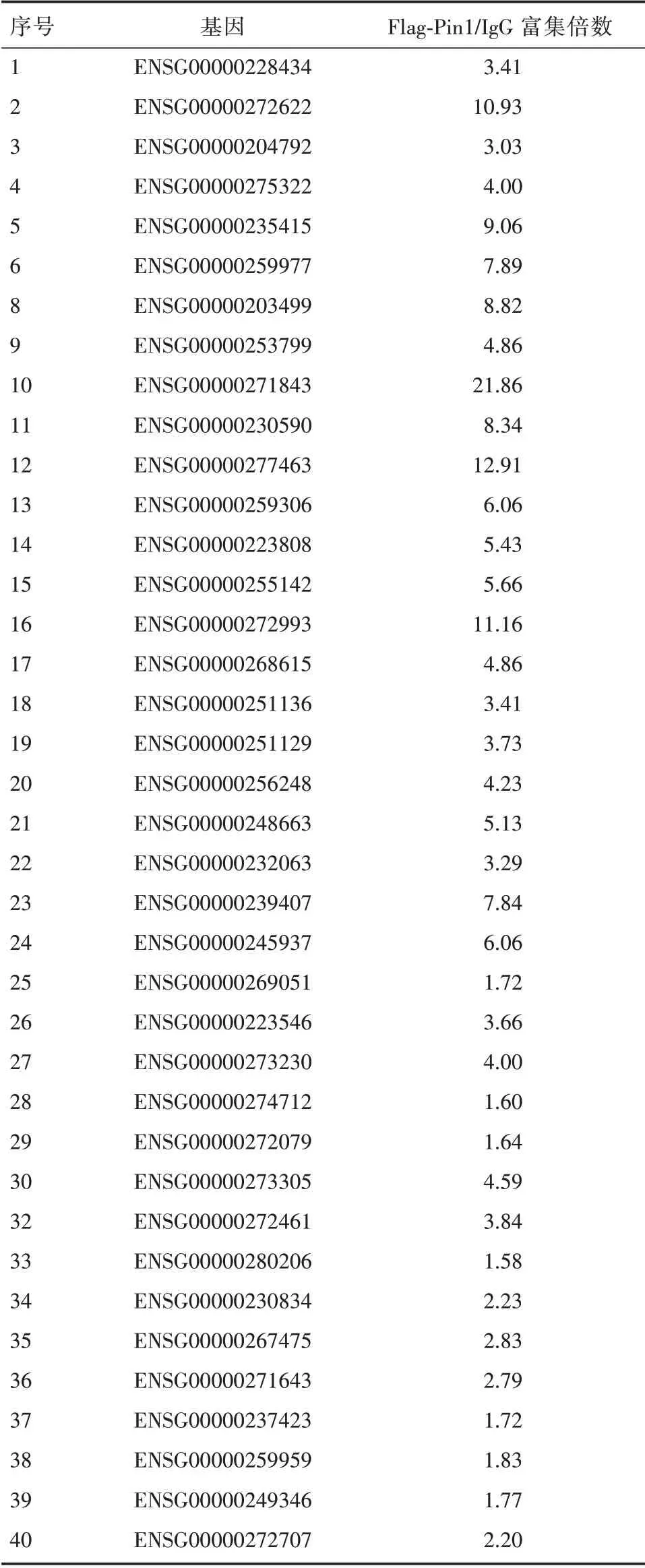
表2 RNA 结合蛋白免疫沉淀(RIP)联合qRT-PCR 实验结果
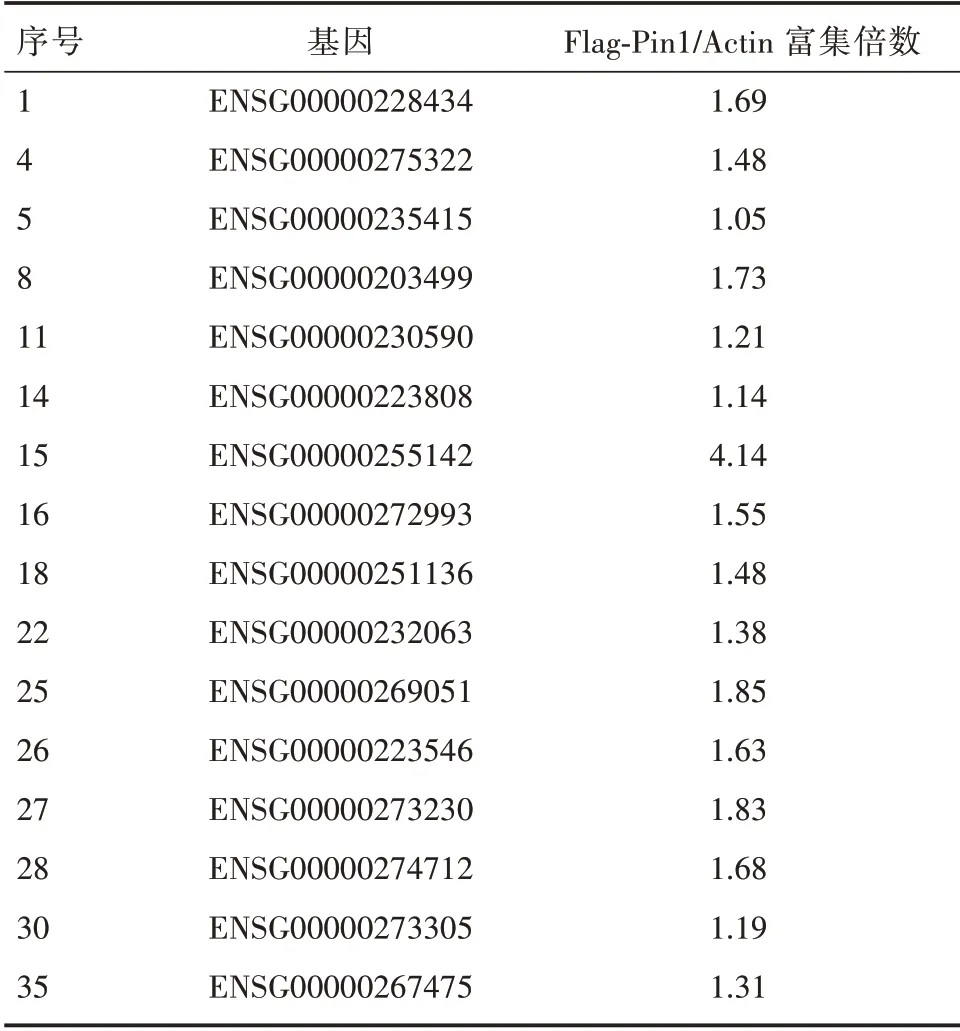
表3 紫外交联免疫沉淀(CLIP)联合qRT-PCR 实验结果
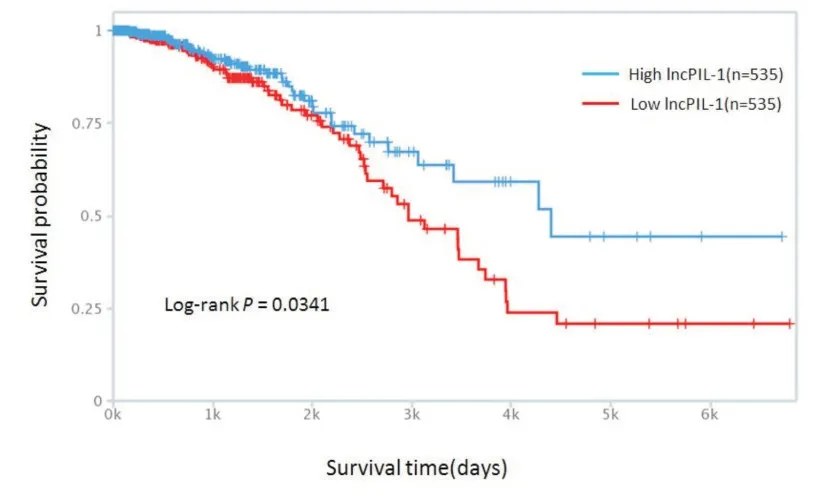
图1 乳腺癌患者lncPIL-1 的生存分析图 浅色折线代表
2.2 lncPIL-1 在乳腺癌细胞系中的过表达和敲降效率
为了探究lncPIL-1 对乳腺癌发生发展的影响,我们在不同乳腺癌细胞系分别对lncPIL-1 进行了过表达和敲降处理。通过对乳腺癌细胞MDA-MB-231、BT549 进行慢病毒质粒转染,我们得到了相应的lncPIL-1 过表达细胞株,通过qRT-PCR 检测其过表达效率,显示lncPIL-1 表达显著上调,与对照组相比,分别上调了约3500、30 倍(图2-A、B)。使用对照和lncPIL-1 siRNA 转染乳腺癌细胞MDAMB-468、MCF-7,我们得到敲降细胞株,通过qPCR检测显示lncPIL-1 表达显著下调,分别约下调为对照组的55%、25%(图2-C、D)。
2.3 lncPIL-1 对乳腺癌细胞增殖无明显影响
Pin1 对乳腺癌细胞生长有明显的促进作用,为了探究lncPIL-1 是否也影响乳腺癌细胞的增殖能力,我们对乳腺癌细胞BT549 和MDA-MB-231 进行了平板克隆形成实验。结果显示与对照组相比,过表达lncPIL-1 细胞株的克隆数并无显著增长(图3),提示lncPIL-1 对乳腺癌细胞的增殖水平无明显影响。
2.4 过表达lncPIL-1 可增强乳腺癌细胞的迁移和侵袭能力,反之亦然
Pin1 可促进乳腺癌细胞运动迁移,为了探究lncPIL-1 是否影响乳腺癌细胞的迁移能力,我们进行了Transwell 实验。结果显示在乳腺癌细胞MDAMB-231、BT549 中,与对照组相比,过表达lncPIL-1后穿过小室的乳腺癌细胞数明显增多(图4-A、B、D、E)。同时在乳腺癌细胞MDA-MB-468 中,与对照组相比,敲降lncPIL-1 后穿过小室的乳腺癌细胞数明显减少(图4-C、F)。提示过表达lncPIL-1会加强乳腺癌细胞的运动迁移能力,而敲降lncPIL-1 会降低乳腺癌细胞的迁移能力。
2.5 敲降lncPIL-1 抑制乳腺癌干性表型
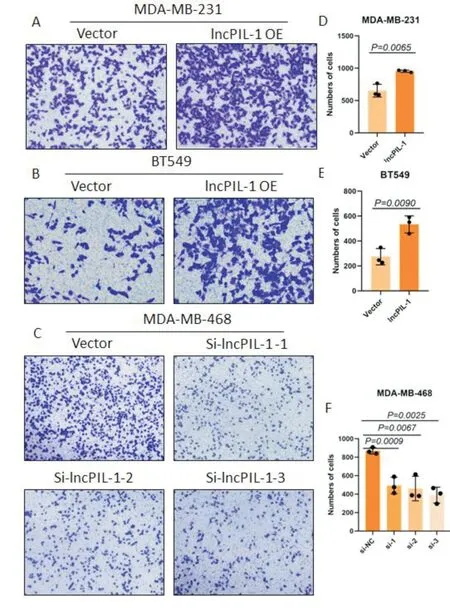
图4 Transwell 实验检测lncPIL-1 对乳腺癌细胞迁移能力的影响 A、B 分别为乳腺癌细胞MDA-MB-231、BT549 的对照组和lncPIL-1 过表达组经Transwell 实验处理15 h、10 h 后的在显微镜下拍摄的图片;D、E 为图片中细胞数量的统计分析;C 为乳腺癌细胞MDA-MB-46 的对照组和3 个si-lncPIL-1 敲降组经Transwell 实验处理15 h 后的在显微镜下拍摄的图片;F 为图片中细胞数量的统计分析
促进乳腺癌干细胞自我更新是Pin1 蛋白的重要功能之一,为了探究lncPIL-1 是否也影响乳腺癌干细胞的功能,我们利用ALDEFLUOR 试剂盒检测富含乳腺癌干细胞的ALDH+细胞比例。分别使用阴性对照试剂DEAB 和Aldefluor 反应剂处理乳腺癌细胞MCF-7,然后进行流式细胞术分选ALDH+细胞,对结果进行统计学分析。与对照组相比,敲降lncPIL-1 后,ALDH+细胞数量明显下降(图5)。这提示敲降lncPIL-1 会抑制乳腺癌细胞干性表型。
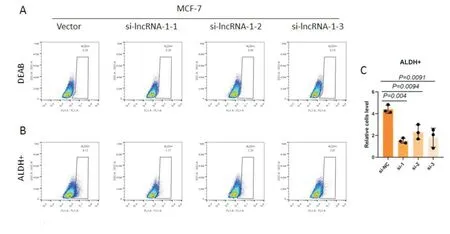
图5 流式细胞术分选ALDH1+细胞 A 为乳腺癌MCF-7 si-NC 和3 个si-lncPIL-1 敲降株经DEAB 处理后作为阴性对照组做流式分选后的图像;B 为乳腺癌MCF-7 si-NC 和3 个si-lncPIL-1 敲降株作为实验组经Aldefluor 反应剂处理后做流式分选后的图像;C 为ALDH+细胞比例的统计分析
3 讨 论
乳腺癌是女性中最常见的恶性肿瘤,其发生发展及转移机制现仍未有准确的认知。大量研究证实,Pin1 在60 余种人恶性肿瘤中表达升高,其中20 余种恶性肿瘤中,30%的病例呈现高表达,在乳腺癌、前列腺癌、肺癌和结肠癌中Pin1 过表达与患者的不良预后密切相关[15,16]。Pin1过表达于大多数人类乳腺癌中,其促进乳腺癌细胞的增殖、侵袭和迁移能力,并对肿瘤干细胞的维护至关重要[17]。
以往对Pin1 与底物的相互作用的研究主要集中在蛋白层面[18],为探索lncRNA 是否在Pin1 与底物的相互作用中起到指引、调控作用,本实验中我们系统地研究和鉴定了与Pin1 结合的lncRNA,首先通过Pin1 的RNA 结合蛋白免疫沉淀获取与Pin1 结合的lncRNA,并对这些RNA 进行测序(RIP-seq),初步获得其信息。随后,我们进一步进行了RIP 和CLIP 实验去验证这些lncRNA 与Pin1 的特异性结合能力,综合考虑通过文献找寻得到的其与乳腺癌患者不良预后的相关性的结果,我们选定了一条lncRNA 作为本实验的研究对象,将其命名为lncPIL-1。我们建立了lncPIL-1 的敲降和过表达细胞系来研究其对肿瘤细胞功能的影响。通过平板克隆实验,我们发现lncPIL-1 对乳腺癌细胞的增殖能力无明显影响。这提示lncPIL-1 与Pin1 的功能途径可能存在不同。通过Transwell 实验,我们发现过表达lncPIL-1 后,乳腺癌细胞的侵袭迁移能力明显增强,而敲降lncPIL-1 后,癌细胞的侵袭迁移能力明显下降,这提示lncPIL-1 发挥功能可能与肿瘤的转移有关。
肿瘤干细胞的存在是导致肿瘤治疗失败和转移的主要原因之一[19,20]。已有研究表明,乳腺癌中Pin1 促进乳腺癌干细胞自我更新和致瘤能力[21,22]。目前认为三种干细胞标志物CD44、CD24和ALDH1 在预测包括转移风险和总生存率在内的乳腺癌患者预后方面具有巨大的价值[23]。在本实验中,为了探究lncPIL-1 与肿瘤干细胞的关系,我们进行了检测肿瘤干性能力的ALDEFLUOR 实验,结果显示敲降lncPIL-1 后,ALDH+细胞数量明显下降。这提示lncPIL-1 可能参与Pin1 调控乳腺癌干细胞的病理过程[24]。
综上所述,长非编码RNA lncPIL-1 与Pin1 特异性结合,在乳腺癌细胞中高表达,并与乳腺癌患者预后不良高度相关。在乳腺癌细胞MDA-MB-231、BT549 中,过表达lncPIL-1 不影响细胞生长,但会加强乳腺癌细胞的运动迁移能力,同时在乳腺癌细胞MDA-MB-468 中,敲降lncPIL-1 会降低乳腺癌细胞的运动迁移能力。在乳腺癌细胞MCF-7中,敲降lncPIL-1 明显抑制乳腺癌细胞干性表型。这提示lncPIL-1 与Pin1 蛋白功能大致相似,但也存在差异,可能是Pin1 蛋白在促进肿瘤转移和干性表型方面相互作用的lncRNA,是乳腺癌发生发展过程中的重要调控因子,有望成为乳腺癌新的治疗靶点。
