基于聚类分析和主成分分析的吴茱萸及制吴茱萸指纹图谱研究
2022-05-24马向慧姜恒丽王双双康亚娟陈云龙曹丽娟
马向慧,刘 烨,姜恒丽,王双双,康亚娟,陈云龙,曹丽娟
基于聚类分析和主成分分析的吴茱萸及制吴茱萸指纹图谱研究
马向慧,刘 烨,姜恒丽,王双双,康亚娟,陈云龙,曹丽娟*
盛实百草药业有限公司,天津市中药饮片炮制技术企业重点实验室,天津 300301
建立吴茱萸生品与炮制品HPLC指纹图谱,通过计算相似度,结合化学模式识别方法,评价吴茱萸和制吴茱萸的质量,探讨炮制前后化学成分的差异,阐释吴茱萸炮制后毒性降低的机制。通过高效液相色谱法建立吴茱萸及制吴茱萸的指纹图谱,运用《中药色谱指纹图谱相似度评价系统》(2012版)和SPSS17.0软件对相应图谱进行相似度评价、聚类分析(cluster analysis,CA)和主成分分析(principal analysis,PCA)。吴茱萸和制吴茱萸的指纹图谱相似度均大于0.985,均含有12个相同的共有峰,指认出了其中的5个。以吴茱萸碱为参照峰,比较各共有峰的相对峰面积,发现吴茱萸炮制后除3号峰外,其余共有峰均有不同程度的下降,以2号峰和10号峰有显著性下降。聚CA结果显示,吴茱萸生品可分为2大类,其中来源于江西的为一类,来源于浙江和湖南的为一类;经PCA分析,前3个主成分因子的累积方差贡献率为87.405%,以2、5(绿原酸)、6(金丝桃苷)、7、8(柠檬苦素)、9(吴茱萸碱)、10(吴茱萸次碱)和12号峰对吴茱萸炮制前后化学成分差异变化的贡献较大。吴茱萸HPLC指纹图谱的构建及化学模式识别可为阐释吴茱萸炮制后毒性降低机制提供科学依据。
吴茱萸;制吴茱萸;指纹图谱;聚类分析;主成分分析;绿原酸;金丝桃苷;柠檬苦素;吴茱萸碱;吴茱萸次碱
吴茱萸为常用的温里药,又名食茱萸、吴萸、茶辣、漆辣子等,来源于芸香科植物吴茱萸(Juss.) Benth.、石虎(Juss.) Benth.var.(Dode) Huang或疏毛吴茱萸(Juss.) Benth.var(Dode) Huang的干燥近成熟果实。《中国药典》2020年版[1]记载吴茱萸饮片有吴茱萸和制吴茱萸2种规格,能散寒止痛、降逆止呕、助阳止泻,主要治疗厥阴头痛、寒疝腹痛、寒湿脚气等病症。研究表明[2],吴茱萸具有保护心肌、抑制血管生成、扩张血管、抗胃肠道溃疡、保护卵巢等药理作用,在临床上有较好的治疗效果。然而,吴茱萸有小毒,若炮制不当、超剂量服用或配伍不当均可引起不良反应,以肝脏损伤居多。实验显示,与吴茱萸生品相比,通过甘草制、盐制均能降低生品的肝毒性作用[3],但对于吴茱萸的主要致毒性成分和炮制减毒机制现有研究尚未明确。
目前对于吴茱萸及其炮制品的研究,主要集中在其炮制方法、药理作用、毒理机制方面,而采用HPLC指纹图谱结合化学识别模式分析吴茱萸炮制前后成分变化的报道甚少,因此本课题拟采用指纹图谱技术建立吴茱萸、制吴茱萸各10批次的指纹图谱,进行相似度评价,结合化学模式识别方法,探究吴茱萸炮制后化学成分的变化,进而为阐释吴茱萸炮制后毒性降低机制提供科学依据,为临床安全使用提供参考。
1 仪器与试药
1.1 仪器
Waters2695型高效液相色谱仪(美国沃特世科技有限公司),ME-204/02型电子天平(梅特勒-托利多仪器(上海)有限公司),KQ-600DB型数控超声波清洗器(昆山市超声仪器有限公司),DZKW-110型恒温水浴锅(STWK有限公司);H130型冷却水循环装置(莱伯泰科有限公司);XP205型电子天平[梅特勒-托利多仪器(上海)有限公司]。
1.2 试剂
吴茱萸碱(质量分数99.6%,批号110802-201710)、吴茱萸次碱(质量分数99.7%,批号110801-201608)、柠檬苦素(质量分数97.9%,批号110800-201707)、金丝桃苷(质量分数94.9%,批号111521-201809)、绿原酸(质量分数96.8%,批号110753-201817),上述对照品均购自中国食品药品检定研究院。乙腈为色谱纯(德国默克股份两合公司),超纯水(娃哈哈有限公司),磷酸为色谱纯(和光纯药工业株式会社)。
1.3 样品
样品收集来源于江西、浙江和湖南3个产地,经盛实百草药业有限公司曹丽娟高级工程师鉴定为芸香科植物吴茱萸(Juss.) Benth的干燥近成熟果实10批次,对应的炮制品吴茱萸和制吴茱萸均按照《中国药典》2020年版规定的炮制方法加工。

表1 10批次吴茱萸样品及炮制品信息
2 方法与结果
2.1 色谱条件
COSMOSIL C18-MS-II色谱柱(250 mm×4.6 mm,5 μm),流动相:乙腈(B)-0.2%磷酸(A)溶液,梯度洗脱(0~20 min,5%~10% B;20~53 min,10%~30% B;53~58 min,30%~43% B;58~80 min,43%~65% B;80~90 min,65%~100% B),进样量为20 μL,体积流量为1.0 mL/min,柱温为25 ℃,检测波长为220 nm。
2.2 溶液的制备
2.2.1 对照品溶液的配制 分别取吴茱萸碱、吴茱萸次碱、柠檬苦素、金丝桃苷、绿原酸对照品适量,精密称定,加50%甲醇制成母液。各吸取适量母液于100 mL量瓶中,用50%甲醇定容稀释,得各对照品质量浓度分别为80.08、50.10、100.40、48.12、40.28 μg/mL的混合对照品溶液。
2.2.2 供试品溶液的配制 精密称取吴茱萸或制吴茱萸粉末(过三号筛)0.5 g,放置在具塞锥形瓶中,精密加入50 mL的50%甲醇,称定质量,超声40 min,放置至室温,再次称定质量,用50%甲醇补足损失的质量,摇匀。以转速3300 r/min进行离心,10 min后,用0.2 μm的微孔滤膜滤过上清液,取续滤液,即得。
2.3 方法学考察
2.3.1 精密度试验 取吴茱萸样品(W1)适量,按“2.2.2”项配制供试品溶液1份,照“2.1”项下方法连续进样6次,以吴茱萸碱为参照峰,记录各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰的相对保留时间的RSD<2.0%,相对峰面积的RSD<3.0%,表明仪器精密度良好。
2.3.2 重复性试验 取吴茱萸样品(W1)粉末6份,按“2.2.2”项配制供试品溶液,照“2.1”项色谱条件项下方法进行测定,以吴茱萸碱为参照峰,记录各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰的相对保留时间的RSD<2.0%,相对峰面积的RSD<3.0%,表明本方法重复性良好。
2.3.3 稳定性试验 取吴茱萸样品(W1)适量,按“2.2.2”配制供试品溶液,照“2.1”项下方法分别在0、2、4、8、12、24 h进样检测,以吴茱萸碱为参照峰,记录各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰的相对保留时间的RSD<2.0%,相对峰面积的RSD<3.0%,表明供试品溶液在室温下放置24 h内稳定性良好。
3 吴茱萸不同炮制品HPLC指纹图谱的测定
3.1 指纹图谱的建立
取“2.2.1”项下配制的混合对照品溶液,按“2.1色谱条件”项下方法进样,得混合对照品的色谱图,见图1。分别取吴茱萸(W1~W10)、制吴茱萸(ZW1~ZW10),依照“2.2.2”配制供试品溶液,按“2.1”项进样检测,记录数据,并将所得数据导入《中药色谱指纹图谱相似度评价系统》(2012年版)软件,采用平均数法和多点校正法,设置时间宽度为0.10 min,分别生成吴茱萸和制吴茱萸的指纹图谱叠加图和对照图谱,见图2~4。
指纹图谱中,共标定出12个共有峰,其中9号峰峰面积稳定、响应值高、分离度好,故定为参照峰。通过与对照品比对,共指认出5、6、8~10号峰等5个共有峰,依次为绿原酸、金丝桃苷、柠檬苦素、吴茱萸碱和吴茱萸次碱,结果见图4。以9号峰为参照峰,计算各批次样品共有峰的相对峰面积,各共有峰的RSD为16.639%~82.074%。
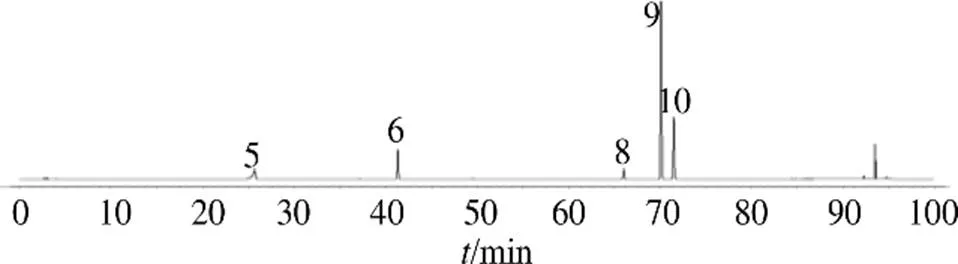
5-绿原酸 6-金丝桃苷 8-柠檬苦素 9-吴茱萸碱 10-吴茱萸次碱
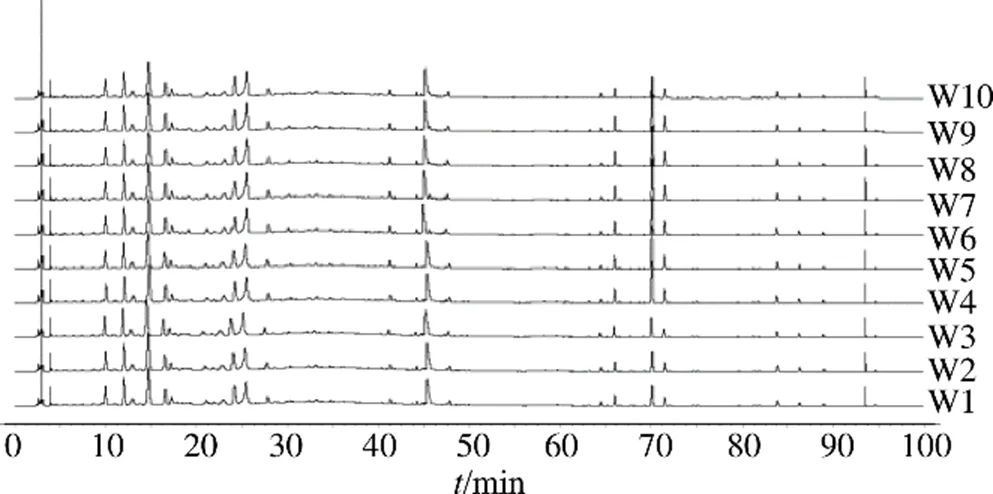
图2 10批吴茱萸样品的HPLC指纹图谱叠加图
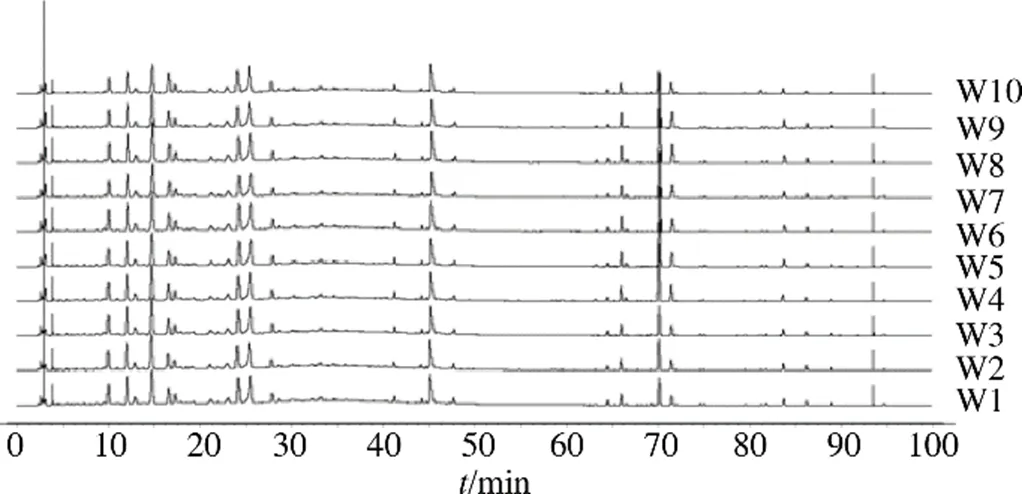
图3 10批制吴茱萸样品的HPLC指纹图谱叠加图
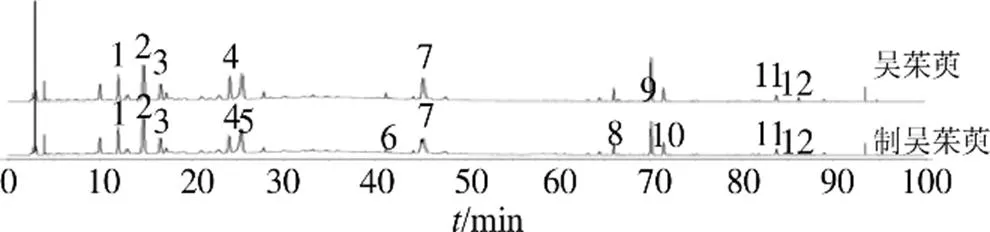
5-绿原酸 6-金丝桃苷 8-柠檬苦素 9-吴茱萸碱 10-吴茱萸次碱
3.2 相似度评价
分别通过10批次吴茱萸和10批次制吴茱萸生成的共有模式为对照指纹图谱,计算各批次之间的相似度,结果见表2。可见10批次吴茱萸的相似度均>0.989,10批次制吴茱萸的相似度均>0.985,表明吴茱萸和制吴茱萸的质量稳定,炮制工艺稳定,生品与生品、炮制品与炮制品之间成分组成差异小。
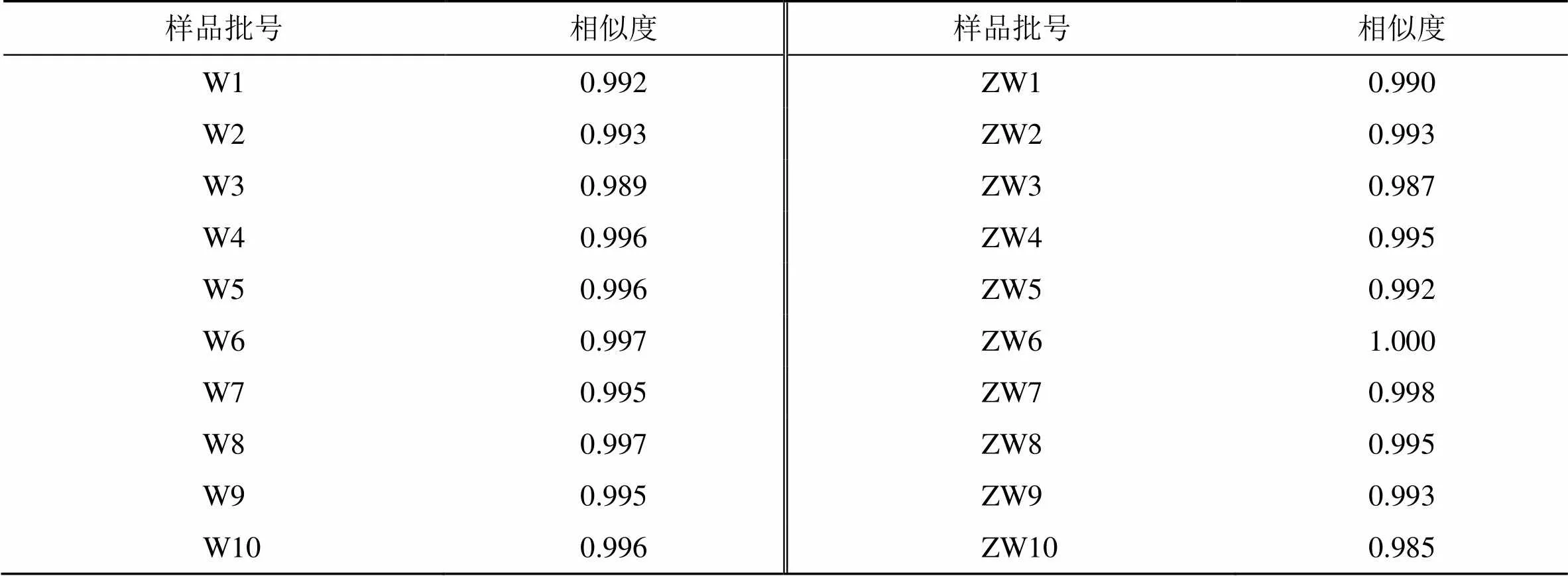
表2 吴茱萸与制吴茱萸指纹图谱相似度结果
3.3 吴茱萸与制吴茱萸各共有峰相对峰面积差异分析
比较吴茱萸与制吴茱萸的共有峰相对峰面积,可知吴茱萸炮制后,1、2、4~7、10~12号峰的相对峰面积均有不同程度的下降,其中2号峰和10号峰(吴茱萸次碱)出现显著性下降,仅3号峰的相对峰面积有增加,但无显著性变化,结果见表3和图5,提示吴茱萸炮制前后毒效发生差异变化可能与这些成分有关。
3.4 系统聚类分析
将10批次吴茱萸饮片共有峰的相对峰面积分别导入SPSS 17.0系统软件,采用组间连接法,选用平方欧氏距离为样品间距离计算方法,进行系统聚类分析,结果见图6。吴茱萸饮片可聚为2大类,W1~W3、W10为一类(均来源于江西),W4~W9为另一类(来源于浙江和湖南),表明江西所产的吴茱萸与其他产地的在质量上存在一定的差异。
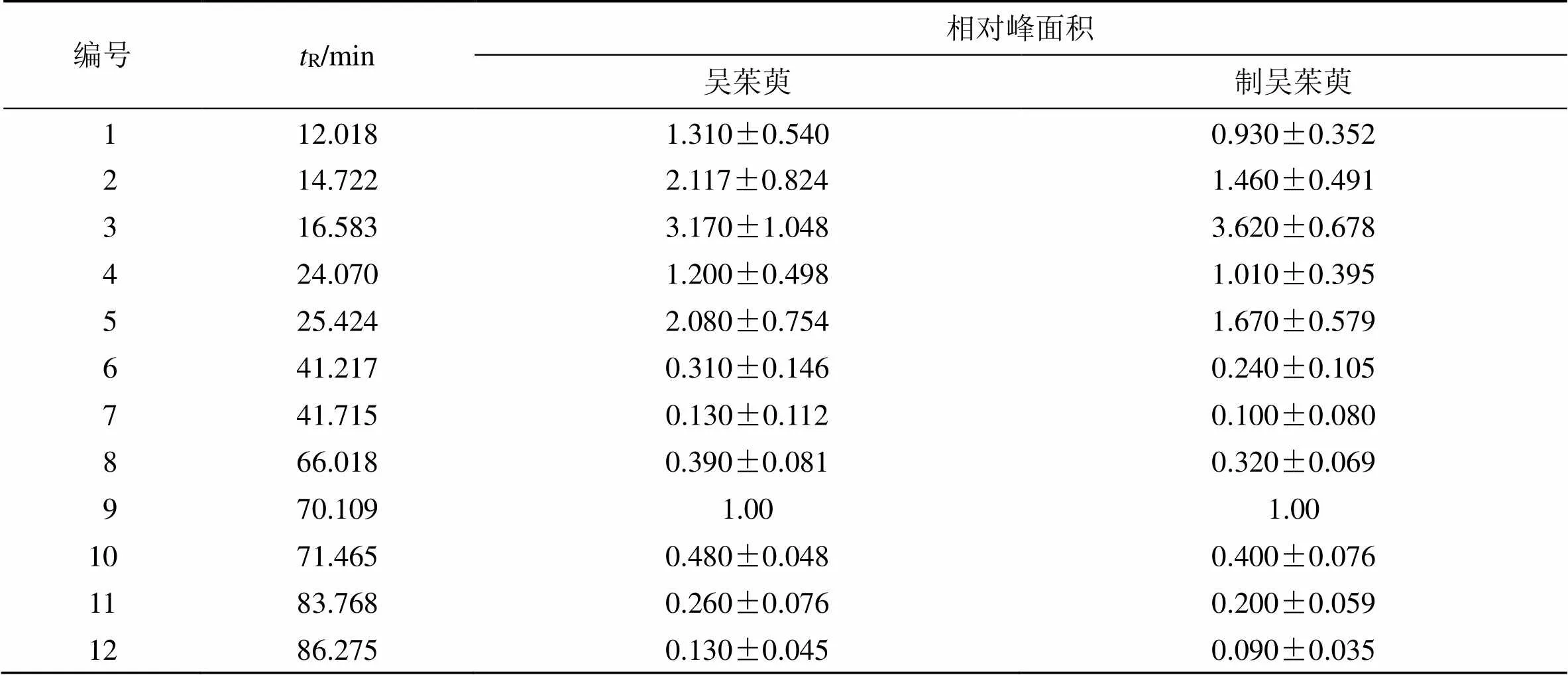
表3 吴茱萸及制吴茱萸共有峰相对保留时间和相对峰面积(n= 10)
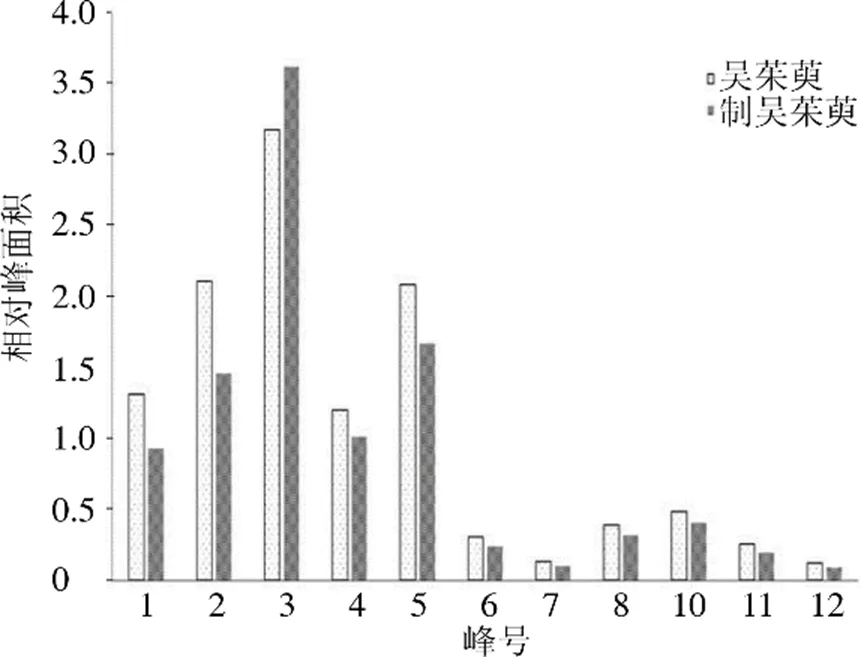
图5 吴茱萸与制吴茱萸相对峰面积均值对比图
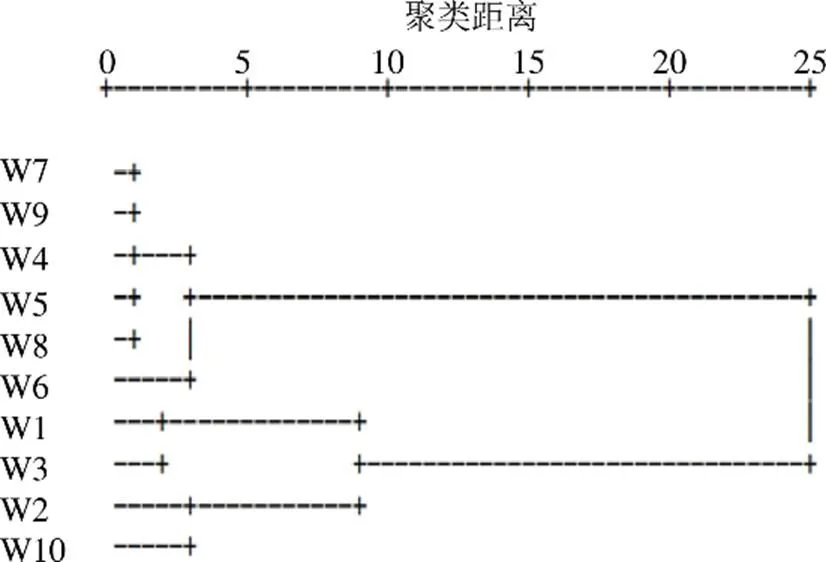
图6 10批吴茱萸样品聚类分析图
3.5 主成分分析
采用SPSS 17.0软件对吴茱萸及制吴茱萸样品(各10批次)的共有峰峰面积进行标准化处理后,以特征值及累积方差贡献率为依据对共有峰进行主成分分析,结果见表4、图7。以特征值>1为提取标准,共得到3个主成分因子,特征值分别为4.907、3.756、1.826,方差百分比分别为40.893%、31.298%、15.215%,累积贡献率为87.405%,且碎石图中前3个特征值的变化曲线陡峭,提示这3个主成分因子能够揭示引起不同批次样品间差异的信息,可作为吴茱萸和制吴茱萸的评价指标。
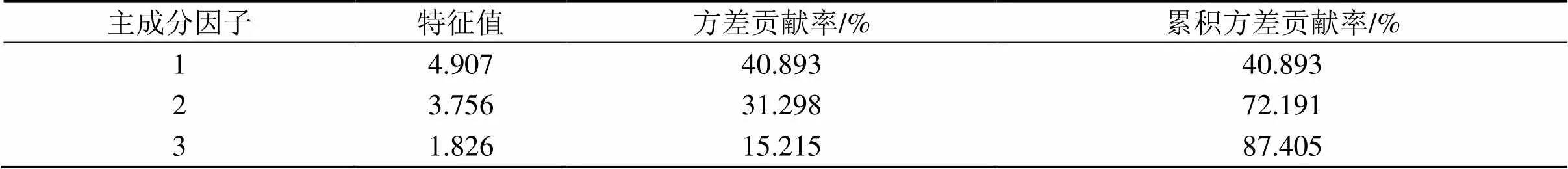
表4 特征值及方差贡献率
由表5可知12个变量均与主成分因子1呈正相关,其中以峰2、峰5(绿原酸)、峰6(金丝桃苷)和峰7对其贡献较大;6个变量与主成分因子2成呈相关,峰8(柠檬苦素)、峰9(吴茱萸碱)和峰10(吴茱萸次碱)对其贡献较大;4个变量与主成分因子3成正相关,峰12对其贡献较大。对上述主成分载荷值进行计算,得出各主成分因子的线性模型。
1=0.34×峰1+0.37×峰2+0.35×峰3+0.28×峰4+0.40×峰5+0.40×峰6+0.38×峰7+0.12×峰8+0.08×峰9+0.07×峰10+0.18×峰11+0.14×峰12
2=−0.21×Z峰1-0.03×Z峰2-0.1×Z峰3-0.05×Z峰4+0.08×Z峰5-0.09×Z峰6-0.17×Z峰7+0.47×Z峰8+0.48×Z峰9+0.48×Z峰10+0.41×Z峰11+0.17×Z峰12
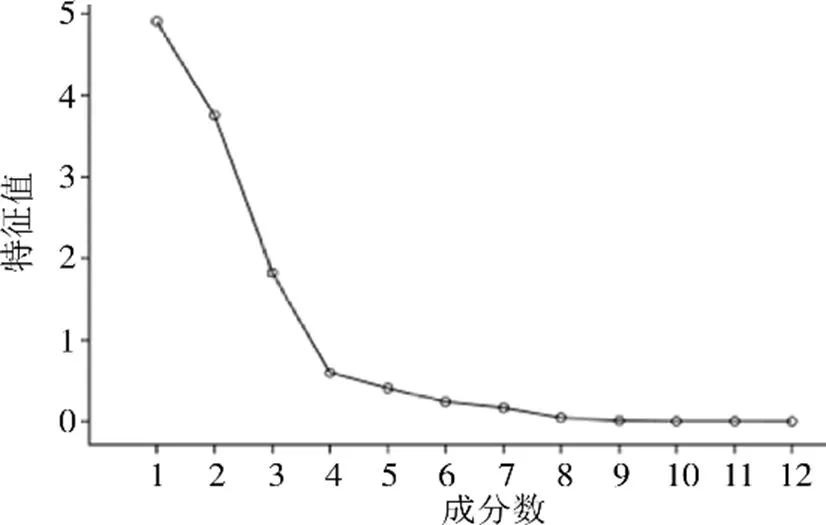
图7 主成分分析碎石图
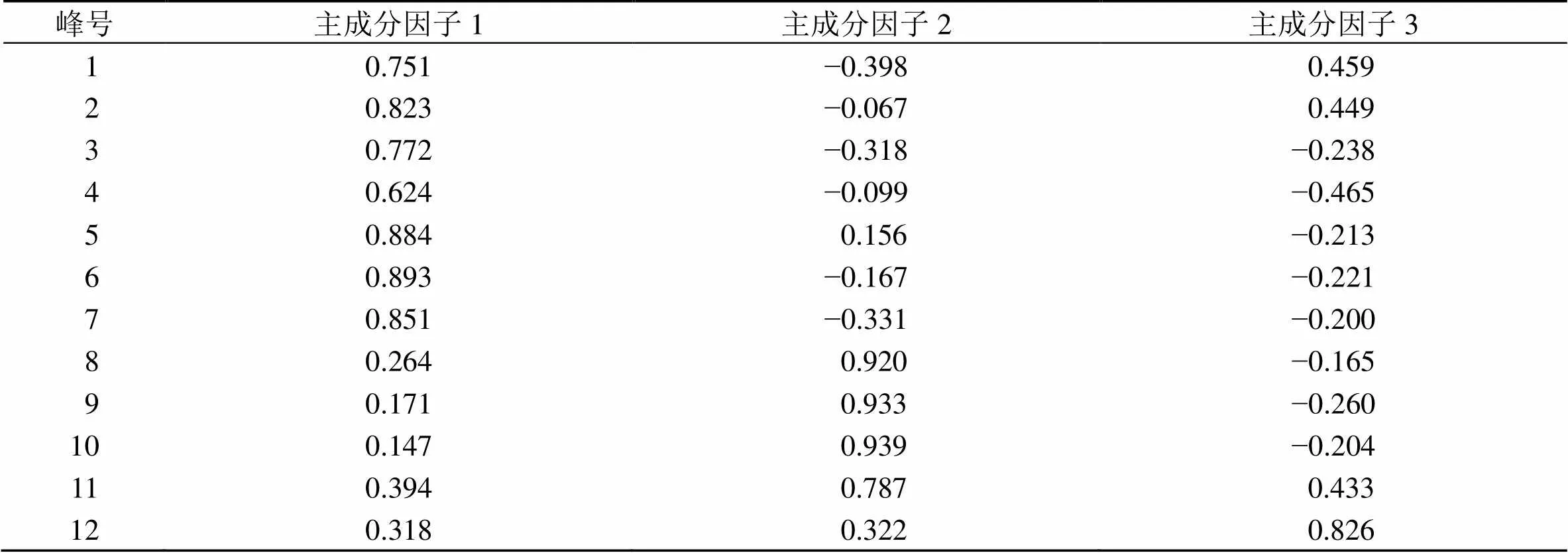
表5 主成分因子载荷矩阵
3=0.34×Z峰1+0.33×Z峰2-0.18×Z峰3-0.34×Z峰4-0.16×Z峰5-0.16×Z峰6-0.15×Z峰7-0.12×Z峰8-0.19×Z峰9-0.15×Z峰10+0.32×Z峰11+0.61×Z峰12
其中,1、2、3分别代表主成分因子1、2、3的综合得分值,Z峰1~Z峰12分别代表12个共有峰峰面积的标准化数值。将各样品数据代入上述计算模型后,可得其主成分得分,结果见表6,以3个主成分因子的得分值为轴、轴和轴建立3D散点图(图8)。结果显示,吴茱萸与制吴茱萸的分布区域明显不同,基本能区分开,说明吴茱萸生品与炮制品在化学成分上存在一定的差异。此外,得分图中W1~W3、W10分布较为集中,W4~W9较为集中,与聚类分析的结果基本一致。
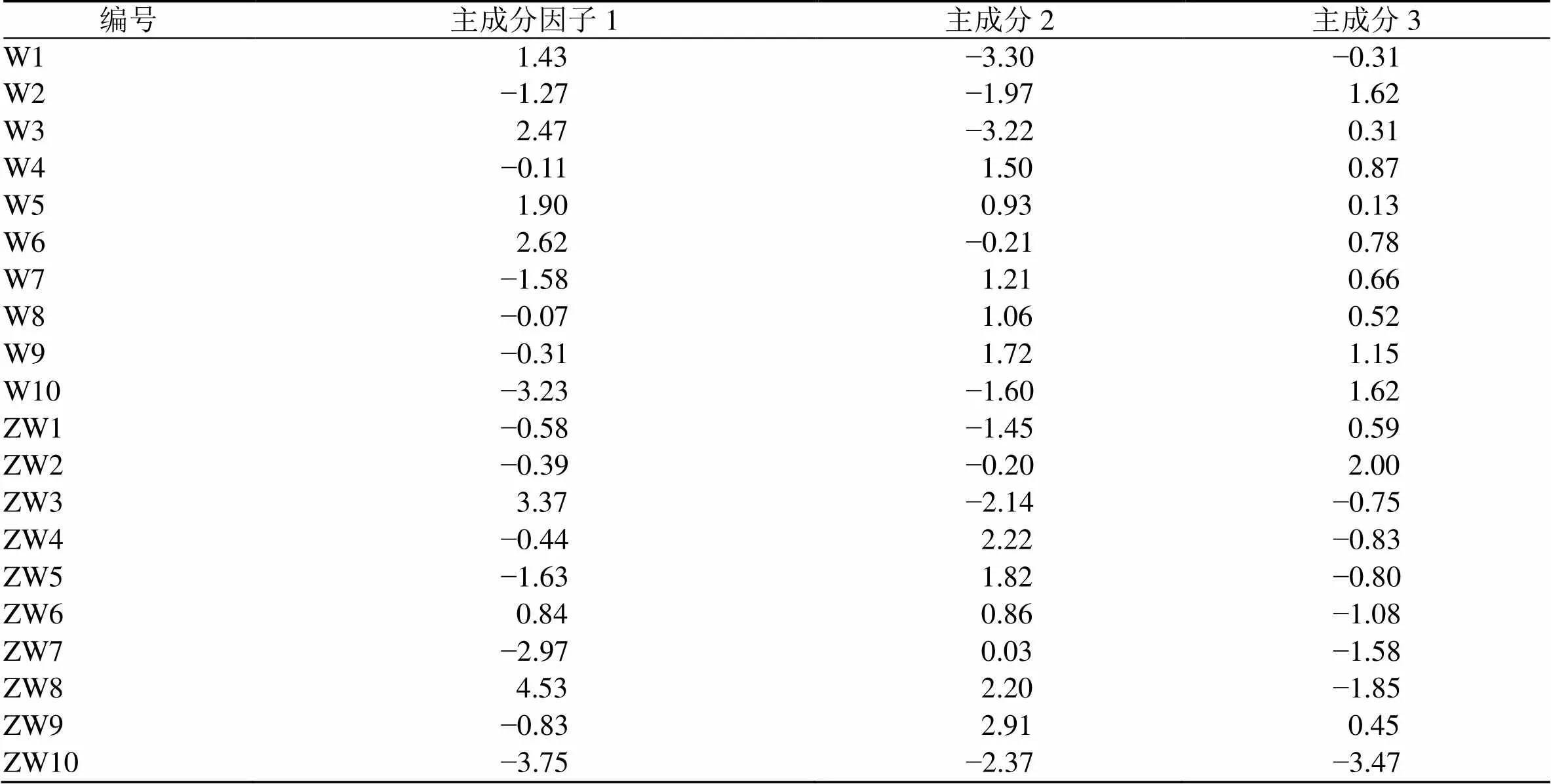
表6 吴茱萸不同炮制品的主成分因子得分
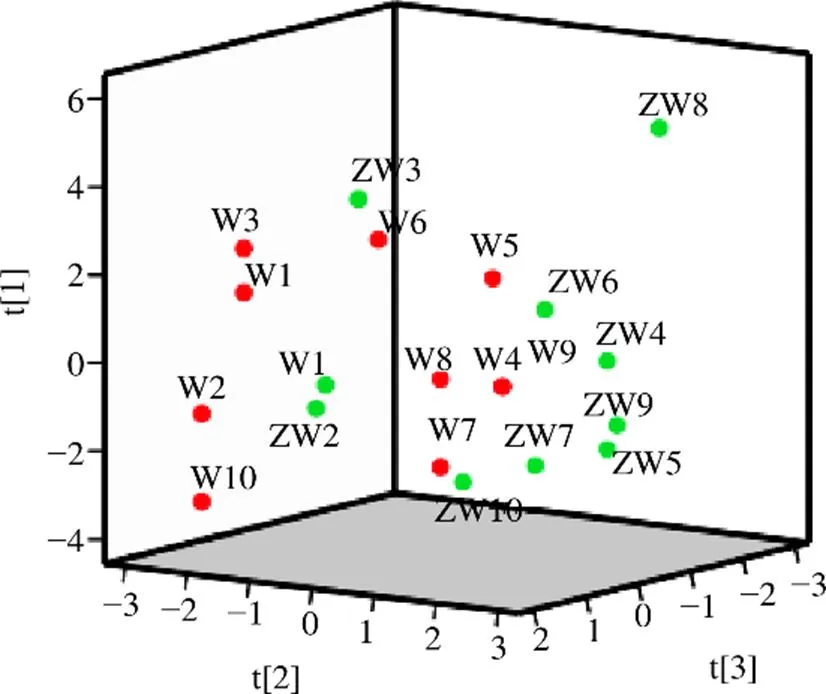
图8 主成分因子得分图
4 讨论
吴茱萸为临床常用中药材,除销往全国外,还有部分出口。据《中药大辞典》[4]、《全国中草药汇编》[5]等记载,吴茱萸原植物以栽培为主,全国各地都有大面积的栽种,主要分布在长江以南的贵州、重庆、湖南、浙江、江西、广西等省区。魏宝阳[6]对上述产地2007—2010年的吴茱萸资源情况进行实地调研,发现由于市场价格、土壤类型等因素的影响,已有大面积的吴茱萸栽培地被人为破坏,以江西的种植规模较大。为体现本项研究的代表性与全面性,前期结合该药材的市场流通现状,除收集了多批次代表性产地江西的吴茱萸药材外,还收集了来源于有一定种植规模产区浙江和湖南的多批次样本。由聚类分析结果可知,10批次吴茱萸样品可分为2大类,W1~W3、W10为一类(均来源于江西),W4~W9为另一类(来源于浙江和湖南),与主成分分析的结果相一致。可见不同产地的吴茱萸在质量上还是存在差异的,推测可能与生长环境不同密切相关。
本研究前期采用DAD检测器对吴茱萸样品进行了190~400 nm的全波长扫描,筛选出最优波长;对不同色谱柱Agilent ZORBAX SB-Aq(Dim:250 mm×4.6 mm,5 μm)、COSMOSIL C18-MS-II(Dim:250 mm×4.6 mm,5 μm)、Agilent Eclipse Plus(Dim:250 mm×4.6 mm,5 μm)、AccurasilC18(Dim:250 mm×4.6mm,5 μm)、Diamonil C18(250 mm×4.6 mm,5 μm)等进行了考察;对不同流动相系统乙腈-磷酸、甲醇-磷酸等进行了筛选;对梯度洗脱条件进行了优化;对不同柱温(20、25、30、35、40 ℃)和不同体积流量(0.6、0.8、1.0和1.2 mL/min)也进行了筛选;同时对样品的提取方法也都进行了考察,包含提取溶剂、提取方式和提取时间3个方面。最终筛选优化出本文所需的色谱条件,建立了吴茱萸及制吴茱萸的指纹图谱,所建方法简便、易操作、重复性好。
通过比较吴茱萸和制吴茱萸的HPLC指纹图谱,发现两者的相似度均大于0.985,说明两者质量稳定,炮制工艺稳定;两者的色谱峰数量无明显变化,有12个共有峰,其中5、6、8、9、10号峰被分别指认出,依次为绿原酸、金丝桃苷、柠檬苦素、吴茱萸碱和吴茱萸次碱。通过比较共有峰的相对峰面积,发现1、2、4、5(绿原酸)、6(金丝桃苷)、7、10(吴茱萸次碱)、11和12号峰在炮制后的相对峰面积均有不同程度的下降,其中2号峰和10号峰(吴茱萸次碱)出现显著性下降,仅3号峰的相对峰面积在炮制后出现增加,却无显著性变化,由此可知吴茱萸炮制后所含化学成分发生了一定程度的量变。
吴茱萸所含化学成分较多,以生物碱类、柠檬苦素类和挥发油类占比最高,其中吴茱萸碱、吴茱萸次碱和柠檬苦素是评价吴茱萸及其炮制品质量优劣的重要指标,临床显示它们也是吴茱萸发挥药效的主要活性成分。文献报道吴茱萸碱具有抗癌、抗炎、抗菌、调脂、舒张血管、改善肥胖、保护神经等药理作用[7],吴茱萸次碱具有保护心脏、扩张血管、降血压、镇痛、抗炎、抗癌、抗抑郁、抗肥胖等药理作用[8],柠檬苦素具有抗胃溃疡、抗炎、镇痛等药理作用[9-10],然而Li等[11]通过网络药理学方法,从吴茱萸药材中筛选出了薯蓣皂苷元、吴茱萸次碱、吴茱萸碱、粉防己碱、柴胡皂苷D等6种可能导致肝损伤的生物碱;李文兰等[12]运用UPLC-Q- TOF-MS法检测吴茱萸的致肝毒性部位,鉴定出吲哚类生物碱、喹诺酮类生物碱、三萜、黄酮、有机酸等29个成分;伊利顺等[13]发现吴茱萸的挥发油组分也可导致动物肝脏损伤;张茜等[14]通过体外和体内实验,发现大剂量的吴茱萸次碱可能对肝肾具有一定的毒性作用。本研究的主成分分析结果显示吴茱萸与制吴茱萸样品分布区域存在明显不同,提示两者的化学成分确实存在差异,并且两者的共有峰中2、5(绿原酸)、6(金丝桃苷)、7、8(柠檬苦素)、9(吴茱萸碱)、10(吴茱萸次碱)和12号峰对吴茱萸炮制前后化学成分差异变化的贡献较大。结合共有峰相对峰面积差异分析的结果及文献报道,推测上述色谱峰所对应的化学成分含量降低可能是降低吴茱萸炮制后毒性的因素,以有显著性降低的2号峰和10号峰(吴茱萸次碱)为主要因素。
综上,本研究建立的吴茱萸及制吴茱萸HPLC指纹图谱,能真实地反映吴茱萸炮制前后化学成分变化,联合聚类分析和主成分分析可为阐释吴茱萸炮制后毒性降低机制提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S].一部.2020: 179.
[2] 魏舒婷, 刘元乾, 黄坚, 等.吴茱萸化学成分、药效及肝毒性的研究进展 [J].世界中医药, 2020, 15(23): 3580-3585, 3592.
[3] 刘舒凌, 张晟瑞, 韦慧, 等.炮制降低吴茱萸肝毒性作用的初步研究 [J].中药材, 2018, 41(3): 570-575.
[4] 赵国平, 戴慎, 陈仁寿主编.南京中医药大学编著.中药大辞典 [M].2版.上海: 上海科学技术出版社, 2006: 1564-1567.
[5] 《全国中草药汇编》编写组.全国中草药汇编彩色图谱[M].北京: 人民卫生出版社, 1996: 236.
[6] 魏宝阳.中药吴茱萸道地性形成相关因子的研究 [D].长沙: 湖南农业大学, 2012.
[7] 戚华文, 徐鑫, 高德嵩, 等.吴茱萸HPLC指纹图谱的建立及基原鉴别研究 [J].中草药, 2021, 52(14): 4341-4347.
[8] 袁志坚, 何文涓, 胡晶.吴茱萸次碱药理学研究进展 [J].中国医药导报, 2018, 15(36): 40-43.
[9] 杨炳友, 宋佳欣, 孟永海, 等.吴茱萸多糖和吴茱萸内酯抗胃溃疡作用的研究 [J].中医药信息, 2012, 29(3): 11-15.
[10] 王婷.中药吴茱萸化学成分及生物活性研究 [D].大连: 大连医科大学, 2021.
[11] Li F, Dong Y Z, Zhang D,.Molecular mechanisms involved in drug-induced liver injury caused by urate-lowering Chinese herbs: A network pharmacology study and biology experiments [J]., 2019, 14(5): e0216948.
[12] 李文兰, 孙向明, 陈晨, 等.基于UPLC-Q-TOF MS的吴茱萸致肝毒性部位及入血成分分析 [J].质谱学报, 2017, 38(3): 282-293.
[13] 尹利顺, 吕莉莉, 龚彦胜, 等.吴茱萸挥发油对大鼠长期毒性实验研究 [J].中国药物警戒, 2015, 12(1): 20-25.
[14] 张茜, 周绮, 金若敏, 等.吴茱萸次碱对肝肾毒性的初步研究 [J].中国实验方剂学杂志, 2011, 17(8): 221-225.
HPLC fingerprint ofand processedbased on cluster analysis and principal component analysis
MA Xiang-hui, LIU Ye, JIANG heng-li, WANG Shuang-shuang, KANG Ya-juan, CHEN Yun-long, CAO Li-juan
Tianjin Key Laboratory of TCM Decoction Processing Technology Enterprise, China Medico Corporation, Tianjin 300301, China
To establish HPLC fingerprints ofand processed, evaluate the quality ofand processedby similarity calculation and chemical pattern recognition method, explore the changes of chemical components before and after processing, and explain the mechanism of toxicity reduction after processing.The fingerprints ofand processedwere established by HPLC, and the similarity evaluation system of Chinese Medicine Chromatographic Fingerprint (2012 edition) and SPSS17.0 software were used for similarity evaluation, cluster analysis (CA) and principal analysis (PCA).The fingerprint similarity ofand preparedwere greater than 0.985, and they all contained 12 identical common peaks, five of which were recognized.Using evodiamine as the reference peak, comparing the relative peak area of common peaks, it was found that the common peaks of processeddecreased in varying degrees except peak 3, and there were significant decreases in peak 2 and peak 10.The results of cluster analysis showed that the raw products ofcould be divided into two categories, one from Jiangxi and the other from Zhejiang and Hunan.Principal component analysis results showed that the cumulative variance contribution rate of the first three principal component factors was 87.405%, with peak 2, peak 5 (chlorogenic acid) and peak 6 (hypericin), peak 7, peak 8 (limonin), peak 9 (evodiamine), peak 10 (rutacarpine) and peak 12 contribute greatly to the difference of chemical components before and after processing.The construction of HPLC fingerprint and chemical pattern recognition ofcan provide a scientific basis for explaining the mechanism of toxicity reduction after processing.
(Juss.) Benth.; processed(Juss.) Benth.; fingerprint; cluster analysis; principal component analysis; chlorogenic acid; hypericin; limonin; evodiamine; rutacarpine
R286
A
0253 - 2670(2022)10 - 3171 - 07
10.7501/j.issn.0253-2670.2022.10.028
2021-10-09
国家重点研发计划项目(2018YFC1707000)
马向慧(1991—),女,硕士,主要从事中药质量标准研究。Tel: 18222016292 E-mail: maxianghui@linmura.com.cn
通信作者:曹丽娟,研究员,主要从事中药材及饮片质量标准研究。E-mail: caolijuan@linmura.com.cn
[责任编辑 时圣明]
