MoS2/Ru异质结构的制备及其电催化析氢反应性能
2022-05-23马海霞王太和赵玉洁李嘉辰
马海霞,王太和,赵玉洁,王 旭,李嘉辰,2
(1 西北大学 化工学院,西安 710069;2 西北大学 化学与材料科学学院,西安 710127)
氢能由于其具有高能量密度和清洁无污染等特性并且可通过可再生能源而获取被认为是可以替代化石能源的最佳替代品,因此能够有效缓解全球气候变暖以及环境污染等问题[1-2]。电催化水分解制氢是最清洁的工业制氢技术,由于采用高昂的铂(Pt)催化剂以达到降低反应能耗的目的,不可避免地提高了电水解制氢成本,在一定程度上限制了这种制氢技术的发展。鉴于此,许多研究者致力于设计低成本、高活性与稳定性的非贵金属催化剂替代贵金属Pt催化剂从而降低反应能耗的同时降低制氢成本[3-4]。
近些年来,二维层状二硫化钼(2D MoS2)由于其结构类似于自然界中的光催化氢化酶和在酸性或碱性条件下的理论氢吸附能更接近于热中性(ΔG=0)而作为氢析出反应(HER)催化剂被广泛研究[5-6]。通过理论计算得知,电子密度更趋近于MoS2中的Mo边位点,从而质子(H+)更容易在Mo活性位点上形成Mo—H键[7]。对于碱性HER,其反应机理存在两种不同的路径:Volmer-Tafel或者Volmer-Heyrovsky路径,包括水分子中HO—H键的断裂(Volmer步骤)而后进行电化学脱附H2(Heyrovsky步骤)或化学脱附H2(Tafel步骤)。在此过程中,Volmer步骤在碱性HER过程中是速率决定步骤[8]。MoS2在碱性环境中被证明是能够促进Heyrovsky步骤,但是MoS2表面对OH-吸附能力较强,这导致了Volmer步骤动力学反应速率较低,致使在碱性环境下的反应速率相比于酸性环境下降了2~3个数量级[9-11]。
近年来,许多研究者致力于如何提高MoS2在碱性条件下的HER活性而做了大量研究,包括阴阳离子掺杂[12]、相转变(2H相转变为1T相)[13]、构建表面缺陷[14]、构建异质结构[3,15]等。其中,将MoS2与能够促进碱性Volmer步骤的物质构建异质结构能够有效提高HER活性。Subbaraman等[16]最早证明了Ni(OH)2的边位点在Pt表面能够促进碱性HER中Volmer水分子的吸附/裂解,形成的氢中间体(Hads)转移到临近Pt位点析出氢气。根据这种策略,Hu等[17]将NiCo-LDH与MoS2进行复合构建MoS2/NiCo-LDH异质结构,在1.0 mol·L-1KOH条件下电流密度-10 mA·cm-2的过电位为78 mV。随后,许多研究者将金属氢氧化物如Ni(OH)2[10],Co(OH)2[18],CoO[19]等金属氧化物/氢氧化物作为Volmer步骤的促进体与MoS2结合,表现出了优异的HER活性。然而,这些非贵金属催化剂仍然不能达到Pt的活性。因此,将贵金属与MoS2结合并且调节ΔGH能够有效提高HER活性,同时将贵金属纳米化甚至单原子化以最大程度上提高贵金属质量活性和降低成本。最近,有研究者将Pt、钯(Pd)、铑(Rh)等贵金属与MoS2进行结合作为碱性HER催化剂,表现出类Pt的性质[20-22]。而在Pt族金属中,钌(Ru)是成本最低的金属,并且Ru—H与Pt—H的键能相近(≈65 kcal/mol)[23]。此外,Ru被证明能够诱导局域结构极化,有效降低Volmer活化能垒,并且能够优化ΔGH[24]。因此,利用Ru代替金属氧化物或其他贵金属与MoS2复合可望在极大程度上提高其碱性HER活性。
本工作通过两步水热法合成具有高分散性超小Ru纳米颗粒负载在MoS2纳米片并原位生长在三维导电碳布上,形成CC@MoS2/RuNPs异质结构电催化剂。对其进行结构和形貌的表征以及碱性HER电化学活性测试,考察了不同RuNPs负载量对HER活性的影响,优化出最佳MoS2/Ru配比。并且测试了该催化剂在长时间循环后的形貌和结构稳定性。最终讨论了MoS2与Ru在碱性HER过程中的协同催化作用机制。
1 实验材料与方法
1.1 CC@MoS2纳米片(NSs)的制备
在进行水热反应之前,将裁剪好的CC(1 cm×3 cm)用3.0 mol·L-1HCl、丙酮和无水乙醇分别清洗数次以去除CC表面的油渍和杂质,清洗完后将其浸泡在无水乙醇中备用。称取1.0 mmol Na2MoO4·2H2O和4.0 mmol硫脲溶解在15 mL去离子水中,搅拌10 min后倒入容量为25 mL聚四氟乙烯内胆的不锈钢水热釜中。将温度调至220 ℃并保温24 h,随后将CC@MoS2NSs用去离子水和乙醇清洗并在60 ℃下干燥即可得到CC@MoS2纳米片(NSs)。
1.2 CC@MoS2/RuNPs的制备
将上述制得的CC@MoS2NSs(1 cm×1 cm)浸入Ru3+的乙醇溶液中,该溶液由2.5 mL RuCl3·xH2O水溶液(10 mg/mL)倒入15 mL乙醇并搅拌10 min制得。将乙醇溶液倒入容量为25 mL聚四氟乙烯内胆的不锈钢水热釜中,温度调至180 ℃并保温6 h。随后取出CC@MoS2/RuNPs并用去离子水和乙醇清洗后在60 ℃下干燥。为了研究不同RuNPs负载量对性能的影响,可通过控制Ru3+溶液的量调节MoS2与RuNPs的比例。本工作将RuCl3·xH2O水溶液的添加量为0.2,0.4,0.8,1.0,1.5,2.0,2.5,3.0 mL和3.5 mL分别记作CC@MoS2/Ru-0.2,CC@MoS2/Ru-0.4,CC@MoS2/Ru-0.8,CC@MoS2/Ru-1.0,CC@MoS2/Ru-1.5,CC@MoS2/Ru-2.0,CC@MoS2/Ru-2.5,CC@MoS2/Ru-3.0和CC@MoS2/Ru-3.5。CC@MoS2/RuNPs的制备流程图如图1所示。

图1 MoS2/RuNPs的制备流程图Fig.1 Schematic illustration of preparation procedures for MoS2/RuNPs
1.3 材料表征
样品的结构和形貌表征分别采用X射线粉末衍射仪(XRD,Bruker D8 Advance)、扫描电子显微镜(SEM,Hitachi, SU8010)、透射电子显微镜(TEM,FEI Talos F200X)、X射线光电子能谱(XPS,Thermo Scientific Nexsa),粒径分布图是由Nano Measurer 1.2软件进行分析绘制。
1.4 电化学测试
本工作的电化学测试在CHI760E电化学工作站进行。采用三电极体系进行碱性HER测试,其中所制催化剂为集成工作电极,无需任何黏结剂和导电剂。石磨棒和Hg/HgO(1.0 mol·L-1KOH)分别为对电极和参比电极;电解液体系为1.0 mol·L-1KOH。本工作中所有电位通过公式ERHE=EHg/HgO+0.059×pH+0.098换算为可逆氢电极(RHE)。线性扫描伏安法(LSV)测试的扫描速度为2.0 mV/s。循环伏安法(CV)测试在非法拉第电位区间,通过不同扫描速度v(5,10,25,50,100 mV/s)和双电层电流(ic)的线性关系(见式(1))[25]计算出双电层电容(Cdl),进而判断不同材料的电化学表面积(ECSA)的大小。稳定性测试可通过考察2000周次CV前后的LSV重合度,或通过在恒定电流密度(-10 mA·cm-2)下电位随时间变化趋势(计时电位滴定法,CP)进行判断。
ic=vCdl
(1)
2 结果与分析
2.1 结构与形貌表征
图2为CC@MoS2和CC@MoS2/RuNPs的XRD谱图,可以看出CC@MoS2的衍射峰和MoS2标准卡片(JCPDS No.37-1492)完全吻合,说明所制备的样品不存在任何杂相[26-27]。在24°左右出现一个宽峰,对应三维基底CC特征峰。在14.4°位置说明MoS2(002)晶面为MoS2层间距。另外,在29°,33.5°,39.5°,44.2°,49.8°和58.3°位置出现明显衍射峰,并与(004),(101),(103),(006),(105)和(110)晶面相对应。与CC@MoS2相比,CC@MoS2/Ru基本保留了MoS2的特征峰,但是没有出现任何Ru金属的特征峰,说明在MoS2纳米片表面沉积的Ru的含量较少并且颗粒粒径较小,同时未检测出其他Ru氧化物的信号,说明所制备的CC@MoS2/Ru纯度较高。
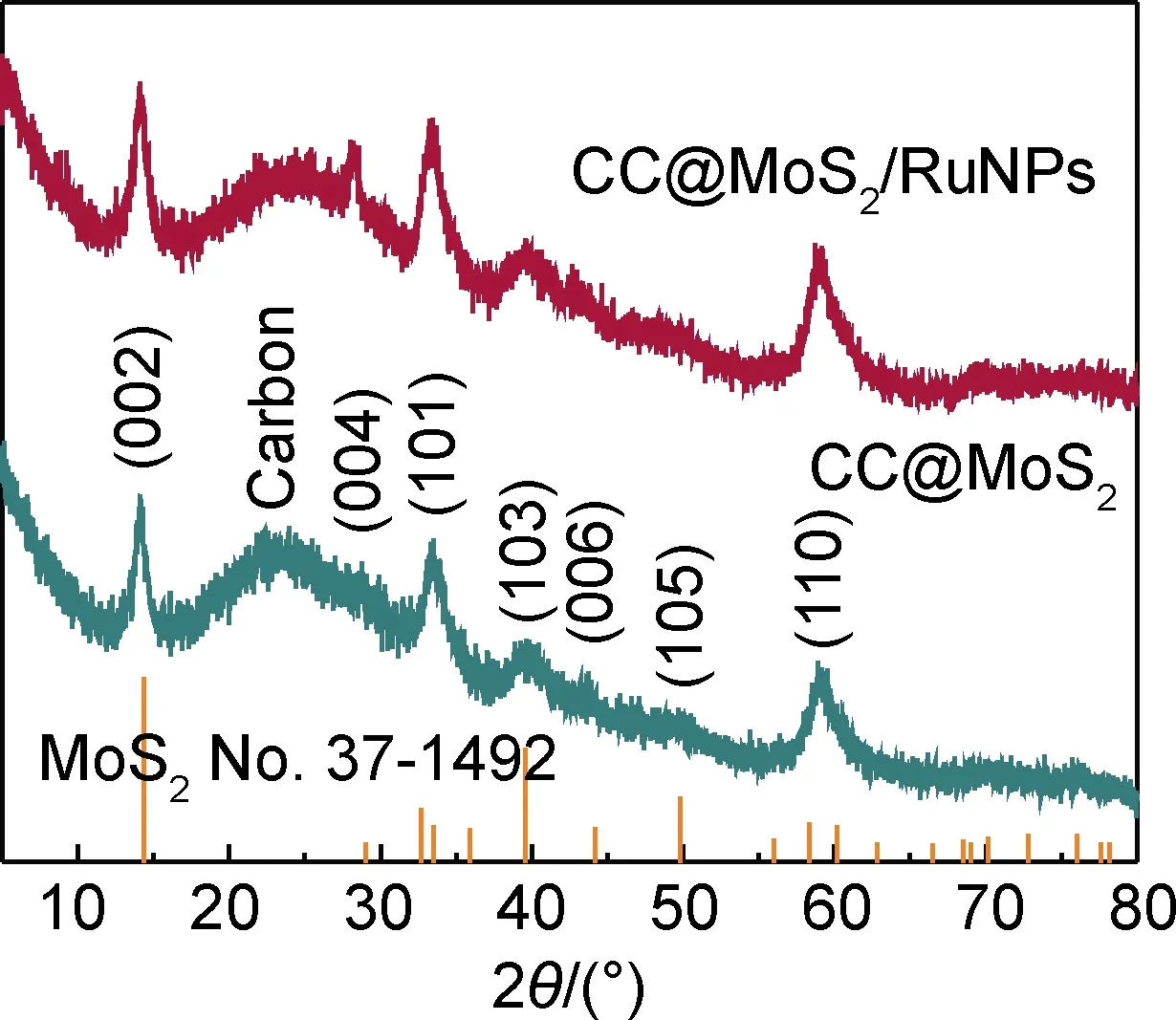
图2 CC@MoS2和CC@MoS2/RuNPs的XRD谱图Fig.2 XRD patterns of CC@MoS2 and CC@MoS2/RuNPs
图3为CC@MoS2NSs和CC@MoS2/RuNPs的SEM图。从图3(a-1),(a-2)中可以看出,MoS2纳米片均匀生长在三维导电碳布上。在CC@MoS2NSs表面沉积RuNPs后,基本保持MoS2纳米片状形貌,表明CC@MoS2/RuNPs具备良好的结构稳定性(图3(b-1),(b-2))。这种2D层状MoS2结构能够暴露更多的表面活性位点,可以充分分散RuNPs,防止团聚。而3D导电碳布基底具有低成本和高比表面积等特性,不仅可作为理想的催化剂负载基体,也可有效提高Ru利用率[28]。

图3 样品的SEM图(a)CC@MoS2NSs;(b)CC@MoS2/RuNPs;(1)低倍;(2)高倍Fig.3 SEM images of samples(a)CC@MoS2NSs;(b)CC@MoS2/RuNPs;(1)low magnification;(2)high magnification
为了进一步分析CC@MoS2/RuNPs的微观结构,本工作中对MoS2/RuNPs进行了TEM以及高分辨HRTEM的表征。图4(a)为MoS2/RuNPs的TEM图片,纳米片表面出现多层MoS2的褶皱,但是没有发现明显的颗粒状Ru,说明其粒径较小。进一步提高TEM分辨率能够看到MoS2NSs表面均匀分散了大量Ru颗粒(图4(b)),没有出现明显的Ru颗粒团聚,证实了上述XRD的分析。另外,通过粒径分布图分析得知RuNPs的平均粒径为2.5 nm(图4(b)插图)。图4(c)为MoS2/RuNPs的HRTEM图片,通过分析MoS2的晶格间距为0.62 nm,对应MoS2(002)层间距[29]。而Ru的分散区域未出现MoS2(002)晶格,说明RuNPs分散在单层MoS2表面。这种单层结构能够暴露更多活性位点,MoS2/Ru界面具有高电活性,促进MoS2与Ru之间的电荷重新分布,表现出更加优异的催化活性[8,30]。

图4 CC@MoS2/RuNPs的TEM图(a)低分辨率;(b)高分辨率和粒径分布图;(c)HRTEM图Fig.4 TEM images of CC@MoS2/RuNPs (a)low resolution;(b)high resolution and particle size distribution map;(c)HRTEM image
采用XPS分析CC@MoS2/Ru中元素组成以及各元素价态。图5(a)为CC@MoS2/Ru全谱图,其中含有Mo,S,Ru,C以及O元素,C和O元素来源于空气污染的C源和三维CC基底,而O元素来源于材料表面不可避免的部分氧化。因此,CC@MoS2/Ru中不含其他杂元素。图5(b)是Mo3d高分辨XPS谱图,在226.7 eV为MoS2中S2s信号,229.5 eV和232.5 eV处的特征峰分别为MoS2中Mo4+的3d5/2和3d3/2自旋轨道。在235.3 eV处为CC@MoS2/Ru表面部分氧化形成Mo6+[31]。在图5(c)中S2p图谱中,其中在162.3 eV和163.4 eV分别表示MoS2中Mo—S键的2p3/2和2p1/2自旋轨道。在168.7 eV处的特征峰为MoS2表面氧化形成的S—O化合物[32]。图5(d)为CC@MoS2/Ru中Ru3d高分辨XPS图谱,可以看到结合能为280.3 eV处为Ru3d5/2自旋轨道,与Ru0相对应,表明CC@MoS2/Ru中Ru的存在形式为金属态而非氧化态。另外,284.6 eV为C1s特征峰,主要来源于导电碳基底[33]。
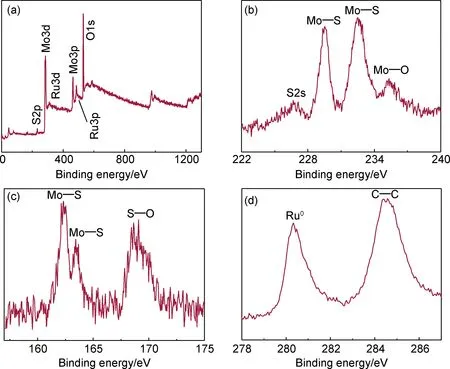
图5 CC@MoS2/Ru的XPS谱图 (a)全谱图;(b)Mo3d;(c)S2p;(d)Ru3dFig.5 XPS spectra of CC@MoS2/Ru (a)survey spectrum;(b)Mo3d;(c)S2p;(d)Ru3d
2.2 碱性HER电化学测试
通过对CC@MoS2/Ru进行LSV极化曲线测试可以评价材料的HER催化活性。如图6(a)所示,不同Ru的负载量对HER活性有显著影响。在电流密度为-10 mA·cm-2下CC@MoS2的过电位为150.8 mV,通过负载不同RuNPs的量可调控CC@MoS2/Ru的HER活性,当RuCl3·xH2O溶液的添加量为2.5 mL时,催化活性达到最优。过电位在71.3 mV和188.6 mV时就可分别驱动-10 mA·cm-2和-100 mA·cm-2的电流密度。这种优异的活性明显高于最近发表的Ru或Mo基电催化剂(图6(b))。但是在这里存在一个活性峰值,在RuCl3·xH2O溶液添加量超过2.5 mL,如达到3.0 mL和3.5 mL时,CC@MoS2/Ru的活性显著降低,其原因有可能是MoS2表面负载过量RuNPs导致团聚现象,颗粒团聚会导致表面活性位点数减少,很大程度上影响催化活性。

图6 不同RuNPs负载量的CC@MoS2/Ru的LSV极化曲线(a)和在-10 mA·cm-2和-100 mA·cm-2下与最近报道的Mo或Ru基电催化剂的碱性HER性能对比图(b)Fig.6 LSV curves of CC@MoS2/Ru with different Ru mass loading(a) and comparison of the alkaline HER performance of CC@MoS2/Ru-2.5 with those of recently reported Ru- or Mo-based electrocatalysts at -10 mA·cm-2 and -100 mA·cm-2(b)
为了研究CC@MoS2/Ru与CC@MoS2的HER动力学速率变化,通过LSV曲线和式(2)[34]计算出CC@MoS2/Ru-2.5和CC@MoS2的Tafel斜率。
η=A×lg(j/j0)
(2)
式中:η为过电位;j为电流密度;j0代表交换电流密度;A代表Tafel斜率。如图7所示,CC@MoS2/Ru-2.5的Tafel斜率为104.8 mV·dec-1,低于CC@MoS2(114.6 mV·dec-1),说明MoS2表面负载RuNPs后会提高表/界面反应动力学速率,提高HER反应速率。因此,CC@MoS2/Ru的Tafel斜率降低表明在此异质结构中,由于存在丰富的MoS2/Ru界面,提高了碱性HER过程中Volmer-Heyrovsky反应速率,从根本上提高了碱性HER的本征活性。

图7 CC@MoS2/Ru-2.5和CC@MoS2的Tafel曲线Fig.7 Tafel plots of CC@MoS2/Ru-2.5 and CC@MoS2
除了本征活性的影响,ECSA是另一个提高HER活性的重要因素,本工作通过测试Cdl电容值判断CC@MoS2/Ru-2.5和CC@MoS2的ECSA差异。如图8(a),(b)所示,通过测试非法拉第电位区间在不同扫描速度下的CV曲线,即可通过式(1)拟合出CC@MoS2/Ru-2.5和CC@MoS2的Cdl电容值。如图8(c)所示,CC@MoS2/Ru-2.5的Cdl为102.2 mF·cm-2,远高于CC@MoS2(74.4 mF·cm-2)。结果表明,RuNPs的负载可提高CC@MoS2的ECSA,能够暴露更多的活性位点作为催化位点,提高CC@MoS2/Ru-2.5的HER活性。
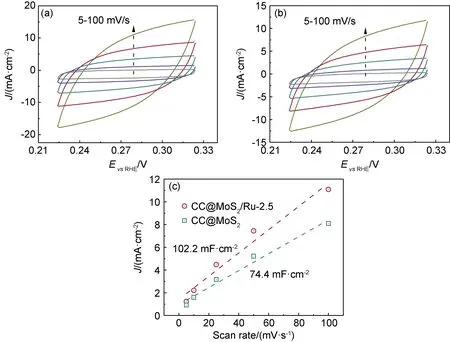
图8 CC@MoS2/Ru-2.5(a),CC@MoS2(b)在不同扫描速度下的CV曲线以及CC@MoS2/Ru-2.5,CC@MoS2的电流密度-扫描速度关系图(c)Fig.8 CV curves of CC@MoS2/Ru-2.5(a),CC@MoS2(b) over different scan rates and current density as a function of scan rate for CC@MoS2/Ru-2.5 and CC@MoS2 (c)
催化剂的稳定性是评判催化剂好坏的重要指标。在本工作中,采用多次CV循环前后LSV重合程度来判断CC@MoS2/Ru-2.5的稳定性好坏。如图9(a)所示,在2000 CV后CC@MoS2/Ru-2.5的LSV曲线与初始曲线重合度较好,说明没有明显的性能衰减。为了进一步证明CC@MoS2/Ru-2.5在长时间催化反应后的稳定性,本工作通过在恒定电流密度下测定过电位随时间的变化趋势。如图9(b)所示,在-10 mA·cm-2电流密度下,经过至少35 h的持续催化反应后过电位变化仍不明显,说明CC@MoS2/Ru-2.5具有优异的催化稳定性。其原因主要是MoS2/Ru原位生长在CC三维基底上,具有较强机械稳定性。另外,MoS2/Ru的三维纳米片交错排列的结构能缓解“气体屏蔽效应”,促进H2的溢出而不会堵塞活性位点,影响后续的HER催化反应[11,23]。
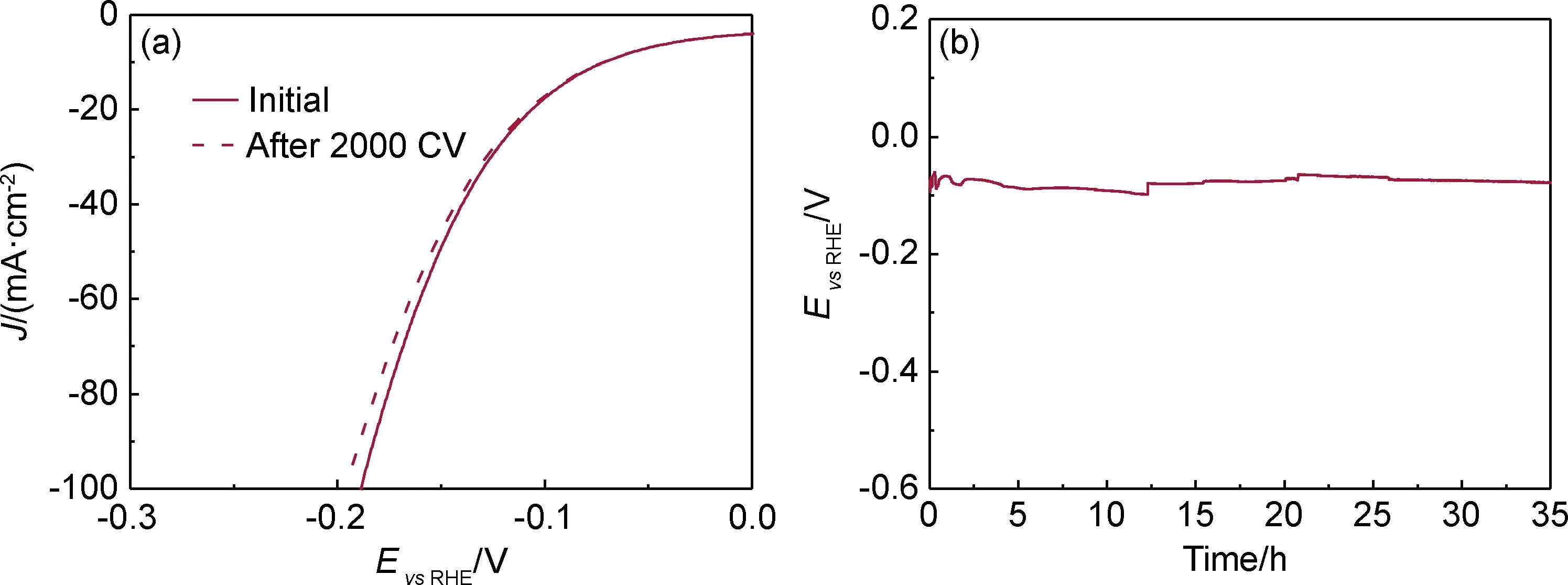
图9 CC@MoS2/Ru-2.5的稳定性测试(a)初始和2000 CV循环后的LSV曲线;(b)在-10 mA·cm-2电流密度下的CP曲线Fig.9 Stability test of CC@MoS2/Ru-2.5(a)LSV curves before and after 2000 CV test;(b)CP curve at a current density of -10 mA·cm-2
2.3 协同催化机理分析
结合实验结果能够看出CC@MoS2/Ru的碱性HER相比于CC@MoS2有明显提高,说明RuNPs的复合能够提高MoS2的本征活性。其原因主要是Ru的加入诱导Ru/MoS2的界面进行电荷重新分布,界面附近的Ru位点由于局部结构极化而积累更多的电子,从而降低Volmer水裂解的能量势垒,解决了MoS2在碱性HER过程中的第一步水裂解动力学缓慢的问题[24]。如图10所示,在MoS2/Ru异质结构中的碱性HER反应机理为:水分子优先在Ru位点上进行Volmer水吸附并且裂解为OH-和Hads,随后产生的Hads进行Heyrovsky电化学脱附形成氢气。因此,Ru与MoS2两者的复合充分体现了协同催化作用机制。
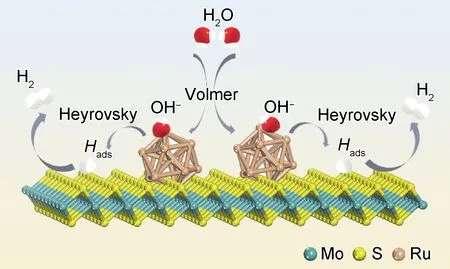
图10 MoS2/Ru界面的碱性HER机理示意图Fig.10 Schematic illustration of alkaline HER mechanism on the interfaces of MoS2/Ru
3 结论
(1)通过简单温和的两步水热法制备出了新颖的CC@MoS2/Ru三维集成催化剂,表现出优异的碱性HER催化活性和稳定性。在电流密度为-10 mA·cm-2下的过电位仅为71.3 mV,相比于CC@MoS2(150.8 mV)过电位有明显降低。在恒定电流密度下能保持至少35 h没有明显衰减,主要原因为CC@MoS2/Ru牢固的三维集成电极和稳定的形貌及结构,消除气体屏蔽效应,促进H2的排出。
(2)对比不同RuNPs负载量的CC@MoS2/Ru催化活性,CC@MoS2/Ru-2.5的活性最佳,而过多负载RuNPs会降低CC@MoS2/Ru的催化活性,其主要原因是高负载量会导致RuNPs的团聚,减少活性位点的暴露。CC@MoS2/Ru优异的碱性HER活性主要来源于RuNPs的复合诱导Ru/MoS2的界面进行电荷重新分布,提高MoS2/Ru的Volmer反应速率,从根本上解决了MoS2在碱性HER活性较差的问题,有望成为替代商业Pt/C的高效稳定氢析出催化剂。
