小麦 TaGF14m基因的克隆及其盐胁迫响应分析
2022-05-23刘佳月郭树娟郑昊元赵惠贤刘香利
刘佳月,郭树娟,郑昊元,赵惠贤,2,刘香利,2
(1.西北农林科技大学生命科学学院,陕西杨凌 712100; 2.旱区作物逆境分子生物学国家重点实验室,陕西杨凌 712100)
小麦(L.)是世界上广泛种植的重要粮食作物之一,干旱、高温和盐碱是导致小麦减产的主要非生物胁迫。因此,小麦逆境胁迫响应基因的功能研究对于小麦抗逆遗传改良具有重要意义。14-3-3蛋白是在牛脑中发现的酸性可溶性蛋白,根据其经二乙氨乙基纤维素柱层析后的分离组分及其在凝胶电泳中的迁移率而命名。目前编码14-3-3蛋白的基因已经在拟南芥()、水稻()、二穗短柄草()等物种中被分离并鉴定出来。14-3-3蛋白在真核生物中广泛存在且高度保守,可通过同源或异源二聚体结合多种靶蛋白(如代谢相关的酶)、转录因子(如ABF、CBF和MYB)、蛋白激酶(如CDPK和CRPK1)以及磷酸酶(如MAPK磷酸酶)等,参与植物代谢、发育以及胁迫响应等多种生理过程和信号途径。
植物响应盐胁迫主要通过盐超敏感(salt overly sensitive,SOS)信号转导途径。研究表明,拟南芥14-3-3蛋白λ和k可与SOS2蛋白互作,抑制其激酶活性,从而负调节盐胁迫的耐受性;在烟草中过表达二穗短柄草14-3-3蛋白基因和小麦14-3-3蛋白基因后,转基因烟草的耐盐性均增强。小麦14-3-3蛋白家族成员TaGRF6-A通过与MYB转录因子TaMYB64相互作用,也可正向调控盐胁迫的耐受性。
本课题组前期对小麦14-3-3蛋白基因家族进行了鉴定,并对其非生物逆境胁迫下的表达模式进行了分析,发现位于小麦3D染色体上的基因在小麦非生物逆境胁迫下上调表达。因此,本研究对基因进行克隆,并利用过表达的转基因拟南芥对基因在盐胁迫下的功能进行初步分析,以期为小麦14-3-3蛋白基因的功能研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 植物材料
试验所用的小麦材料为中国春,拟南芥材料为哥伦比亚野生型(Columbia-0),均由本试验室保存。
1.1.2 载体与菌株
基因克隆载体pMD19T为TaKaRa产品,植物表达载体为经本试验室改造的pCAMBIA1304(植物中抗性替换为Basta除草剂抗性,35S启动子序列后引入酶切位点Ⅰ和Ⅲ),大肠杆菌菌株DH5α 和农杆菌菌株GV3101均由本试验室保存。
1.2 方 法
1.2.1 小麦基因的克隆
根据NCBI中基因的序列(TraesCS3D01G055500),利用Primer Premier 5.0设计特异引物TaGF14m-F/R(表1),用CTAB法提取小麦幼苗叶片的基因组DNA。利用RNA提取试剂盒(BioTeke,北京)提取总RNA,并利用PrimeScriptII 1st Strand cDNA synthesis Kit(6210A)反转录试剂盒(TaKaRa,日本)反转录成cDNA,分别以基因组DNA和cDNA为模板,扩增基因全长及其编码区序列。PCR反应体系为20 μL,包括2×KOD buffer 10 μL,dNTP 2 μL,KOD-FX(TOYOBO,上海) 0.4 μL,DNA模板1 μL,上、下游引物各 0.5 μL,ddHO补至20 μL。PCR反应程序: 95 ℃ 2 min;98 ℃ 20 s,64 ℃ 30 s,68 ℃ 1 min 40 s(基因组DNA)或50 s(cDNA),35个循环; 68 ℃ 10 min。PCR反应结束后,用1%的琼脂糖凝胶电泳进行检测。切胶回收后进行加尾反应,T-A克隆至载体pMD19T,然后转化至大肠杆菌DH5α感受态细胞,菌落PCR和酶切鉴定后送西安擎科泽西生物有限公司测序,测序正确的分别命名为pMD19T-和pMD19T-cds。利用GSDS(http://gsds.cbi.pku.edu.cn)在线工具对其外显子-内含子结构进行分析。利用DNAMAN软件将小麦TaGF14m蛋白与其他物种的同源蛋白序列进行比对分析。
1.2.2 盐胁迫处理下小麦基因的表达模式分析
将两叶一心期的中国春小麦幼苗(22 ℃光照16 h/黑暗8 h ,相对湿度为70 %,1/2 Honland营养液培养)用0.2 mol·L的NaCl溶液进行处理,分别在处理后的 0、1、3、6、12和24 h取样,液氮速冻后-80 ℃保存。用RNA提取试剂盒(BioTeke,北京)提取总RNA,并反转录为cDNA,以小麦基因为内参,以qTaGF14m- F/R为引物,用Talent SYBR green qPCR PreMix (天根,北京)进行qRT-PCR分析,PCR反应体系参照试剂盒说明书,PCR反应程序: 95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。每个样品三个生物学重复,使用2-△△方法计算相对表达量。

表1 本研究所用引物的信息Table 1 Primers used in the study
1.2.3 小麦基因植物表达载体的构建及转基因拟南芥的筛选
以pMD19T-质粒为模板,利用带有Ⅰ和EⅡ酶切位点的引物14m-Ⅰ-F和14m-EⅡ-R扩增基因,PCR扩增产物经胶回收后与改造后的pCAMBIA1304载体用限制性内切酶Ⅰ和EⅡ进行酶切并回收,使用T连接酶将二者连接后转化大肠杆菌DH5α感受态细胞,菌落PCR筛选和酶切鉴定正确的质粒送西安擎科泽西生物有限公司进行测序,测定正确的命名为pCAMBIA1304-(图1)。
利用冻融转化法将重组载体pCAMBIA1304-转入农杆菌GV3101,采用花序侵染法获得转基因拟南芥。通过叶片喷施0.1%的Basta除草剂(有效成分为20%的草胺磷) 进行筛选,并利用引物14m-Ⅰ-F和14m-E Ⅱ-R对转基因植株进行PCR鉴定,获得独立的T代转基因纯合株系。利用qRT-PCR检测T代转基因纯合株系中目的基因的表达水平,检测引物为qTaGF14m-F2/R2,PCR反应体系和程序同1.2.2。

LB:左边界;35S T Ploy A:35S终止子;Bar:膦丝菌素乙酰转移酶基因(筛选标记基因);CaMV35S:花椰菜病毒35S强启动子; Nos T:Nos基因终止子;RB:右边界。
1.2.4 盐胁迫处理对过表达转基因拟南芥的影响
盐胁迫下转基因拟南芥的表型观察:对野生型和转基因拟南芥种子在正常供水条件下培养 3~4周(22 ℃光照16 h/黑暗8 h)后用0.2 mol·L的NaCl溶液浇灌,盐胁迫13 d后观察植物表型。将野生型和转基因拟南芥种子消毒后播种于MS培养基上,4 ℃春化3 d后,置于22 ℃培养3~5 d,然后将幼苗分别转移至1/2 MS和含100 mmol·LNaCl的1/2 MS培养基中,竖直培养14 d 后,拍照并测量幼苗的根长。
盐胁迫下转基因拟南芥中SOS途径相关基因的表达模式分析:分别在盐胁迫0、12 d对野生型和转基因拟南芥叶片进行取样,用RNA提取试剂盒(BioTeke,北京)提取总RNA,并反转录成cDNA。然后利用qRT-PCR方法检测转基因拟南芥中SOS途径相关基因()的表达水平(定量引物序列见表1,PCR反应体系和程序同1.2.2),结果以平均值±标准差 表示 。
1.3 数据处理
用Excel软件进行数据统计和分析,用SPSS软件进行差异显著性分析。
2 结果与分析
2.1 小麦 TaGF14m基因的克隆结果及序列分析
分别以中国春基因组DNA和cDNA为模板扩增基因全长及其编码区序列,分别得到1 437和789 bp的目的条带(图2)。进一步分析表明,该基因含有5个外显子和4个内含子,包含789 bp的开放阅读框,可编码262个氨 基酸。
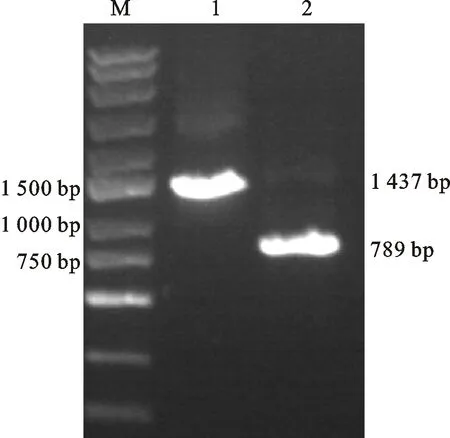
M:DNA marker ;1: TaGF14m的基因组DNA扩增;2: TaGF14m的cDNA扩增。
使用DNAMAN软件对小麦 TaGF14m蛋白与其他物种的同源蛋白进行多重比对分析,结果(图3)显示,小麦TaGF14m与玉米ZmGF14a、大麦HvGF14b、拟南芥AtGRF7、水稻OsGF14e、二穗短柄草BdGF14e以及乌拉尔图小麦TuGF14b的相似度较高,其中与乌拉尔图小麦TuGF14b相似度最高,且所检测物种中均含有14-3-3蛋白保守结构域。

方框表示14-3-3蛋白家族保守结构域。Ta:小麦;Zm:玉米;HV:大麦;At:拟南芥;Os:水稻;Bd:二穗短柄草;Tu:乌拉尔图小麦。
2.2 小麦 TaGF14m基因在盐胁迫处理下的表达模式
利用qRT-PCR对盐胁迫0、1、3、6、12和 24 h的小麦幼苗叶片中基因的相对表达量进行分析,结果(图4)显示,基因在盐胁迫1、3、12和24 h均上调表达,且在盐胁迫12 h时表达量最高,与0 h之间的差异达显著水平,表明小麦基因能响应盐胁迫。

图柱上无相同字母表示相对表达量在不同处理时间之间差异达显著水平(P<0.05)。
2.3 植物表达载体pCAMBIA1304-TaGF14m的构建及转基因拟南芥的筛选鉴定结果
表达载体pCAMBIA1304和基因用Ⅰ和EⅡ双酶切后,用T连接酶连接并转化大肠杆菌DH5ɑ感受态细胞,挑取单克隆进行菌落PCR和酶切验证,可以切出pCAMBIA1304载体骨架和1 437 bp的目的条带,进一步通过测序验证,成功构建了pCAMBIA1304-载体。
利用花序侵染法转化拟南芥,通过Basta筛选获得转基因株系,然后随机选取8个抗性转基因株系进行PCR检测,结果(图5)显示,转基因株系均能扩增出1 437 bp的目的条带,说明均为阳性株系。选取4个独立的T代转基因纯合株系,利用qRT-PCR方法检测基因的表达水平,结果(图6)表明,4个过表达转基因株系OE2、OE4、OE5和OE6中基因的相对表达量均显著高于野生型。

M:DNA marker;1:野生型;2:H2O(阴性对照);3~10:转基因植株。

WT代表野生型;OE2、OE4、OE5、OE6代表转基因株系。图柱上不同字母表示不同株系间差异显著。图8同。
2.4 盐胁迫对过表达 TaGF14m转基因拟南芥的影响
2.4.1 盐胁迫下转基因拟南芥的表型
对正常供水条件下培养3~4周的野生型和转基因拟南芥用0.2 mol·LNaCl溶液进行盐胁迫处理,与野生型相比,盐胁迫处理13 d的转基因拟南芥生长明显受到抑制,叶片发紫,变黄,植株变矮(图7),说明过表达基因使转基因拟南芥的盐胁迫耐受性降低。

图7 野生型和转基因拟南芥在盐胁迫下的表型
将MS上萌发3~5 d的幼苗转移至1/2 MS培养基以及含100 mmol·LNaCl的1/2 MS培养基中,培养14 d后,发现在1/2 MS培养基中,野生型和转基因拟南芥间的根长无显著差异(图8左);而在含100 mmol·LNaCl的1/2MS培养基中,转基因拟南芥的根长显著短于野生型(图8右),说明转基因株系对盐胁迫较为 敏感。

图8 盐胁迫对野生型和转基因拟南芥根长的影响
2.4.2 盐胁迫处理下SOS途径相关基因的表达模式
利用qRT-PCR分析野生型与转基因拟南芥株系OE2和OE4在盐胁迫下SOS途径三个关键基因(、和)在叶片中的表达模式,结果(表2)表明,与野生型相比,对照组转基因拟南芥株系中和基因均上调表达,且差异达显著水平,而基因的相对表达量在野生型和转基因拟南芥株系间无显著差异;盐胁迫处理组转基因拟南芥株系中基因下调表达,和基因均上调表达,但这三个基因的相对表达量在野生型和转基因拟南芥株系间均无显著差异,说明转基因拟南芥株系中、和基因在SOS途径中的功能不同。与对照组相比,盐胁迫处理下野生型拟南芥中、和基因均上调表达,而转基因拟南芥株系中基因均下调表达,和基因均上调表达。以上结果说明,基因可能参与盐胁迫信号通路的 调控。

表2 盐胁迫处理下SOS途径相关基因的相对表达量Table 2 Relative expression of SOS pathway related genes under salt stress
3 讨 论
14-3-3蛋白在真核生物中广泛存在且高度保守,本研究对小麦TaGF14m蛋白及其他物种同源蛋白的序列进行多重比对分析,发现不同物种同源蛋白间相似度较高,差异主要在分布在N端和C端,这与Yang等报道的14-3-3蛋白主要通过变异性较高的N端和C端来发挥功能相一致。本研究发现,小麦幼苗中基因在盐胁迫处理下显著上调表达,这与其同源基因二穗短柄草基因和水稻基因在盐胁迫诱导后上调表达的结果相一致。
SOS1、SOS2和SOS3蛋白是SOS途径的三个主要组成部分,SOS1为质膜Na/H反向转运蛋白,能够促进Na的外排;SOS3为钙结合蛋白,可以感知钙信号,与丝氨酸/苏氨酸蛋白激酶SOS2相互作用并激活SOS2,进一步通过磷酸化激活SOS1,阻止Na进入胞内,促进胞内过多的Na外排。14-3-3蛋白λ和k可通过SOS途径参与植物盐胁迫响应,例如拟南芥14-3-3蛋白λ和k可与SOS2结合,抑制其激酶活性,负调控盐胁迫耐受性,过表达λ和k可使转基因拟南芥根长和鲜重降低;盐胁迫处理下,细胞质中Ca浓度升高,与14-3-3蛋白结合,进而抑制14-3-3蛋白与SOS2互作,释放SOS2,激活PMH-ATP酶和SOS1,进而增加盐胁迫耐受性。本研究分析了盐胁迫处理对过表达转基因拟南芥的影响,发现与野生型相比,转基因拟南芥生长明显受到抑制;SOS途径基因表达模式分析表明,正常培养条件下过表达转基因株系和基因的相对表达量显著高于野生型;而盐胁迫处理下过表达转基因株系中SOS途径相关基因的相对表达量与野生型均无显著差异,说明基因可能通过SOS途径负调控盐胁迫耐受性,但其胁迫响应机理有待进一步研究。
