SALM3 在胰腺癌组织中的表达变化及临床意义*
2022-05-21刘益飞
刘益飞,王 燕,张 青,刘 颖*
(南通大学附属医院病理科,南通 226001)
胰腺癌是常见的消化系统恶性肿瘤,占消化道肿瘤的8%~10%[1],其侵袭性强,恶性程度高,5 年生存率低[2]。目前治疗仍以手术根治性切除为主,但胰腺癌起病隐匿,大部分患者确诊时已错过最佳治疗时期。鉴于胰腺癌发病率较高,早期诊断困难,预后差,术后复发和转移率高,因此,探索胰腺癌相关分子标志物,寻找特异且敏感的治疗靶点是目前研究的热点。
突触黏附样分子(synaptic adhesion-like molecule,SALM)也称为富含亮氨酸重复序列和纤维连接蛋白Ⅲ型结构域(leucine-rich repeat and fibronectin type Ⅲdomain-containing,LRFN)蛋白家族[3],在神经突的生长及突触的形成中起重要作用[4-5]。研究[6-7]显示,SALM 家族分子尤其是SALM3 在多种肿瘤细胞中表达。但目前SALM3 在胰腺癌中的表达情况报道较少。本研究观察了胰腺癌组织中SALM3 的表达变化,分析其与临床病理参数及患者预后的关系,探讨SALM3 在胰腺癌发生发展及预后判断中的作用。
1 资料与方法
1.1 临床资料 收集2011 年1 月1 日—2014 年12 月31 日南通大学附属医院外科手术切除并病理确诊为胰腺癌患者104 例的癌组织,每例取相应癌旁组织(非癌组织)。患者无其他恶性肿瘤史,术前未行放疗或化疗等。患者临床病理资料(包括年龄、性别及瘤体大小等)均来自病案记录。其中男55 例,女49 例,年龄43~78 岁,中位年龄55 岁。所有患者均电话随访,随访时间为手术日期至最终随访日期(2019 年12 月31 日)或死亡日期。本研究通过南通大学附属医院医学伦理委员会批准,所有患者签署知情同意书。
1.2 组织芯片的制作及免疫组织化学染色分析收集病例对应的石蜡组织,用记号笔选取目标位置,用组织芯片仪取直径为2.0 mm 的目标组织制作成组织芯片蜡块。将芯片蜡块常规切片、脱蜡、水化及抗原修复后,孵育兔抗人SALM3 多克隆抗体(1:200稀释,美国R&D 公司,MAB5445)。随后,孵育二抗(福州迈新公司),3-二氨基联苯胺(diaminobenzidine,DAB)染色,封片。用磷酸缓冲盐溶液替代一抗作为阴性对照。免疫组织化学染色切片由两名高年资病理医师阅片。阳性结果显示为细胞质内出现棕黄色颗粒。染色强度划分:0 分(阴性),1 分(弱阳),2 分(中阳),3 分(强阳)。阳性细胞比例用0~100%记录,免疫组织化学染色评分以染色强度与阳性细胞比例的乘积(0~300)为最终评分[6]。
1.3 统计学方法 采用SPSS 21.0 统计软件分析,胰腺癌组织与癌旁组织中SALM3 的表达差异用χ2检验;SALM3 表达与临床病理参数的关系分析用χ2检验;Kaplan-Meier 方法生成胰腺癌患者5 年生存率的生存曲线;采用Logrank 检验及Cox 回归模型进行预后分析。P<0.05 为差异有统计学意义。
2 结 果
2.1 SALM3 在胰腺癌组织中的表达 用组织芯片行免疫组织化学染色分析SALM3 在胰腺癌组织及非癌组织中的表达情况,阳性染色位于癌细胞的细胞质(图1)。以100 分作为评判SALM3 表达的临界值,0~100 分为低或无表达,101~300 分为高表达。胰腺癌组织中SALM3 高表达率为50.96%(53/104),非癌组织中SALM3 的高表达率为29.81%(31/104),差异有统计学意义(P<0.01)。
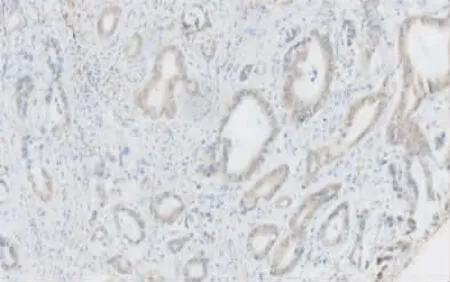
图1 SALM3 在胰腺癌中的表达(Envision,200×)
2.2 SALM3 表达与胰腺癌患者临床病理各参数的关系 SALM3 表达与肿瘤的TNM 分期、肿瘤的分化程度、瘤体大小及淋巴结转移相关(均P<0.05),而与患者年龄、性别及肿瘤部位无关(P>0.05)(表1)。
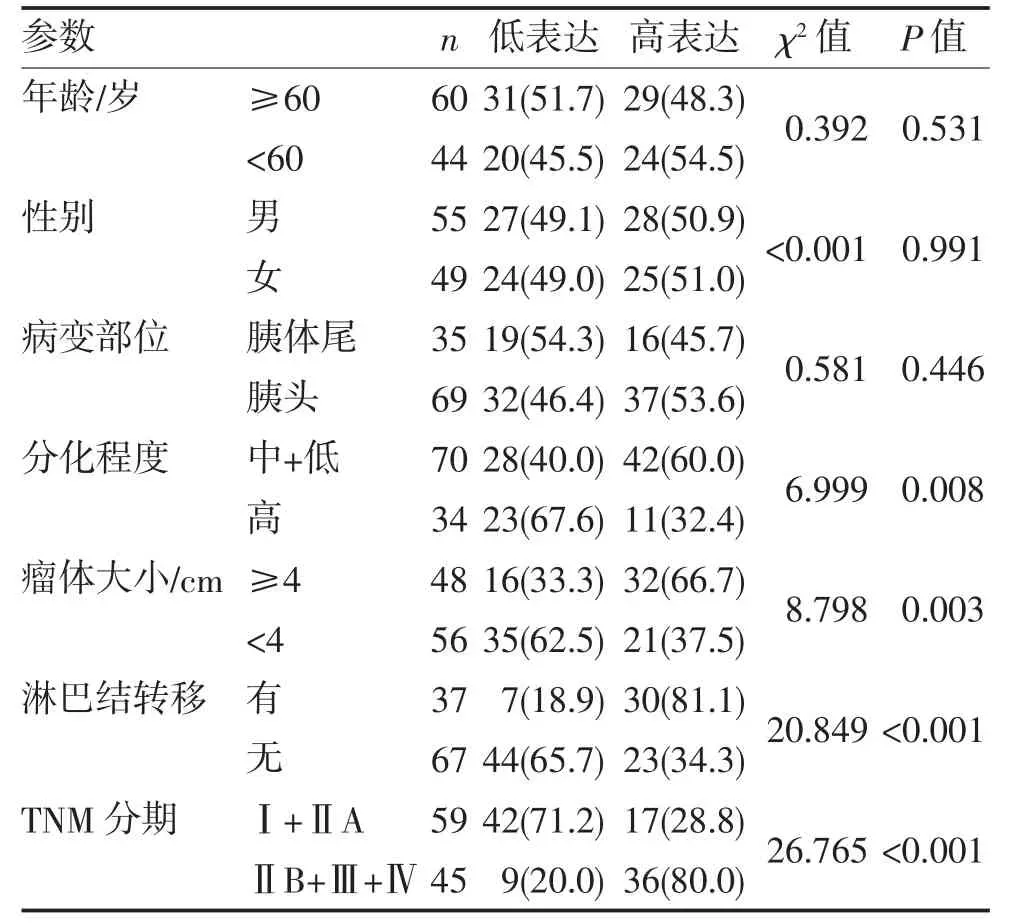
表1 SALM3 表达与胰腺癌临床病理各参数的关系(n,%)
2.3 SALM3 表达与胰腺癌患者预后的关系 Kaplan-Meier 法绘制生存曲线,结果显示SALM3 高表达胰腺癌患者的总体生存率降低(P<0.01)(图2)。单、多因素预后分析显示,SALM3 表达、TNM 分期、瘤体大小、淋巴结转移及肿瘤分化程度与胰腺癌患者的预后有关(均P<0.05),而肿瘤部位、患者年龄、性别与预后无关(均P>0.05);SALM3 表达和TNM 分期为胰腺癌患者独立预后指标(均P<0.05)(表2)。
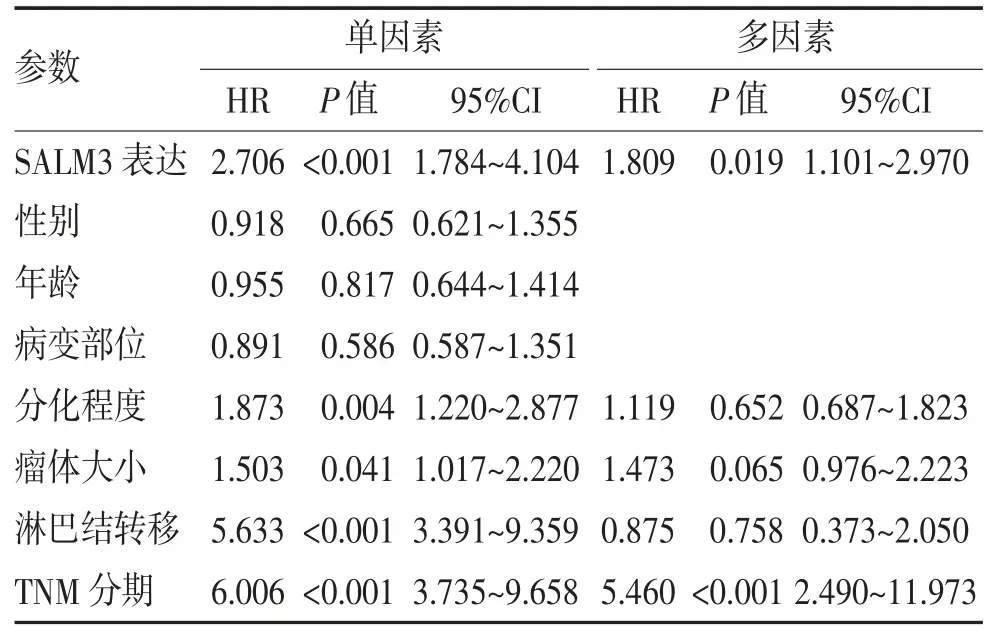
表2 SALM3 与预后的单、多因素分析
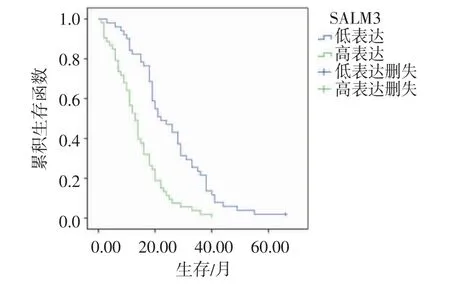
图2 胰腺癌SALM3 高表达和低表达患者的生存曲线
3 讨 论
SALM 家族现已知成员SALM1~5,它们有着相似的结构域,但功能却有所不同。SALM3 也称为LRFN4[3,8]。有报道[4]认为SALM 家族成员主要在神经组织中表达和发挥功能,也有研究[9]显示SALM2/LRFN1 参与胰腺癌细胞存活;SALM3 在某些癌细胞系如JURKAT 1、Panc 1 和MKN7 中表达[10];SALM3/LRFN4 在胃癌和结直肠癌组织中也表达[6-7]。本研究中,SALM3 在胰腺癌癌组织中表达,主要定位在胰腺癌细胞的细胞质,SALM3 在胰腺癌组织中的表达率高于非癌组织,SALM3 在胰腺癌中的高表达与一些临床病理特征呈正相关,如瘤体的大小、肿瘤的分化程度、淋巴结转移和TNM 分期。结果表明SALM3在胰腺癌中起促癌作用。
Kaplan-Meier 分析显示,SALM3 表达上调与患者总生存率降低相关,提示SALM3 的高表达可能促进了胰腺癌的发生和进展,且可用于评估患者预后。多因素分析显示SALM3 表达和TNM 分期是预测胰腺癌患者预后不良的独立指标。肿瘤由肿瘤细胞及间质成分组成,间质成分包括成纤维细胞、免疫细胞、血管和特异的间充质细胞等,间质成分参与并促进肿瘤生长和转移[7]。肿瘤间质中的免疫细胞,尤其是巨噬细胞,能通过诱导肿瘤血管生成,刺激肿瘤细胞的增殖、浸润和远处转移。SALM3/LRFN4 在单核细胞系中表达,在向巨噬细胞分化的单核细胞中SALM3 表达上调,并在诱导单核/巨噬细胞向炎症部位迁移中起着重要的作用[10-11]。最近研究[7]发现,SALM3 不仅在胃癌组织中表达增高,而且在癌间质成纤维细胞中表达也增高。因此,推测SALM3 也参与了胰腺癌的播散与复发。
综上所述,胰腺癌中SALM3 表达水平具有重要的临床意义,SALM3 的表达与患者的生存呈负相关。SALM3 也是影响胰腺癌患者预后的独立危险因素。然而,需要通过更大的样本及更多的实验来研究SALM3 在胰腺癌中的表达情况及其在肿瘤发生发展中的机制,使之成为预测胰腺癌临床预后的潜在标志物,并有望成为胰腺癌生物治疗的潜在靶点。
