基于壳聚糖的还原敏感型siRNA 纳米递送系统的构建及性质研究*
2022-05-21刘婷婷吴祯倩许伯慧
刘婷婷,杨 寒,吴祯倩,许 燕,许伯慧*
(南通大学药学院,南通 226001)
RNA 干扰技术(RNA interfering,RNAi)自1998年被A.Z.FIRE 和C.C.MELLO 两位科学家发现,并于2006 年获得诺贝尔生理学或医学奖后,目前已有产品获批上市[1]。近年来,RNAi 成为基因药物研究和开发的热点和重点,具有广阔的临床应用前景。其中,小干扰RNA(small interfering RNA,siRNA)可以根据致病基因mRNA 的基因序列进行人工设计合成,因而应用最为广泛。siRNA 具有高度的序列特异性、可传播性和高效性,在罕见病、遗传病和肿瘤等治疗领域极具应用潜力[2-4]。然而,siRNA 在体内的有效递送仍然面临着极大的挑战。siRNA 在体内极易被血清中的核酸酶降解而失活,且易被网状内皮系统消除,半衰期仅15 min[5]。除此之外,siRNA 荷负电且亲水,与负电性的脂质细胞膜的亲和力差,致使其能够被细胞摄取的量极其有限[6]。因此,siRNA 的体内转运和靶细胞递送仍离不开具有潜力的核酸载体。
前期,本课题组将九聚精氨酸(nona-arginine,9R)通过二硫键(-ss-)接枝于壳聚糖(chitosan,CS)骨架合成了还原敏感型载体材料CsR(chitosan-disulfidenona-arginine)[7]。CS 是天然的阳离子碱性多糖,但在生理条件下溶解度差,转染效率低[8-9]。9R 具有高的正电荷密度,可作为基因载体,其结构上的胍基还具有溶酶体膜致孔的功能[10]。二硫键可响应胞内高浓度谷胱甘肽(glutathione,GSH)后发生断裂,快速释放siRNA[11]。基于此,本研究期望设计合成的CsR 可以构建具有良好的核酸保护能力和还原敏感响应性能的siRNA 纳米递送载体。
1 材料与方法
1.1 仪器与试药 BS124S 电子天平(赛多利斯科学仪器(北京)有限公司),RS-4DN 磁力搅拌器(亚速旺(上海)商贸有限公司),90plus Zeta 纳米激光粒度分析仪(美国Brookhaven Instruments 公司),OptimaTMXE-90 超高速冷冻离心机(美国贝克曼库尔特公司),Synergy H1 全功能微孔板检测仪(美国BioTek 公司),JEM-1230 透射电子显微镜(日本JEOL 公司),EPS100 核酸电泳仪、HE120 水平电泳槽(上海天能科技有限公司)。
CsR(实验室自制),三聚磷酸钠(sodium triphosphate,TPP),上海阿拉丁生化科技股份有限公司,分析纯),siRNA、荧光素标记的siRNA(FAM-siRNA)、焦碳酸二乙酯(diethylpyrocarbonate,DEPC)处理水(百奥迈科生物技术有限公司),琼脂糖凝胶H(生工生物工程(上海)股份有限公司),纯水由Millipore 实验室超纯水机制备;其他试剂都为化学纯试剂。
1.2 实验方法
1.2.1 CsR/siRNA 纳米粒(nanoparticles,NPs)的制备方法 以TPP 为聚阴离子胶凝剂,采用离子胶凝法制备CsR/siRNA NPs[12],将确定剂量的siRNA 溶解于DEPC 处理水中,滴加入相应剂量的CsR 溶液,用移液器吹打30 s 混合均匀。随后加入相应浓度的TPP溶液,吹打30 s 混合均匀,室温放置30 min,即形成CsR/siRNA NPs。
1.2.2 粒径和电位测定 将200 μL 新鲜制备的CsR/siRNA NPs 混悬液用去离子水稀释至3 mL 后置于纳米激光粒度分析仪中测定粒径、多分散系数(polydispersity,PDI)和Zeta 电位。
1.2.3 包封率(encapsulation efficiency,EE)的测定
1.2.3.1 标准曲线的制备 选用荧光标记的FAMsiRNA,通过测定荧光强度对siRNA 进行定量分析。将FAM-siRNA 用DEPC 处理水分别稀释为1、2、5、10、20、50、100 和200 ng/mL 的标准溶液,取200 μL各质量浓度标准溶液置于酶标板中,在激发波长为492 nm,发射波长为518 nm 处测定荧光强度(fluorescence intensity,FI)。将测得的FI 值对FAM-siRNA浓度(concentration,C)进行线性回归获得标准曲线方程。
1.2.3.2 EE 的测定 取500 μL 载FAM-siRNA 的CsR NPs 混悬液于1 mL 离心管中,置于超高速冷冻离心机中,在4 ℃条件下,20 000 g 离心30 min。测定上清液的荧光强度,代入标准曲线方程中求得上清液中未被包载的siRNA 的质量浓度(Cunloaded),代入公式计算EE。
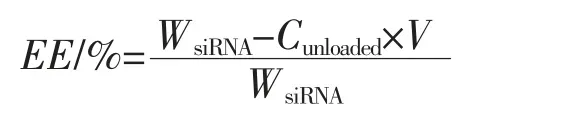
其中,WsiRNA表示加入的总的siRNA 的质量(ng),Cunloaded表示未包载的siRNA 的质量浓度(ng/mL),V表示离心上清液的体积(mL)。
1.2.4 CsR/siRNA NPs 处方因素考察
1.2.4.1 CsR 用量 固定siRNA 的量不变,选取CsR 与siRNA 的质量比(w/w)分别为1:1、5:1、10:1 和20:1,选定TPP 溶液的终浓度为0.5 mmol/L,按照1.2.1项下的方法制备NPs,按照1.2.2 项下的方法测定粒径、多分散系数(polydispersity,PDI)和Zeta 电位,按照1.2.3 项下的方法测定EE。
1.2.4.2 胶凝剂TPP 的浓度 固定CsR 与siRNA的质量比为20:1,选取TPP 的浓度分别为0.1、0.5、1、5 和10 mmol/L,按照1.2.1 项下的方法制备NPs,按照1.2.2 项下的方法测定粒径、PDI 和Zeta 电位,按照1.2.3 项下的方法测定EE。
1.2.5 形态观察 将CsR/siRNA NPs 混悬液点样于铜网上,室温干燥后,置于80 kV 透射电子显微镜下观察NPs 形态。
1.2.6 CsR NPs 的siRNA 保护能力研究
1.2.6.1 结合能力实验 分别选取CsR 和siRNA 的质量比为1:1、5:1、10:1 和20:1 的处方制备NPs 进行琼脂糖凝胶电泳实验。将15 μL CsR/siRNA NPs 混悬液与6×DNA 上样缓冲液混匀后上样于含Gel Red的2%琼脂糖凝胶中,以0.5×Tris-醋酸-乙二胺四乙酸二钠(TAE)为电泳缓冲液,在100 V 电压下电泳20 min 后用紫外透射仪观察siRNA 条带的迁移情况。
1.2.6.2 抗核酸酶降解实验 分别将裸siRNA 和CsR/siRNA NPs 置于终质量浓度为0.02 mg/mL 的RNase A 溶液中,在37 ℃条件下孵化30 min,随后加入RNase 抑制剂(80 U)孵化30 min 终止反应。用1%肝素钠溶液在37 ℃条件下孵化30 min 游离NPs中的siRNA。以裸siRNA 和CsR/siRNA NPs 在DEPC 处理水中孵化为无酶对照组,相同条件孵化后游离siRNA,进行琼脂糖凝胶电泳实验,具体方法同1.2.6.1。
1.2.6.3 血清稳定性实验 分别将裸siRNA 和CsR/siRNA NPs 与50%的胎牛血清在37 ℃条件下孵化0、1、2、4、8、12 和24 h,随后用1%的肝素钠在37 ℃条件下孵化30 min 游离NPs 中的siRNA 进行琼脂糖凝胶电泳实验,具体方法同1.2.6.1。
1.2.7 CsR/siRNA NPs 还原敏感响应行为研究 将CsR/siRNA NPs 分别与终浓度为0、10 μmol/L、5 mmol/L、10 mmol/L 和20 mmol/L 的GSH 在37 ℃条件下孵化45 min 后进行琼脂糖凝胶电泳实验,具体实验同1.2.6.1,观察siRNA 条带的迁移情况。
2 结 果
2.1 FAM-siRNA 的标准曲线 测定各浓度FAMsiRNA 溶液的荧光强度,将荧光强度值对质量浓度进行线性回归,得方程FI=17.603C+293.4,R2=0.999 4。结果表明,在质量浓度范围为1~200 ng/mL,FAMsiRNA 的荧光强度与质量浓度线性相关性良好,可以用于FAM-siRNA 的定量分析。
2.2 CsR/siRNA NPs 处方因素考察
2.2.1 CsR 用量对NPs 形成的影响 CsR 用量对NPs 的粒径、PDI、Zeta 电位和EE 的影响结果见表1。
表1 CsR 用量对NPs 粒径、PDI、Zeta 电位和EE 的影响(n=3,)
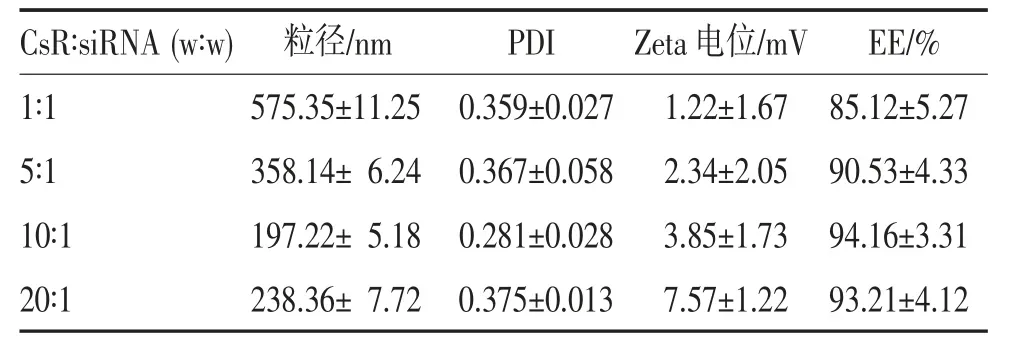
表1 CsR 用量对NPs 粒径、PDI、Zeta 电位和EE 的影响(n=3,)
2.2.2 TPP 浓度对NPs 形成的影响 TPP 浓度对NPs 的粒径、PDI、Zeta 电位和EE 的影响结果见表2。
表2 TPP 浓度对NPs 粒径、PDI、Zeta 电位和EE 的影响(n=3,)
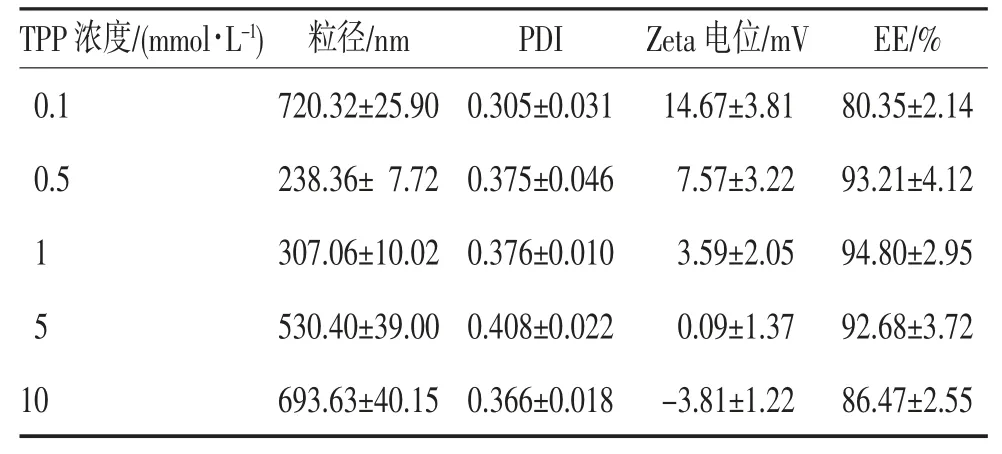
表2 TPP 浓度对NPs 粒径、PDI、Zeta 电位和EE 的影响(n=3,)
2.3 CsR/siRNA NPs 形态考察 采用透射电子显微镜观察CsR/siRNA NPs 的形态,如图1A 所示,CsR/siRNA NPs 为边缘光滑的圆球体,粒径约200 nm。
2.4 CsR NPs 的siRNA 结合能力 选取CsR/siRNA质量比分别为1:1、5:1、10:1 和20:1 的NPs 进行凝胶阻滞实验,结果见图1B。CsR 用量较少时,siRNA 迁移出上样孔外,随着CsR 用量的增加,siRNA 条带向正极迁移的量越来越少,当CsR 与siRNA 的质量比达到20:1 时,siRNA 被完全阻滞于孔中。结果表明,CsR 具有较强的siRNA 结合能力,可高效压缩siRNA形成稳定的NPs。
2.5 抗核酸酶降解能力 裸siRNA 和CsR/siRNA NPs(20:1,w/w)分别与DEPC 处理水和RNase A 孵化后,游离siRNA 后进行琼脂糖凝胶电泳实验,结果见图1C。无酶对照组中,裸siRNA 和NPs 中的siRNA都保持完整,暴露在核酸酶中的siRNA 条带降解完全,而CsR NPs 保护的siRNA 条带仍然明亮清晰。结果表明,CsR NPs 可以有效保护siRNA 免受核酸酶降解。
2.6 血清稳定性 裸siRNA 和CsR/siRNA NPs(20:1,w/w)分别与50%胎牛血清孵化0、2、4、8、12 和24 h后,游离siRNA 进行琼脂糖凝胶电泳实验,结果如图1D。裸siRNA 与血清孵育不到4 h 即被完全降解,而CsR NPs 可以保护siRNA 在血清中至少稳定24 h。
2.7 CsR/siRNA NPs 还原敏感响应行为 CsR NPs分别与终浓度0、10 μmol/L、5、10 和20 mmol/L 的GSH 溶液在37 ℃条件下孵化45 min,NPs 响应GSH还原环境释放siRNA 的行为如图1E 所示。当GSH浓度<10 μmol/L 时,绝大多数的siRNA 被阻滞于孔中,当GSH 浓度达到5 mmol/L 时,siRNA 条带向正极发生明显迁移,表明CsR NPs 可以响应高浓度GSH 还原环境释放siRNA。
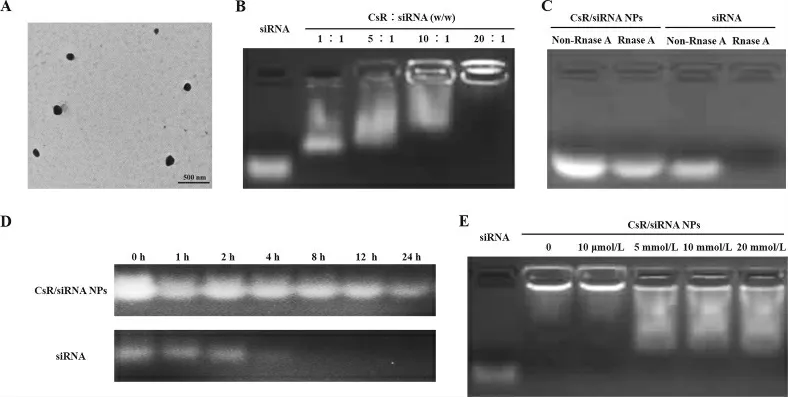
图1 CsR/siRNA NPs 构建及性质研究结果
3 讨 论
3.1 CS/siRNA NPs 处方因素考察 CS 和9R 分子富含正电荷,为常用的基因载体,将9R 接合于CS 骨架,可增加载体的正电荷密度,提高载体的正电性。本研究中,CsR/siRNA 纳米粒的构建采用离子胶凝法,CsR 与荷负电的siRNA 以静电力结合,聚阴离子TPP 与带正电荷的CsR 产生强烈的电性相互作用而使其交联胶凝化形成NPs。在NPs 制备过程中,CsR和TPP 的用量是NPs 的关键处方因素。
当CsR 用量较低时,随着CsR 用量的增加,NPs粒径降低,当CsR 与siRNA 质量比达到10:1 时,粒径最小,随后粒径随着CsR 用量的提高而增大。在聚阴离子浓度一定的条件下,其交联CsR 的能力一定。当CsR 浓度较低时,相对过量的TPP 易产生过度交联而形成粒径较大的NPs。随着CsR 浓度的增加,交联度相应下降,粒径降低。但当CsR 浓度进一步升高时,粒径又有增加的趋势,此时TPP 与CsR 的交联度不够,不能形成紧实的NPs 而表现为粒径增加。然而,即便在CsR 用量较低的情况下,CsR NPs的EE 依然可以达到85%左右。随着CsR 用量的增加,Zeta 电位不断升高,EE 也呈上升趋势。
TPP 浓度为0.1 mmol/L 时,聚阴离子浓度较低,其与CsR 交联不足而形成疏松的NPs 结构,因而粒径较大。当TPP 浓度达到0.5 mmol/L 时,交联形成的NPs 粒径迅速降低,形成较为致密的NPs 子。随着TPP 浓度的不断增加,形成的纳米粒子之间会产生过度交联,进而引起粒径的进一步增加。同时,Zeta 电位随着聚阴离子TPP 浓度的增加而降低。除此之外,TPP 浓度对EE 的影响与胶凝形成NPs 的程度有关,交联度较低或过高都会导致包封率下降。
3.2 CsR NPs 保护siRNA 能力的验证 琼脂糖凝胶电泳实验用于验证CsR NPs 与siRNA 的结合以及保护siRNA 抗核酸酶和血清降解的能力。CsR 与siRNA 通过静电力结合,当结合力较小时,电泳的电压差会使siRNA 从上样孔中游离出来向正极移动。当CsR 用量达到20:1 时,siRNA 则完全被阻滞于孔中,表明该处方的NPs 具有很好的siRNA 结合能力。将CsR/siRNA NPs 分别与核酸酶和血清孵化,采用荷负电的肝素钠置换载体中的siRNA,前期实验[7]证明1%肝素钠可以使CsR NPs 中的siRNA 完全游离出来。裸siRNA 在核酸酶中快速降解,条带消失,而CsR NPs中的siRNA 条带明亮,未被降解。同样,裸siRNA在血清中孵育4 h 后条带消失,几乎降解完全,而CsR NPs 保护的siRNA 可以维持稳定长达24 h。
3.3 CsR NPs 还原敏感响应行为 CsR 中的二硫键可以响应肿瘤细胞内高浓度的GSH 还原敏感环境发生断裂,其断裂的速度和程度与GSH 浓度有关。GSH 在血液循环中、细胞外基质和细胞表面的浓度很低(2~10 μmol/L),而细胞内胞质中GSH 浓度可达2~10 mmol/L。然而,肿瘤组织比正常组织具有更高的还原性,其GSH 浓度可达20 mmol/L[13-14]。琼脂糖凝胶电泳实验表明,NPs 在胞外低浓度GSH 条件下不释放siRNA,当达到胞质内高GSH 浓度时,二硫键发生断裂,siRNA 迅速从NPs 中释放出来。细胞质是siRNA 实现基因沉默的关键场所[15],利用胞质高浓度的GSH 设计还原敏感型的纳米载体可实现siRNA 的快速释放,以获得高效的基因沉默效应。
综上所述,本课题将CsR 与TPP 通过离子胶凝法构建siRNA 纳米递送载体,当CsR 与siRNA 的质量比为20:1,胶凝剂TPP 浓度为0.5 mmol/L 时,制备得到粒径、电位和EE 均较优的NPs,透射电子显微镜观察NPs 形态为200 nm 左右的球形粒子。CsR NPs 可以与siRNA 紧密结合,使其免受核酸酶降解,并有效保护siRNA 在血清中稳定24 h。在血液和细胞外低浓度GSH 环境中,siRNA 可被稳定压缩于CsR NPs 中,而当NPs 进入胞质高浓度GSH 还原环境时,CsR 二硫键断裂,siRNA 快速释放。CsR NPs 因而具有良好的siRNA 保护能力和还原敏感响应性能,可作为siRNA 体内递送的理想纳米载体。
