GLP-1RA 联合SGLT2i 治疗超重/肥胖T2DM 患者效果及安全性的临床观察性研究*
2022-05-21冯媛媛羌雯慧王鑫蕾赵絮影顾云娟
冯媛媛,羌雯慧,肖 静,印 彤,王鑫蕾,赵絮影,袁 洁,顾云娟*
(南通大学附属医院内分泌科,南通 226001)
超重/肥胖已被证明是2 型糖尿病(type 2 diabetes,T2DM)的危险因素之一[1]。随着体质量指数(body mass index,BMI)的升高,T2DM 的患病率上升[2]。我国超重和肥胖人群中糖尿病患病率分别为12.8%和18.5%[3],而糖尿病患者中超重占41.0%,肥胖占24.3%[4]。M.E.LEAN 等[5]研究表明减重10~15 kg,糖尿病缓解率为57%;减重>15 kg,糖尿病缓解率达86%。减重方法主要有饮食运动控制、药物、手术等。但多数患者在生活方式干预的基础上,血糖控制仍依赖降糖药物。近年来,新型降糖药物胰高血糖素样肽-1 受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1RA)和钠-葡萄糖协同转运蛋白2 抑制剂(sodium glucose cotransporters 2 inhibitor,SGLT2i)以其独特的药理作用机制及临床疗效,被推荐用于超重/肥胖T2DM 患者。GLP-1RA 以葡萄糖依赖的方式增加胰岛素的分泌,抑制胰高血糖素的分泌,抑制胃肠道的运动,抑制食欲,延缓胃排空并增加饱腹感,在有效降糖的同时,还有减少体质量的效果[6]。SGLT2i 通过抑制近端肾小管中的SGLT2 来促进尿糖排泄,直接排除机体内多余的能量,降糖同时起到间接减重作用[7]。来自中国T2DM 人群实际情况的有效数据目前还很有限。本文旨在通过对中国超重/肥胖T2DM 患者联合使用GLP-1RA 与SGLT2i治疗12周,观察临床疗效,评估安全性。
1 对象与方法
1.1 对象及分组 南通大学附属医院内分泌科2018 年9 月—2020 年10 月住院或门诊收治的18~70 岁的超重/肥胖T2DM 患者严格按照随机数字表随机入组病例,尊重患者意愿自主选择是否退出,直至每组入组40 例为止,共160 例。纳入标准:符合T2DM 诊断标准;糖化血红蛋白(glycosylated hemoglobin,HbA1c)≥7%;BMI≥24 kg/m2;腰围≥85 cm(女),≥90 cm(男);既往未使用GLP-1RA、SGLT2i,3 个月内未使用二肽基肽酶-Ⅳ抑制剂。排除标准:1 型糖尿病;T2DM 急性并发症;严重心肺功能损伤、慢性肾功能不全需透析或肾移植者;急、慢性胰腺炎;恶性肿瘤;6 个月内发生过严重低血糖。患者分为GLP-1RA 组(A 组)、SGLT2i 组(B 组)、GLP-1RA+SGLT2i 组(C 组)、对照组(D 组),观察12 周。入组后A、B、C 组患者分别在原用药基础上加用GLP-1RA、SGLT2i、GLP-1RA+SGLT2i,D 组对原治疗方案的剂量进行调整。GLP-1RA:利拉鲁肽[诺和诺德(中国)制药有限公司,国药准字J20160037,3 mL:18 mg]、度拉糖肽(Vetter Pharma-Fertigung GmbH &Co.KG,国药准字S20190022,1.5 mg:0.5 mL);SGLT2i:达格列净(阿斯利康制药有限公司,国药准字J20170040,10 mg/片)、卡格列净(Janssen Ortho,LLC,美国,批准文号H20170375,100 mg/片)、恩格列净(Boehringer Ingelheim Pharma GmbH&Co.KG,国药准字J20171073,10 mg/片)。本研究通过南通大学附属医院医学伦理委员会审查(2019-K019),患者均签署知情同意书。
1.2 研究内容
1.2.1 收集社会学资料 患者性别、年龄、糖尿病病程;基线及12 周的身体测量学指标:身高、体质量、腰围、BMI、血压:收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP);基线及观察12周的实验室检查数据:HbA1c、空腹血糖(fasting plasma glucose,FPG)、餐后2 h 血糖(2-hour postprandial blood glucose,2hPBG);空腹胰岛素(fasting insulin,FINS);血脂:总胆固醇(total cholesterol,TC)、三酰甘油(triglycerides,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)。
1.2.2 公式计算(1)稳态模型的胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)=FPG(mmol/L)×FINS(mIU/L)/22.5;(2)胰岛素β 细胞功能指数(homeostasis model assessment of beta cell function index,HOMA-β)=20×FINS(mIU/L)/[FPG(mmol/L)-3.5](%)。
1.3 观察终点 主要观察终点事件:治疗12 周时血糖谱(HbA1c、FPG、2hPBG)及体质量的变化。次要观察终点事件:HOMA-IR、HOMA-β、心血管风险因子(SBP、DBP、TC、TG、HDL-C、LDL-C)。低血糖事件、胃肠道反应及泌尿生殖系感染等不良反应。
1.4 统计学方法 采用SPSS 25.0 统计软件。分类变量采用频数(%)表示,组间比较采用χ2检验;连续变量符合正态分布的变量以表示,基线和干预后组间差异比较采用单因素方差分析,两两比较采用LSD 法,组内基线与干预后比较采用配对样本t检验;不符合正态分布的变量以中位数(四分位间距)表示,基线和干预后组间比较采用多组间独立样本Kruskal-Wallis H 秩和检验,组内基线与干预后比较采用配对样本的Wilcoxon 符号秩和检验,P<0.05 表示差异有统计学意义。
2 结 果
2.1 4 组患者基线情况比较 本研究纳入的160 例患者干预治疗后,有效样本为150 例(93.75%)。各组性别比例、年龄、病程、身体测量学指标、糖代谢指标、心血管风险因子、合并其他降糖药物组间比较差异均无统计学意义(均P>0.05),见表1。
表1 4 组基线情况比较[n,,中位数(四分位间距)]

表1 4 组基线情况比较[n,,中位数(四分位间距)]
2.2 4 种治疗方案血糖谱的改善效果 如表2 所示,4 组治疗前血糖指标HbA1c、FPG 和2hPBG 差异均无统计学意义(均P>0.05)。治疗后,4 组患者HbA1c、FPG 和2hPBG 较治疗前均显著下降(均P<0.001)。HbA1c 下降幅度C 组最高,A 组其次,B 组和D 组最低(B、D 组比较差异无统计学意义);FPG 下降幅度C 组最高,A 组其次,A、B 组间差异无统计学意义,D 组最低(D、A 组间差异有统计学意义,D、B 组间差异无统计学意义);2hPBG 下降幅度C 组最高,A组其次,A、B 组间差异无统计学意义,B 组最低,D、B 组间差异无统计学意义。
表2 4 种治疗方案血糖谱的改善效果比较()

表2 4 种治疗方案血糖谱的改善效果比较()
注:与A 组比较,*P<0.05;与C 组比较,#P<0.05。
2.3 4 种治疗方案体质量、腰围和BMI 的变化 如表3 所示,4 组治疗前体质量、腰围和BMI 差异均无统计学意义(均P>0.05)。治疗12 周后,A、B 和C 组的体质量、腰围和BMI 均显著下降(均P<0.001),而D组体质量、腰围和BMI 变化差异均无统计学意义。体质量、腰围和BMI 下降幅度从高到低依次为C 组、A组、B 组(P<0.01)。
表3 4 种治疗方案体质量、腰围和BMI 变化的比较()
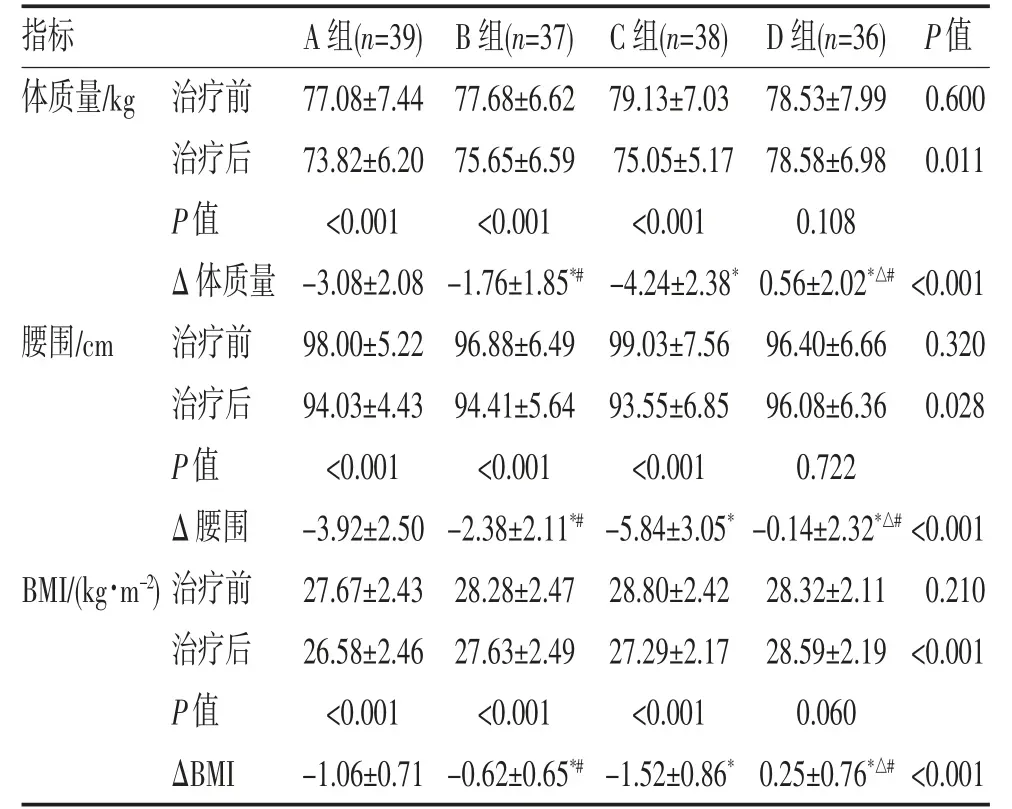
表3 4 种治疗方案体质量、腰围和BMI 变化的比较()
注:与A 组比较,*P<0.05;与B 组比较,△P<0.05;与C 组比较,#P<0.05。
2.4 4 种治疗方案下胰岛素敏感性及胰岛功能的变化 如表4 所示,4 组治疗前HOMA-IR 和HOMA-β比较差异均无统计学意义(均P>0.05),均衡可比。治疗后,A、B、C 组患者HOMA-IR 均显著改善(均P<0.01),而D 组HOMA-IR 的变化差异无统计学意义;且治疗后C 组与D 组间差异有统计学意义,A 组与B、C、D 组,B 组与C、D 组治疗方案间两两比较差异均无统计学意义。4 组患者治疗前后HOMA-β 的改变差异无统计学意义(P>0.05)。
表4 4 种治疗方案胰岛素敏感性及胰岛功能变化比较()
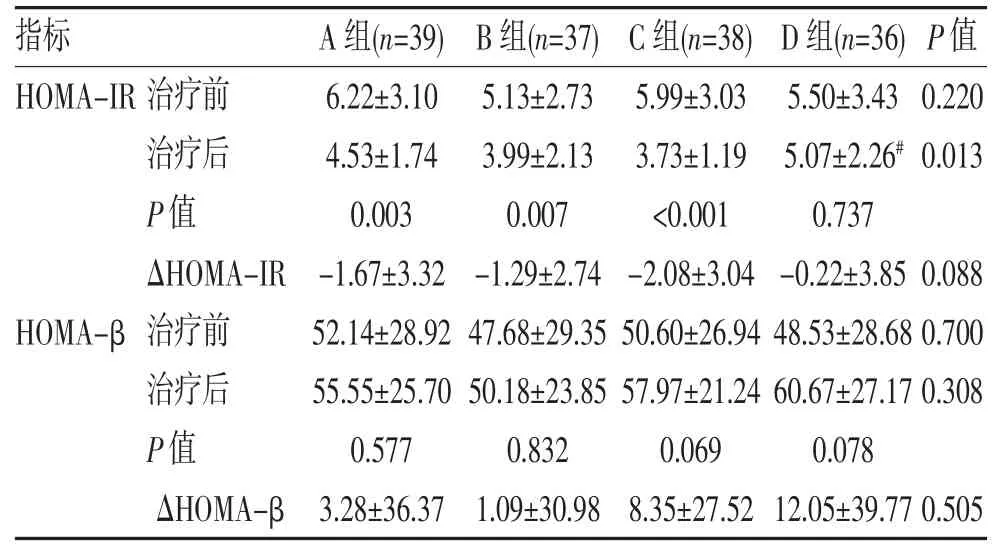
表4 4 种治疗方案胰岛素敏感性及胰岛功能变化比较()
注:与C 组比较,#P<0.05。
2.5 4 种治疗方案心血管风险因子的变化 如表5所示,治疗前4 组心血管风险因子SBP、DBP、TC、TG、HDL-C 和LDL-C 比较差异均无统计学意义(均P>0.05),均衡可比。治疗后,B、C 组患者SBP 降低,A、C 组的HDL-C 升高,C 组LDL-C 下降(均P<0.05)。其余指标在各组差异均无统计学意义(均P>0.05)。且治疗前后的差值在4 种治疗方案间差异无统计学意义(P>0.05)。
表5 4 种治疗方案下心血管风险因子变化的比较[,中位数(四分位间距)]

表5 4 种治疗方案下心血管风险因子变化的比较[,中位数(四分位间距)]
2.6 4 种治疗方案的不良反应 GLP-1RA 治疗后胃肠道反应多见,其中恶心最为常见,A 组9 例(23.1%),C 组8 例(21.1%),随着治疗时间的延长,这种不良反应随之消失。SGLT2i 治疗后以泌尿道感染多见,B 组3 例(8.1%),C 组2 例(5.3%),主要表现为尿白细胞轻度升高,患者无明显尿路刺激症状,停药后复查尿常规均恢复正常。C 组合并使用胰岛素后出现低血糖1 例(2.6%),D 组4 例(11.1%),其中合并使用胰岛素3 例,合并使用促泌剂1 例,均无自觉症状,自测末梢血糖<3.9 mmol/L。治疗过程中未出现急慢性胰腺炎发作、酮症酸中毒、肝肾功能损伤等不良反应。
3 讨 论
本研究发现,GLP-1RA 和SGLT2i 联合治疗可较单药或对照组显著降低HbA1c、FPG 及2hPG。GLP-1RA+SGLT2i 组的HbA1c 降幅达(1.74±1.00)%,相较于O.DÍAZ-TRASTOY 等[8]发现HbA1c 降低1.1%效果更好,其原因可为:研究纳入的患者平均年龄较小(46.67 岁),病程较短,种族不同。此外,GLP-1RA组HbA1c 也有明显下降,而SGLT2i 组HbA1c 降低幅度与对照组相当。Meta 分析[9]表明GLP-1RA 中索玛鲁肽降低HbA1c 效果最好,24 周时能下降1.49%;SGLTi 中埃格列净降低HbA1c 效果最好,24 周时能降0.84%。较本研究中GLP-1RA 组和SGLT2i 组降低幅度都大,这可能与本研究观察时间较短,且使用药物种类不同有关。
GLP1-RA 和SGLTi 具有一定的减重效果,尤其是两药联用可减重2.69~4.60 kg[10]。本研究同样证实,两药联用可减重达(4.24±2.38)kg,显著大于其他3组。但减重程度少于单药治疗减重的总和,这可能与两药减重机制不同有关,说明两药联合使用对体质量的降低不是累积作用,不会引起体质量爆发式地下降。尿糖排泄增加是SGLT2is 导致体质量减轻的原因,而食欲抑制和能量摄入减少是GLP-1RAs 导致体质量减轻的主要原因。本研究发现GLP-1RA组、SGLT2i 组、GLP-1RA+SGLT2i 组较对照组显著降低腰围。研究[11-12]证实利拉鲁肽能显著减少腰围2~3 cm,且腰围基线越大,降低腰围越多。同样,使用SGLT2i 达格列净也可以减少T2DM 患者体内脂肪含量和内脏脂肪[13],而不影响肌肉含量。
在T2DM 患者中,BMI 与胰岛素抵抗呈正相关[14]。本研究结果发现,超重/肥胖T2DM 患者有明显的胰岛素抵抗。GLP-1RA 和SGLT2i 联合治疗可显著减少胰岛素抵抗(P<0.05),但治疗后HOMA-β 无统计学意义,这可能与治疗时间较短有关。已有研究[15]证明与对照组相比,GLP1-RA、SGLT2i 能改善胰岛B细胞功能。M.MARRE 等[16]研究发现使用利拉鲁肽后胰岛素原/胰岛素比值显著降低,HOMA-β 增加。Y.KOIKE 等[17-18]证明卡格列净、达格列净能改善肝脏和肌肉的胰岛素抵抗。
本研究结果显示SGLT2i 组、GLP-1RA+SGLT2i组治疗后SBP 明显下降,这可能与SGLT2i 有渗透性利尿作用有关。GLP-1RA+SGLT2i 组降低幅度最大,较GLP-1RA 组多降低1.85 mmHg,较SGLT2i 组降低0.37 mmHg,比Meta 分析[19]降低幅度小,这可能与治疗时间较短有关。本研究中GLP-1RA+SGLT2i组有降低LDL-C、升高HDL-C 的作用。研究[8]表明GLP-1RA 与SGLT2i 联用可改善HDL-C 水平,对TC、TG、LDL-C 效果不明显。
GLP-1RA 较常见的不良反应是胃肠道不适,SGLT2i 较常见的不良反应是泌尿系统的感染,两药几乎不发生低血糖,这与文献[20]结果一致。
综上所述,超重/肥胖T2DM 患者使用GLP-1RA+SGLT2i 联合治疗较单药治疗在降糖、减重、减少胰岛素抵抗、改善心血管风险因素有优势。GLP-1RA 组主要不良反应为胃肠道反应,SGLT2i 组主要为尿路感染。
