NR4A家族蛋白结构与功能的研究进展*
2022-05-20蒋龙英陈永恒
蒋龙英,陈永恒
[中南大学湘雅医院肿瘤科(国家卫健委肿瘤蛋白质组学重点实验室),湖南长沙 410008]
核受体(nuclear receptor, NR)是一类广泛分布在细胞内的真核转录因子,通过调控多种关键基因的转录及表达,参与人体炎症、免疫反应,以及肿瘤的发生、发展等多种病理生理过程[1]。迄今为止,在人体内共发现了48 种核受体蛋白。根据其功能的不同被分为7 个亚家族(NR0~NR6),这些蛋白有着相似的结构域,存在于不同的组织和细胞中,可通过与配体结合,招募辅调节因子,调控下游基因的转录和表达,发挥多种不同的功能[2]。在这些蛋白中,有一类特殊的蛋白,因尚无内源性配体的发现,而被称为孤儿核受体(orphan nuclear receptor)。 孤儿核受体第4 亚科A 组(nuclear receptor subfamily 4, group A, NR4A)属于典型的孤儿核受体家族蛋白,包括NR4A1(Nur77、NGFI-B),NR4A2(Nurr1)和NR4A3(NOR-1)3 个成员[3]。NR4A是一类即时的早期反应基因,可被胞内外多种刺激迅速诱导,调节机体代谢和免疫反应,参与肿瘤等多种疾病的发生、发展[4]。本文将从结构和功能两方面综述NR4A 家族蛋白的研究进展。
1 NR4A 的结构组成及功能
NR4A 蛋白的功能域见图1:配体非依赖的转录激活域(AF1, TAD),DNA 结合域(DBD),铰链区(hinge region, H),配体结合域(LBD),配体依赖的转录激活区(AF2)[5]。AF1 域主要通过与其他转录因子的相互作用,调控激活转录。DBD 域由两个高度保守的C4 锌指结构及C 末端延伸区(CTE)组成,其中的N 端的螺旋识别并结合在DNA 大沟,CTE 识别DNA 小沟加强对DNA 的结合。DBD 域特异性识别结合特定的DNA 序列,调节下游靶基因的表达[6]。H 域连接DBD 与LBD,主要参与蛋白的核定位。LBD 由12 个α-螺旋组成(H1~H12),其配体结合口袋被大量的芳香氨基酸及疏水残基填充,难以结合配体[7]。AF2 位于LBD 的C 端,并有大部分的重叠,是依赖配体的转录激活域。
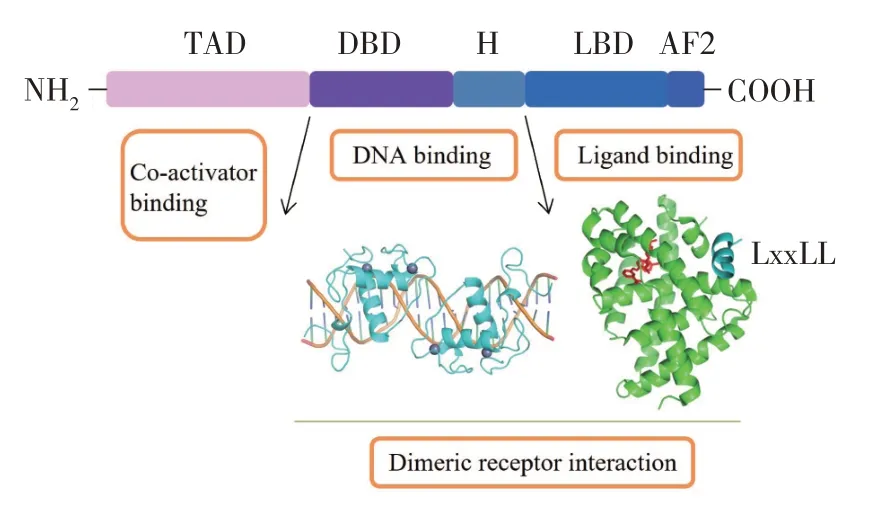
图1 NR4A 的结构组成及功能
2 NR4A的转录调控机制
NR4A 是一类不依赖于配体激活的主动转录因子,其对靶基因的转录激活作用主要是依赖N 末端的AF1 域。而其本身的表达、转录、翻译后修饰(磷酸化、泛素化等过程)可被多种外界刺激激活[8]。激活后的NR4A 以单体或二聚体形式识别并结合下游靶基因的启动子调控其转录与表达。
NR4A 通过单体形式结合下游基因启动子上的NGFI-B 反应元件(NBRE:AAAGGTCA)上(见图2A),从而发挥重要的生理作用[6]。NR4A 也可以以同源二聚体结合启动子区域的Nur 反应元件(NurRE)。PHILIPS 等[9]研究表明NR4A1 和NR4A2可以与一种在类吗啡样神经肽(POMC)启动子上发现的NurRE 元件(TGATATTACCTCCAAATGCCA)结合形成同源二聚体(见图2B)。NurRE 元件是由2 个半位点(NBRE)的回文结构组成的。NR4A1在体内的信号功能有可能是由于NurRE 形成的二聚体介导的,MARIA 等[10]证实NR4A1 识别NurRE 时,可对内分泌系统及淋巴系统的生理刺激有反应,而NR4A1 识别其他靶基因却没有这种反应。结合NR4A1 与NurRE 元件复合物的晶体结构及结构模拟发现,虽然在DNA 结合域之间没有观察到蛋白的相互作用,但在其配体结合域之间可能存在蛋白-蛋白相互作用[11]。这些相互作用可能对NR4A 家族蛋白发挥功能起到重要作用。此外,JOLMA 等[12]通过高通量指数富集的配体系统进化技术(SELEX)和芯片测序(ChIP-seq)对人类转录因子的大样本分析表明,NR4A 可以结合另外2 个不同的NurRE基序:一个名为ER0 的基序由2 个翻转的8 个核苷酸半位点(NBRE)组成,没有间隔(见图2C);另一个是IR5,由2 个反向的8 个核苷酸半位点(NBRE)重复序列组成,间隔为5 个核苷酸(见图2D)。通过ChIP-seq 数据分析,发现在体内诸多重要基因(如Foxo1,Cyp17a1等)的启动子区域发现了这2 个位点,提示NR4A 家族蛋白在体内可通过结合NurRE 形成同源二聚体调控下游基因的表达,该发现扩大了NR4A 调节表达的靶基因范围,让人们认识到NR4A 蛋白参与人体功能的更多可能[13]。

图2 NR4A家族蛋白的DNA识别结构模型
NR4A 家族蛋白除了形成单体或者同源二聚体以外,也可以与RXRα 或者RXRγ 结合形成异源二聚体识别DR5 元件或者IR5 元件来激活下游基因的转录,这一机制在大脑多巴胺神经元中起到重要作用[14]。RXRγ 与NR4A1 结合后可以增加RXRγ 的转录活性,进一步增强RXR 配体9-cis-RA 的活性;NR4A1 与RXRα 结合也会促进9-cis-RA 对RXRα 转录激活[15]。前列腺癌细胞中,在凋亡刺激因子作用下,只有RXRα 存在,NR4A1 才能从胞核转移到线粒体上,并在线粒体中通过与BCL-2基因相互作用诱导凋亡[16]。
3 NR4A与疾病的关系
NR4A 家族广泛表达于多个组织中,最早是在神经系统中被发现的。在后续的研究中,NR4A 被证明在造血系统、脂肪组织、肝脏组织中也至关重要。在这些组织中,NR4A 家族成员的功能可分为两类:激活或抑制转录目标的表达。除了直接调节靶基因表达以外,NR4A 可通过与其他蛋白(如BCL-2)相互作用,参与体内多条信号通路,影响细胞的增殖和凋亡,参与神经系统、心血管系统及肿瘤等多种疾病的发生发展[5]。
3.1 NR4A与神经系统疾病
NR4A2 在脑组织中广泛表达,主要存在于大脑皮质和海马等端脑结构中,其在多巴胺能神经元中的作用研究最为广泛[17]。NR4A2 通过调节多巴胺的合成和代谢,影响多巴胺神经元的发育和稳态。NR4A2-/-小鼠在脑黑质/腹侧被盖区表现出多巴胺选择性地丢失,不能产生中脑多巴胺能神经元,小鼠生存活性降低,并在出生后早期迅速死亡[18]。帕金森病模型杂合性NR4A2 小鼠的神经功能呈现年龄相关性下降,其中NR4A2 表达的减少增加了1-甲苯基-4-苯基-1,2,3,6-四氢吡啶(MPTP)对中脑多巴胺神经元的损伤,表明NR4A2 有神经保护功能[19]。在201 例帕金森病患者和221 例年龄匹配的对照组的基因筛查中发现2 个与帕金森病相关的突变,存在于NR4A2 的外显子中(309C-T 突变和-245T-G 突变)。NR4A2 点突变通过减少酪氨酸羟化酶(多巴胺合成中的限速酶)的表达导致帕金森病的发生[20],NR4A2 的低表达也可提高帕金森病进展的风险。实验表明NR4A2 可通过限制小胶质细胞产生神经毒性介质,维持移植神经干细胞的存活,保护多巴胺能神经元免受神经炎症损伤[21-22]。这表明,NR4A2 是调节中枢神经系统中多种生理功能的重要因素,提示NR4A2 在预防和治疗包括帕金森病在内的神经退行性疾病中具有强大的潜力。在帕金森病小鼠模型中,NR4A2 的激活剂C-DIM12 通过调节NR4A2 的转录活性和血脑屏障,抑制神经胶质细胞的激活,防止多巴胺神经元胞体损失,减少核因子-κB(NF-κB)调节的炎症基因表达,保护多巴胺神经元,有望用于治疗包括帕金森病在内的神经退行性疾病[23]。
3.2 NR4A2与免疫相关疾病
NR4A 家族蛋白调控多种免疫细胞的分化过程,参与多种免疫相关疾病的发生发展。NR4A2的抗炎活性主要是通过影响NF-κB 信号通路发挥作用。在NF-κB 信号通路,如肿瘤坏死因子-α(TNF-α) 和细菌脂多糖(LPS) 的炎症刺激下,NR4A2 能形成共抑制复合物,起到抗炎的作用[24]。NR4A2 也可以激活负调控因子AP-1 的表达,抑制炎症因子的表达,起到抗炎的效果[25]。NR4A2 参与Th17 细胞的成熟和分化,也可以激活转录因子Foxp3 的表达,激活调节性T 细胞(Treg 细胞)的分化。有研究[26-27]发现,NR4A基因敲除小鼠体内的Treg 细胞显著减少,这会引发机体强烈的自身免疫性反应,导致自身免疫性疾病。NR4A2 与其他具有抗炎活性的可溶性细胞表面介质(如IL-10、TGF-β、TAM 受体配体)作用,对调节活化的免疫细胞和神经胶质细胞的炎症信号,以及炎症信号的分辨非常重要[28]。NR4A2 可促进滑膜细胞的增殖导致关节炎,而干扰滑膜细胞中内源性NR4A2 的表达可以减轻关节的损伤程度,提示NR4A2 可能成为关节炎的治疗靶点[29]。
3.3 NR4A2与心血管疾病
血管壁受损后,参与血管重建细胞(巨噬细胞、血管内皮细胞和平滑肌细胞)的NR4A 受体家族蛋白表达会上调,以应对微环境变化[30]。动脉粥样硬化病变患者巨噬细胞中高表达的NR4A 蛋白是通过参与NF-κB 信号通路来发挥作用的。PEI 等[31]研究证实,小鼠巨噬细胞中NR4A1 可通过直接结合IKKi基因启动子上的NBRE 位点来激活IKKi的表达,激活NF-κB 信号通路。BONTA 等[32]的研究发现,在THP-1 细胞系中,NR4A 受体家族3 个蛋白过表达可使炎症因子TNF-α,LPS、IL-1β 和趋化因子的表达降低,减少巨噬细胞对氧化低密度脂蛋白的摄取。在血管内皮细胞中,血管内皮生长因子(VEGF)诱导表达上调的NR4A3 参与多条信号通路,包括激活蛋白激酶C、钙动员和钙调神经磷酸酶信号,促进动脉粥样硬化病变的发展。有研究[33]发现,平滑肌细胞中的NR4A 受体家族蛋白也会被外部刺激诱导高表达,小鼠平滑肌细胞中的有丝分裂刺激可诱导NR4A3 mRNA 表达上调,超过原来的600 倍,除此之外,动静脉平滑肌细胞的周期伸展运动可以提高NR4A1 的转录水平;平滑肌细胞中的NR4A3 参与的是RAS-MEK-ERK1/2 信号通路,沉默平滑肌细胞中的NR4A1 通过减少DNA 合成,增加p27Kip1 蛋白的表达,表现出抗增殖活性;而miR-145 负调控NR4A2,缺乏miR-145的小鼠由于其高表达NR4A2 而对动脉粥样硬化斑块的形成具有抵抗作用。总的来说,在动脉粥样硬化病变进程中,NR4A3 促进动脉粥样硬化病变的发展,而NR4A1 和NR4A2 可减轻动脉粥样硬化,可能成为预防和治疗心血管疾病的标志物。
3.4 NR4A2与肿瘤
肿瘤的发病机制及进程非常复杂,一直是科学研究的重点。NR4A 受体表达改变已在许多实体瘤中被发现。NR4A1 和NR4A3 受体表达的减少与血液恶性肿瘤包括急性髓性白血病和慢性骨髓增生性疾病相关。NR4A 受体在多种肿瘤组织中通过上调介导细胞周期调控的细胞周期素D2(Cyclin D2)、介导细胞凋亡抑制的转录因子E2F1、介导活性氧类物质生成的硫氧还蛋白5(TXNDC5)等多种靶基因促进细胞增殖。因此,针对NR4A 受体的抗肿瘤药物也一直都是研究的重点。目前针对NR4A 受体药物的开发策略包括靶向NR4A 受体的表达、核输出,以及与辅因子的相互作用。针对NR4A 受体的靶向药物有助于提高肿瘤对放化疗的敏感性。Csn-B 是从真菌中分离出来的化合物,是NR4A1 的配体,通过激活NR4A1 靶基因,诱导NR4A1 的表达,将NR4A1 转运至线粒体引起细胞色素C 的释放,诱导细胞凋亡,延缓异种移植瘤的生长,Csn-B 可能是治疗癌症的新的候选或者先导化合物[34]。从化合物库中筛选出的靶向NR4A1 的化合物THPN,诱导NR4A1 从胞质向线粒体转移,在黑色素瘤细胞系中证实NR4A1/THPN 结合后,NR4A1 可结合线粒体外膜上的NIX 及腺嘌呤核苷酸移位酶1,通过线粒体外膜通道上的转位酶进入线粒体内膜,诱导细胞自噬过程导致细胞死亡[35]。在胰腺癌细胞中的Nur77 受体激动剂(DIM-CpOPHCH3)是潜在的NR4A1 激动剂;然而,该化合物对人NR4A1 仅是弱激动剂,并且大多数CDIMs 表现出抑制效果。高活性的NR4A1 拮抗剂(DIM-C-pPhOH)与NR4A1-LBD 独特的相互作用,直接作用于核NR4A1 并表现出NR4A1 拮抗活性,在癌细胞系和肿瘤中显示DIM-C-pPhOH 是一种高效抗癌剂,提示NR4A1 拮抗剂是新一类重要的抗癌药物[36-37]。结直肠癌中,PGE2 以cAMP/蛋白激酶a 依赖的方式诱导NR4A2 表达,这一机制可促进鳞状细胞癌对氟尿嘧啶的耐药性[38-39]。NR4A 受体的DNA 修复作用也可能有助于放化疗的耐受(如博莱霉素)。紫杉醇能够模拟NR4A1 的功能活性,直接靶向结合线粒体膜蛋白Bcl-2,改变Bcl-2 构象,使其从抗凋亡蛋白转变为促凋亡蛋白,触发凋亡进程。
4 结论与展望
综上所述,NR4A 家族蛋白是一类孤儿核受体,是由多种应激源诱导的早期基因,在肿瘤中的作用越来越被重视。针对NR4A 蛋白的结构研究为更好地了解NR4A 受体识别结合不同的靶基因的分子机制提供了理论基础,尤其是针对其二聚体的结构研究有助于了解基因协调表达的分子机制。而针对NR4A 蛋白的功能研究为了解肿瘤发生过程中的分子机制及抗肿瘤治疗提供了新的思路,在开发新的抗癌策略方面具有潜力。
