基于二代测序技术ghrelin作用后人卵巢癌细胞差异表达lncRNA的生物信息学分析
2022-05-20宋婉莹萨日盖高海宁赵鹏伟
宋婉莹,萨日盖,高海宁,赵鹏伟
(1.兴安盟人民医院,内蒙古乌兰浩特 137400;2.内蒙古医科大学,内蒙古呼和浩特 010059;3.内蒙古医科大学基础医学院微生物与免疫学研究室,内蒙古呼和浩特 010059)
卵巢癌是一种异质性的恶性肿瘤,占女性所有恶性肿瘤的2.5%,由于生存率低,卵巢癌死亡人数占女性癌症死亡人数的5%[1],是致死率最高的妇科肿瘤,严重威胁女性生命健康。新兴的分子靶向治疗可特异性干扰致癌靶点,可能是提高卵巢癌治疗效果的有效途径。但目前卵巢癌相关治疗靶点十分有限,迫切需要研究卵巢癌关键靶基因和调控靶基因的药物及网络。ghrelin 是与恶性肿瘤细胞增殖、侵袭等相关的生长激素促分泌素受体的天然配体,有学者发现[2-3],ghrelin 能够调控人卵巢癌细胞的增殖、凋亡及自噬过程,但其在非编码RNA(non-codingRNA, ncRNA)水平上是如何影响卵巢癌进展的报道较少。长链非编码RNA(lncRNA)是长度>200 bp的ncRNA,起初并不认为其具有生物学功能,但随着高通量测序、基因芯片等技术的日渐成熟,越来越多的lncRNA 被证实具有重要功能,尤其在肿瘤中的作用受到重视。研究发现上皮性卵巢癌与正常卵巢组织相比,lncRNA 表达有差异,这种差异与卵巢癌的发生及耐药密切相关[4]。lncRNA SNHG8、lncRNA DSCR8也被证实参与卵巢癌进展[5-6]。lncRNA 可能是卵巢癌治疗的生物标志物和潜在靶点,所以深入研究lncRNA 在卵巢癌细胞中的功能和分子机制十分有必要。为探讨ghrelin 对卵巢癌细胞lncRNA 表达的影响,本研究采用二代测序技术,从添加ghrelin 作用后的人卵巢癌细胞中提取RNA 进行测序,对差异表达lncRNA 进行生物信息学分析,初探这些差异lncRNA 的功能及参与的信号通路,为卵巢癌的诊疗提供帮助。
1 材料与方法
1.1 细胞和主要试剂
人卵巢癌细胞株SK-OV-3 购自武汉普诺赛公司;ghrelin 购自美国Sigma 公司;总RNA 提取试剂盒购自天根生化科技(北京)有限公司;Trizol 试剂盒购自日本TaKaRa 公司;氯仿购自北京鼎国生物技术公司。
1.2 细胞培养和分组
人卵巢癌细胞株SK-OV-3 采用含10% FBS 和1%青霉素/链霉素的DMEM 高糖培养基,于37℃、含5%二氧化碳培养箱中培养。分为对照组和实验组。对照组:无处理的SK-OV-3细胞;实验组:600 ng/mL ghrelin 作用24 h 的SK-OV-3 细胞。
1.3 lncRNA测序生物信息分析
1.3.1 生物信息分析流程lncRNA 测序生物信息分析流程见图1。
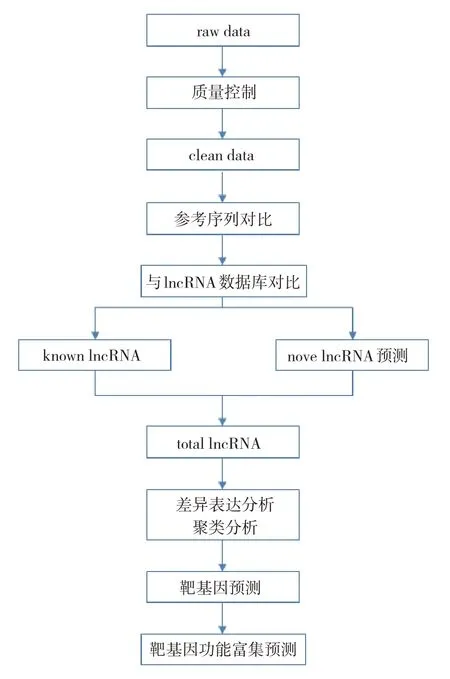
图1 lncRNA测序生物信息分析流程
1.3.2 lncRNA 差异表达分析采用DESeq 对lncRNA 表达进行差异分析,筛选差异表达lncRNA的条件:表达差异倍数|log2Fold Change|>1,P<0.05。采用R 语言ggplots 2 软件包绘制差异表达lncRNA 火山图。
1.3.3 聚类分析使用R 语言Pheatmap 软件包对所有差异基因的并集和样品进行双向聚类分析,根据同一lncRNA 在不同样品中的表达水平和同一样品中不同lncRNA 的表达模式进行聚类。
1.3.4 靶基因预测根据差异表达lncRNA 的顺式和反式靶基因预测结果,使用Igraph 包绘制lncRNA与靶基因互作关系网络图。
1.3.5 差异表达lncRNA 靶基因GO 和KEGG 通路富集分析利用GO term 注释的差异lncRNA 靶基因对每个term 的lncRNA 靶基因列表,并计算lncRNA靶基因数目,然后通过超几何分布方法计算P值(显著富集标准为P<0.05),找出与整个基因组背景相比,差异lncRNA 靶基因显著富集的GO term,从而确定差异lncRNA 靶基因的主要生物学功能及参与的生物过程。通过KEGG 数据库对差异表达lncRNA 靶基因进行KEGG 通路富集分析,预测这些差异lncRNA 参与的信号通路。
2 结果
2.1 ghrelin 对卵巢癌细胞lncRNA 及mRNA 表达的影响
与对照组比较,实验组发生差异表达的lncRNA 有236 个(上调130 个,下调106 个)。发生差异表达mRNA 有71 个(上调66 个,下调5 个)。火山图展示的是lncRNA 分布情况、lncRNA 的表达倍数差异及显著性结果。图中红点表示差异上调的lncRNA,蓝点表示差异下调的lncRNA,灰点表示无差异表达lncRNA。见图2。
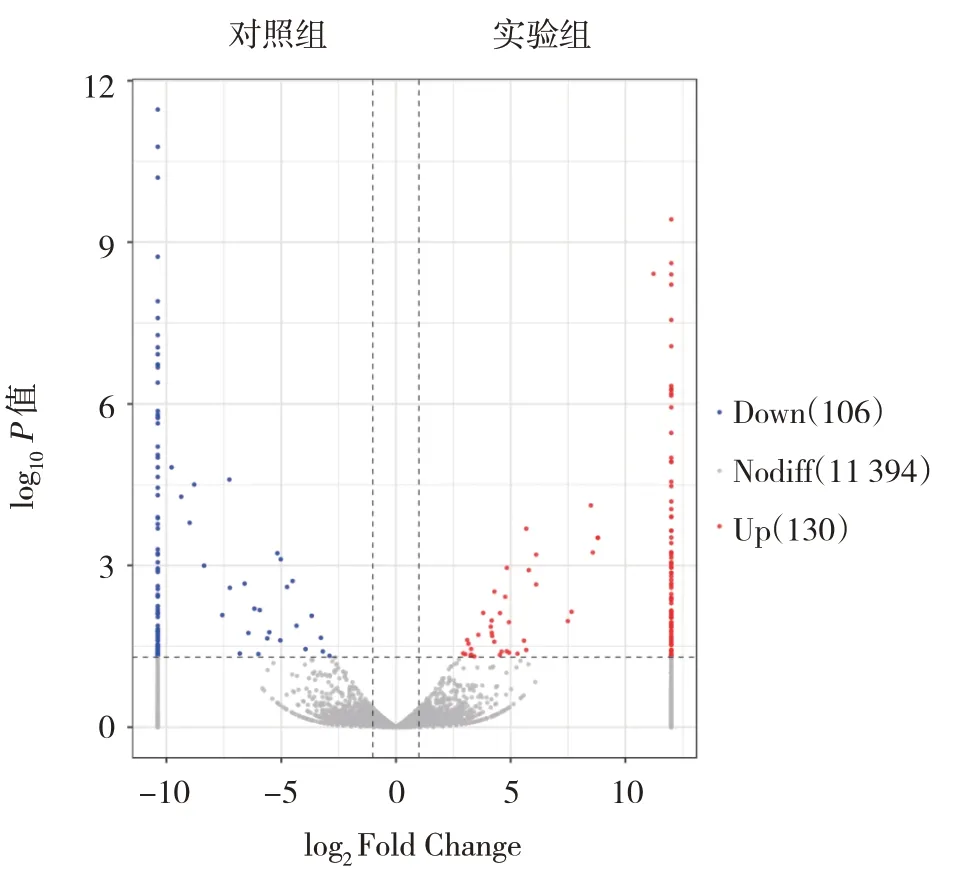
图2 差异表达lncRNA火山图
2.2 差异表达lncRNA聚类分析
聚类分析结果见图3。图中横向表示lncRNA,每一列为一个样本,红色代表高表达lncRNA,绿色代表低表达lncRNA。图中左侧的线图表示各个基因在所有样品中表达规律的相似性,在聚类中分支越近的基因,其表达量的变化规律就越接近,同一聚类模式的基因可能具有相同或相关的功能。
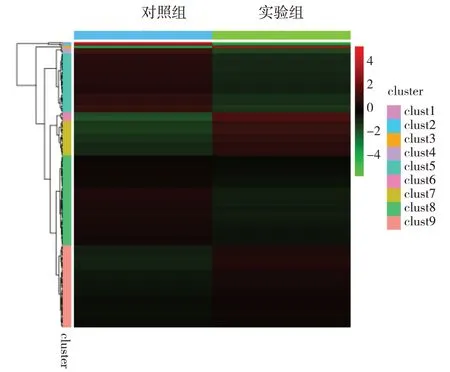
图3 差异表达lncRNA聚类
2.3 差异表达lncRNA与mRNA靶向关系
差异表达lncRNA 与mRNA 靶向关系见图4。图中用蓝色表示差异下调lncRNA,紫色表示差异上调lncRNA,红色表示差异上调的mRNA,绿色表示差异下调的mRNA,连线代表靶向关系。多个lncRNA 可同时与一个mRNA 具有靶向关系,共同调节靶基因的变化。

图4 差异表达lncRNA与mRNA靶向关系网络图
2.4 差异表达lncRNA 靶基因与差异mRNA 交集分析
通过对差异表达lncRNA 预测到的靶基因与差异mRNA 取交集,得到57 个基因(上调54 个,下调3 个),统计结果见图5。图中红色表示差异上调基因,绿色表示差异下调基因。
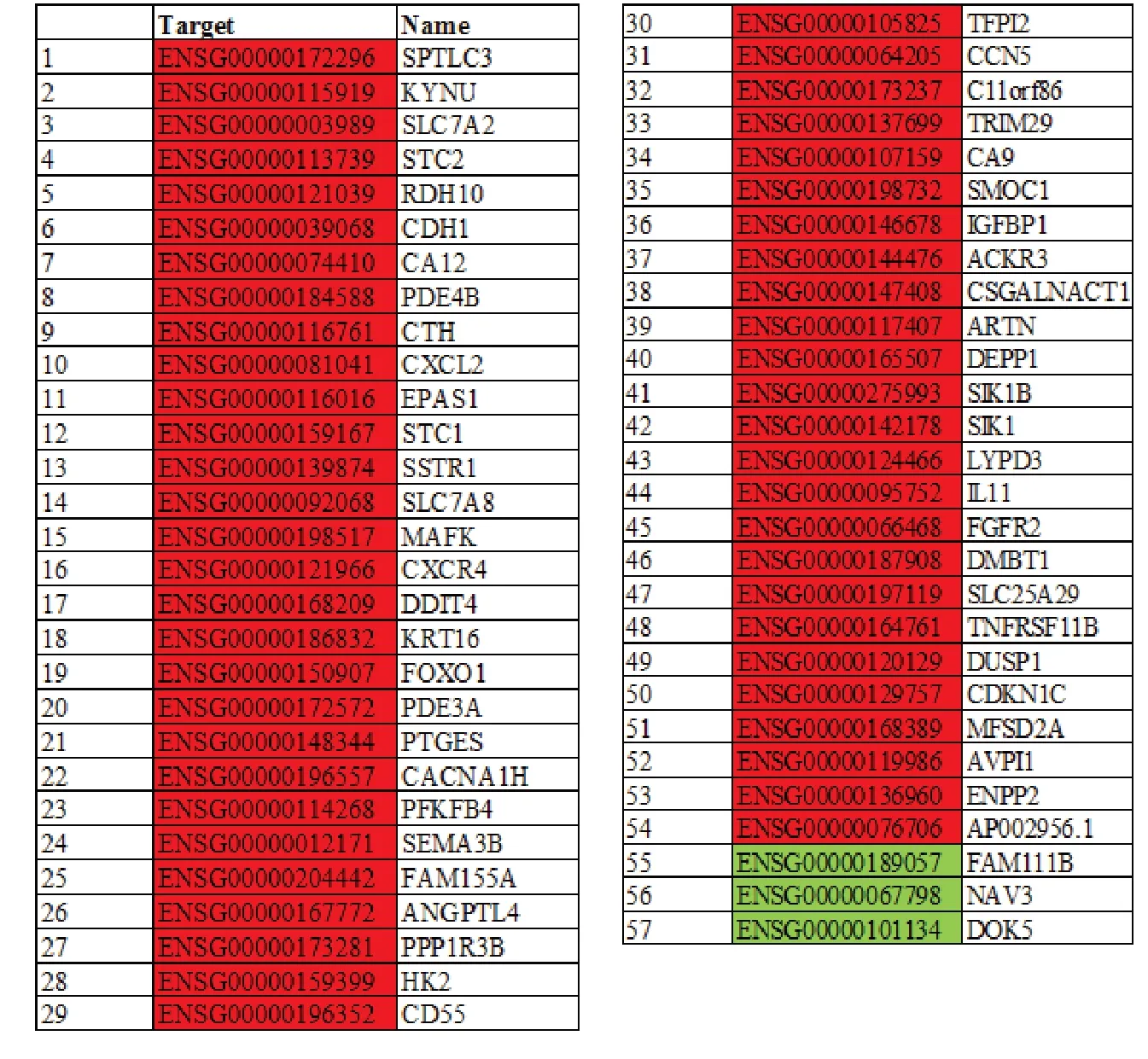
图5 交集分析结果统计
2.5 差异表达lncRNA靶基因富集分析
2.5.1 GO 富集分析对取交集后靶基因进行GO富集分析,按照分子功能(MF)、生物过程(BP)和细胞组分(CC)进行GO 分类,挑选每个GO 分类中P值最小即富集最显著的前10 个GO term 条目进行展示,结果见图6。图中橙色柱状图表示富集最显著的前10 个细胞组分,绿色柱状图表示富集最显著的前10 个分子功能,蓝色柱状图表示富集最显著的前10 个生物过程。
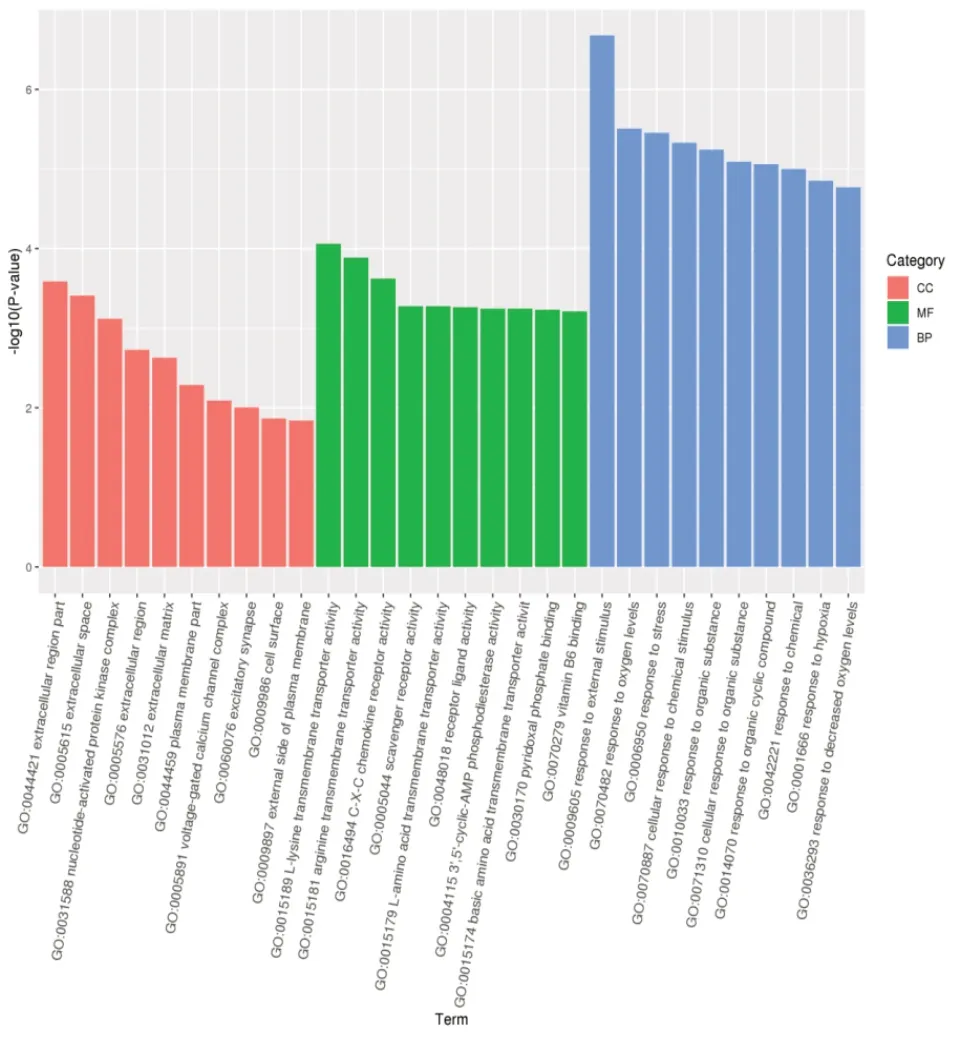
图6 GO富集分析柱状图
根据GO 富集分析结果,通过Rich factor、FDR值及富集到此GO term 上的lncRNA 靶基因个数来衡量富集的程度。挑选FDR 值最小的即富集最显著的前20 个GO term 条目进行展示,结果见图7。图中横坐标Rich factor 指该GO term 中富集到的差异lncRNA 靶基因个数与注释到的差异lncRNA 靶基因个数的比值。Rich factor 越大,表示富集的程度越大。纵坐标表示最显著的前20 个GO term 条目。FDR 取值范围为0~1,越接近于零,表示富集越显著。
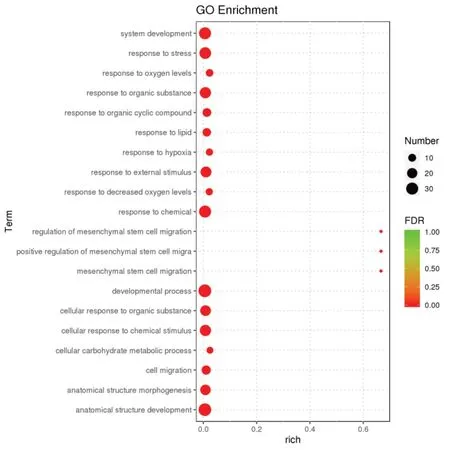
图7 lncRNA靶基因GO富集分析气泡图
以上GO 富集分析结果显示,这些差异表达lncRNA 的主要与精、赖氨酸跨膜转运,氧化应激反应及发育过程相关。
3.5.2 KEGG 通路富集分析根据差异表达的lncRNA 靶基因的KEGG 通路富集分析结果,挑选P值最小即富集最显著的前20 个通路进行展示,结果见图8。由图可知,这些通路主要涉及4 个方面,分别为Environmental Information Processing(橙色),Human Diseases (绿色),Metabolism (蓝色),Organismal Systerms(紫色)。
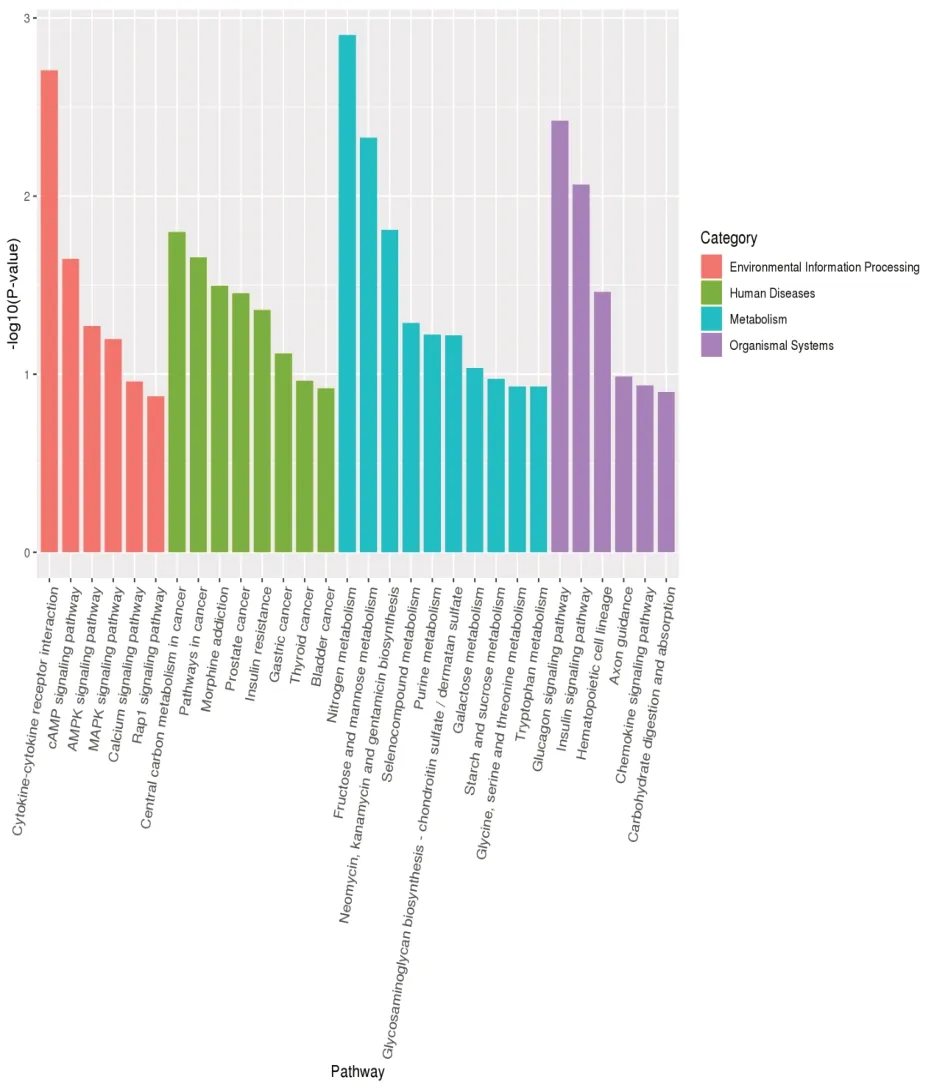
图8 lncRNA靶基因KEGG通路富集分析柱状图
根据KEGG 通路富集分析结果,通过Rich factor、FDR 值和富集到此通路上的lncRNA 靶基因个数来衡量富集的程度。挑选FDR 值最小的即富集最显著的前20 条KEGG 通路进行展示,结果见图9。图中横坐标表示Rich factor,纵坐标表示富集最显著的前20 条通路。气泡大小表示富集到此通路上的lncRNA 靶基因的个数。
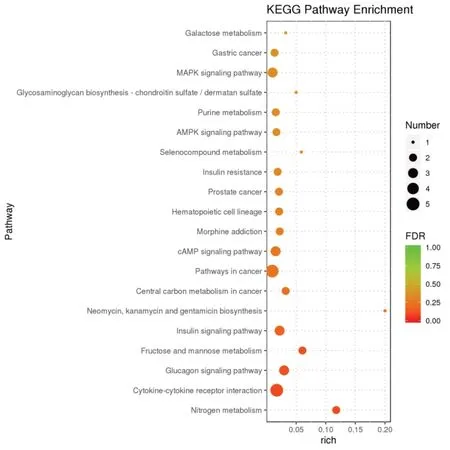
图9 lncRNA靶基因KEGG通路富集分析气泡图
以上KEGG 富集分析结果显示:这些差异表达lncRNA 主要富集在细胞因子受体信号通路、胰高血糖素和胰岛素信号通路及癌症相关信号通路上。
3 讨论
卵巢癌始于卵巢,因其病死率高,卵巢肿瘤在妇科恶性肿瘤中是最致命的。据估计,只有30.6%的女性能存活5年。目前卵巢癌治疗方式仍然是手术加放化疗,但分子靶向治疗的出现为卵巢癌的治疗提供了新的可能,卵巢癌的生物标志物之一CA125 被广泛用于诊断卵巢癌[7],然而卵巢癌的治疗靶点十分有限,随着基因组学、蛋白质组学及代谢组学技术的不断发展,有望能够发现更多的卵巢癌生物标志物与治疗靶点。
ghrelin 中文名为胃饥饿素或生长激素释放肽,是由28 个氨基酸构成的多肽,主要由胃产生,胃切除后胰腺是其主要来源[8]。ghrelin 在体内可发挥多种生物学功能,如促进生长激素的分泌、调节摄食和能量代谢等,并且参与调控消化道恶性肿瘤、食管癌、胃癌、乳腺癌、卵巢癌等多种肿瘤发生、发展[9-11]。研究发现ghrelin 可抑制卵巢癌细胞增殖,且可能通过miR-1 和Bcl-2 以及抑制mTOR 和经典Wnt 信号通路调控该过程[3,12]。但ghrelin 对卵巢癌细胞lncRNA 表达的影响报道较少。
基因组学研究发现[13]人类基因中只有不到2%具有编码蛋白质的潜力,而其余大部分均被转录为ncRNA,包括微小RNA(microRNA,miRNA)、lncRNA 以及环状RNA(circular RNA,circRNA)。由于没有编码蛋白的功能,让学者们一度认为ncRNA是可有可无的存在,甚至是转录过程当中的“噪音”。但随着研究的深入学者们发现ncRNA 并不是一无是处,功能性ncRNA 参与调节多种生命过程,尤其近年来高通量测序、基因芯片等技术日渐成熟,让学者掀开ncRNA 的神秘面纱。本研究以lncRNA 作为关注对象,lncRNA 是一类长度超过200 bp 并具有更高组织器官特异性的ncRNA[14]。lncRNA 在多种生命活动中均可发挥重要生物学功能,尤其在肿瘤领域占有至关重要的位置,研究发现lncRNA 可参与调节肿瘤细胞增殖、自噬、迁移以及凋亡等多种过程[15-17],lncRNA 已被确定为癌症发展过程中的关键调控分子。在卵巢癌的发生发展过程中已有多种lncRNA 被证实发生差异表达并发挥重要作用,如lncRNA TP73-AS1 在卵巢癌组织和卵巢癌细胞中上调,而TP73-AS1 上调与预后不良有关。敲低TP73-AS1 可显著抑制SK-OV-3 细胞的增殖、侵袭及迁移,而且,敲低TP73-AS1 抑制体内肿瘤的生长[18]。lncRNA EIBC 在卵巢癌组织中高表达,lncRNA EBIC 的过度表达可通过Wnt/β-catenin 信号通路促进卵巢癌的增殖、侵袭及迁移,并提高细胞对顺铂的耐药性[19]。LINC 00152 在卵巢癌组织和细胞系中上调,敲除LINC 00152 可抑制细胞增殖,诱导细胞凋亡,从而抑制肿瘤生长[20]。lncRNA MALAT1 可能使miR-211 成为竞争性内源RNA,并可能上调PHF19 表达,从而促进卵巢癌发展[21]。此外,lncRNA MALAT1 也可以负性靶向miR-503-5p 表达,通过JAK2-STAT3 途径进一步促进卵巢癌细胞增殖并抑制其凋亡[22]。lncRNA 有望成为新的卵巢癌生物标志物与治疗靶标。
本研究采用第二代测序技术,基于illumina HiSeq 测序平台,从ghrelin 作用的人卵巢癌细胞及对照组中提取RNA 进行测序。根据测序结果筛选实验组人卵巢癌细胞中差异表达lncRNA 及mRNA,对差异表达lncRNA 进行靶基因预测,将预测到的靶基因与差异mRNA 做交集分析,并对取交集后得到的基因进行GO 富集分析、KEGG 信号通路富集分析,初步探讨这些差异表达lncRNA 在卵巢癌中的主要功能及参与的信号通路,为卵巢癌的诊疗提供潜在靶点。
