白藜芦醇对银屑病细胞生长的影响及其作用机制的探讨*
2022-05-20韩乌日罕郭果香丽丽闫静茹张婷郝玉琴
韩乌日罕,郭果香,丽丽,闫静茹,张婷,郝玉琴
(1.包头市第四医院皮肤科,内蒙古包头 014000;2.内蒙古医科大学第三附属医院皮肤科,内蒙古包头 014000;3.北京大学第三医院皮肤科,北京 100191)
银屑病是被世界卫生组织确定为主要的全球健康问题的少数非传染性疾病之一[1],是一种常见的免疫介导的以角质形成细胞过度增殖和异常分化及炎症细胞浸润为主要特征的慢性炎症性皮肤病,全球发病率为2%~3%[2-3]。其典型临床表现为鳞屑性红斑或斑块,主要累及肘部、膝盖及头皮,亦可广泛分布[1]。银屑病病因复杂,机制不明,并且病程迁延不愈,容易反复,治疗困难,常罹患终身[4]。随着对银屑病的深入研究,发现丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路在银屑病角质形成细胞的增殖过程和炎症反应中均发挥一定的作用[5-7]。
白藜芦醇是一种多酚类化合物,存在于多种植物中,具有抗癌、抗菌、抗炎、抗氧化等多种生物学活性[8-10]。其中抗炎和抗肿瘤作用可通过调控P38/MAPK 通路或细胞外信号调节激酶(extracellular regulated protein kinases, ERK)/MAPK 通路发挥作用[11-12]。有研究[13-14]发现白藜芦醇可以降低银屑病皮损的炎症程度,还可导致人永生化角质形成细胞(HaCaT)的凋亡。虽然白藜芦醇可通过调控MAPK通路抑制细胞异常增殖和炎症反应,并且对银屑病也有抑制作用,但白藜芦醇是否可通过调控MAPK通路起到抗银屑病的作用尚未见相关报道。
很多研究[15-17]都采用HaCaT 细胞株作为银屑病的研究模型。本研究采用角质细胞生长因子(keratinocyte growth factor, KGF)刺激HaCaT 细胞过度增殖,模拟银屑病角质形成细胞的过度增殖状态,复制银屑病细胞模型,分别观察不同浓度的白藜芦醇对HaCaT 细胞株增殖及凋亡的影响,检测Caspase-3、p-ERK1/2、p-P38 蛋白表达,探讨白藜芦醇对银屑病细胞生长的影响及其作用机制,为白藜芦醇临床治疗银屑病提供理论和实验基础。
1 材料与方法
1.1 细胞、试剂与仪器
HaCaT 细胞株(湖南丰晖生物科技有限公司)。KGF(MCE 中国公司),白藜芦醇、顺式视黄酸(维A 酸)、二甲基亚砜DMSO(美国Sigma 公司),DMEM 培养基、胎牛血清[赛默飞世尔科技(中国)有限公司],胰酶、抗生素(美国GenView 公司),MTT(上海生物工程有限公司),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(美国BioLegend 公司),生理盐水(湖南科伦有限公司),Caspase-3 抗体(武汉三鹰生物技术有限公司);p-ERK1/2 抗体(武汉Abclonal 公司) ,p-P38 抗体(美国Cell Signaling Technology 公司),RIPA 裂解液(强)、BCA蛋白定量试剂盒、ECL 化学发光试剂盒(广州碧云天生物技术有限公司),彩色预染蛋白分子量标准(10~170 kD)[赛默飞世尔科技(中国)有限公司],PVDF 膜(美国Merck Millipore 公司)。二氧化碳恒温培养箱、台式高速大容量冷冻离心机[赛默飞世尔科技(中国)有限公司],倒置显微镜[奥林巴斯(中国)有限公司],离心机(湖南平凡科技有限公司),超净工作台(华宇净化设备有限公司),酶标仪(北京德泉兴业商贸有限公司),流式细胞仪[贝克曼库尔特商贸(中国)有限公司],电泳仪电源、双垂直电泳仪、转印电泳仪(槽)(北京六一生物科技有限公司),水平脱色摇床(海门市其林贝尔仪器制造有限公司),化学发光仪(上海勤翔科学仪器有限公司)。
1.2 HaCaT细胞培养及银屑病模型复制
HaCaT 细胞贴壁培养于含10% 胎牛血清的DMEM 培养基中,置于37℃、饱和湿度、5% CO2培养箱内培养,每1~2 天换液1 次,细胞单层贴壁生长,待长满瓶底时,用0.25%胰蛋白酶消化液消化成单个细胞,取对数生长期的细胞准备实验。
取对数生长期、生长状态良好的HaCaT 细胞,以10×104个/孔细胞接种到6 孔板中,每孔体积2 500 μL。第2 天,将6 孔板中细胞培养基更换为含有不同浓度KGF (0 ng/mL、5 ng/mL、10 ng/mL、20 ng/mL、40 ng/mL)的培养基继续培养。在诱导第3 天时为每组细胞换液,继续添加相应浓度的KGF。用显微镜观察加药后0 h、12 h、1 d、2 d、3 d、4 d、5 d、6 d、7 d 的HaCaT 细胞形态及增殖情况,并拍照。
1.3 MTT 法检测不同浓度KGF 组HaCaT 细胞的增殖
取对数生长期、生长状态良好的HaCaT 细胞,以7 000 个/孔细胞接种到96 孔板,每孔体积100 μL。第2 天,将细胞分成5 组,每组3 个复孔,更换含有0 ng/mL、5 ng/mL、10 ng/mL、20 ng/mL、40 ng/mL 浓度KGF 的培养基,继续培养12 h、24 h、48 h。每孔加20 μL MTT 溶液(5 mg/mL),在37℃、5%二氧化碳培养箱中培养4 h,小心吸弃孔内上清液,每孔加150 μL DMSO,振荡10 min,测定并记录酶联免疫检测仪490 nm 波长处各孔的光密度(OD)值,以时间为横坐标,OD 值为纵坐标绘制细胞生长曲线。
1.4 MTT 法检测不同浓度白藜芦醇组HaCaT 细胞的增殖
取对数生长期,生长状态良好的HaCaT 细胞,以8 000个/孔细胞接种到96孔板中,每孔体积100 μL。第2 天,将细胞分成5 组,每组3 个复孔,更换含有0 μmol/L、0.5 μmol/L、1.0 μmol/L、2.0 μmol/L、4.0 μmol/L浓度白藜芦醇的培养基,继续培养24 h,每孔加20 μL MTT 溶液(5 mg/mL),在37℃、5%二氧化碳培养箱中培养4 h,小心吸弃孔内上清液,每孔加150 μL DMSO,振荡10 min,测定并记录酶联免疫检测仪490 nm 波长处各孔的OD 值,计算细胞存活率及半抑制浓度(IC50)。细胞存活率=(实验组OD值/空白对照组OD 值)×100%。
1.5 MTT法检测各组银屑病模型细胞的增殖
取对数生长期、生长状态良好的HaCaT 细胞,以8 000个/孔细胞接种到96孔板中,每孔体积100 μL。第2 天,以40 ng/mL KGF 处理细胞24 h。第3 天,弃原培养基,将细胞分成阴性对照组(30 μg/L 生理盐水),2.5 μmol/L、5.0 μmol/L、7.5 μmol/L 白藜芦醇组,阳性对照组(5.0 μg/mL 维A 酸)及空白对照组(未加任何药物)6 组,每组3 个复孔,更换相应培养基,继续培养24 h、48 h、72 h,每孔加20 μL MTT 溶液(5 mg/mL),在37℃、5%二氧化碳培养箱中培养4 h,小心吸弃孔内上清液,每孔加150 μL DMSO,振荡10 min,测定并记录酶联免疫检测仪490 nm 波长处各孔的OD 值。以时间为横坐标,OD值为纵坐标绘制细胞生长曲线。
1.6 流式细胞术检测各组银屑病模型细胞的凋亡
取对数生长期、生长状态良好的HaCaT 细胞,以2.5×105个/孔细胞接种到6 孔板中,每孔体积2 500 μL。第2天,以40 ng/mL的KGF处理细胞24 h。第3 天,弃原培养基,将细胞分成阴性对照组(30 μg/L生理盐水),2.5 μmol/L、5.0 μmol/L、7.5μmol/L 白藜芦醇组,阳性对照组(5 μg/mL 维A 酸)及空白对照组(未加任何药物)6 组,每组3 个复孔,更换相应培养基,继续培养72 h。1 500 r/min 离心5 min 后收集各组细胞,用4℃预冷PBS 洗涤2 次,调节浓度为1×107/mL,用500 μL 结合1 mL PBS 缓冲液重悬细胞,取100 μL 细胞悬浮于5 mL 流式管中,加入5 μL Annexin V-FITC 混匀后,加入5 μL Propidium Iodide 混匀,于室温下避光孵育15 min。采用流式细胞术检测各组细胞的凋亡。
1.7 Western blotting 检测各组银屑病模型细胞p-ERK1/2、p-P38、Caspase-3蛋白的相对表达量
取对数生长期、生长状态良好的HaCaT 细胞,以2.5×105个/孔细胞接种到6 孔板中,每孔体积2 500 μL。第2 天,以40 ng/mL 的KGF 处理细胞24 h。第3 天,弃原培养基,将细胞分成阴性对照组(30 μg/L生理盐水),2.5 μmol/L、5.0 μmol/L、7.5 μmol/L 白藜芦醇组,阳性对照组(5 μg/mL 维A 酸)及空白对照组(未加任何药物)6 组,每组3 个复孔,更换相应培养基,继续培养72 h。用细胞裂解液抽提各组细胞总蛋白,按BCA 试剂盒说明书操作步骤测定总蛋白含量后分装,置入-80℃冰箱冷冻待用。分别取50 μg 各组蛋白,煮沸10 min 变性后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电泳结束后,通过电转移法将蛋白质从SDS-PAGE 凝胶转移至硝酸纤维素膜。硝酸纤维素膜在含5%BSA-PBST 中室温轻摇60 min,分别加入Caspase-3(1∶1 000 稀释)、p-ERK1/2(1∶500 稀释)、p-P38(1∶500 稀释)抗体,4℃孵育过夜,次日取出PVDF 膜,PBST 充分漂洗(6 min×5 次),加入1∶5 000 稀释的过氧化物酶标记的抗兔IgG,室温孵育60 min,PBST 充分漂洗(6 min×5 次)后,化学荧光法显色,利用Image J 灰度分析软件做半定量分析测定Caspase-3、p-ERK1/2、p-P38 蛋白的相对表达量。GAPDH 为内参。
1.8 统计学方法
数据分析采用Graphad 软件及SPSS 22.0 统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,两两比较用Tukey′s 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 KGF对HaCaT细胞生长的影响
倒置显微镜观察结果显示,12 h、1 d、2 d,KGF各浓度组分别与0 ng/mL 组比较,细胞增殖明显,细胞数量增多,密度增大,细胞呈圆形、长梭形,较密集分布(见图1)。3 d、4 d、5 d、6 d、7 d,KGF 各浓度组分别与0 ng/mL 组比较,细胞增殖不明显,细胞数量增多不显著,密度小,呈较分散分布。

图1 不同浓度KGF组HaCaT细胞的增殖情况 (倒置显微镜×100倍)
2.2 不同KGF浓度组HaCaT细胞的OD值比较
不同KGF 浓度组HaCaT 细胞0 h、12 h、24 h、48 h的OD 值比较,采用重复测量设计的方差分析,结果:①不同时间点的OD 值有差异(F=4 733.148,P=0.000);②不同KGF浓度组的OD 值有差异(F=64.967,P=0.000),40 ng/mL KGF 组的OD 值高于其他浓度组(P<0.05);③不同KGF 浓度组OD 值的变化趋势有差异(P=44.627,P=0.000),40 ng/mL KGF 组的OD 值从24 h 开始明显高于其他浓度组(P<0.05)(见表1和图2)。以上结果表明,浓度为40 ng/mL 的KGF 从24 h 开始对HaCaT 细胞有明显的增殖促进作用。本研究采用40 ng/mL KGF 处理HaCaT 细胞24 h 复制银屑病模型。
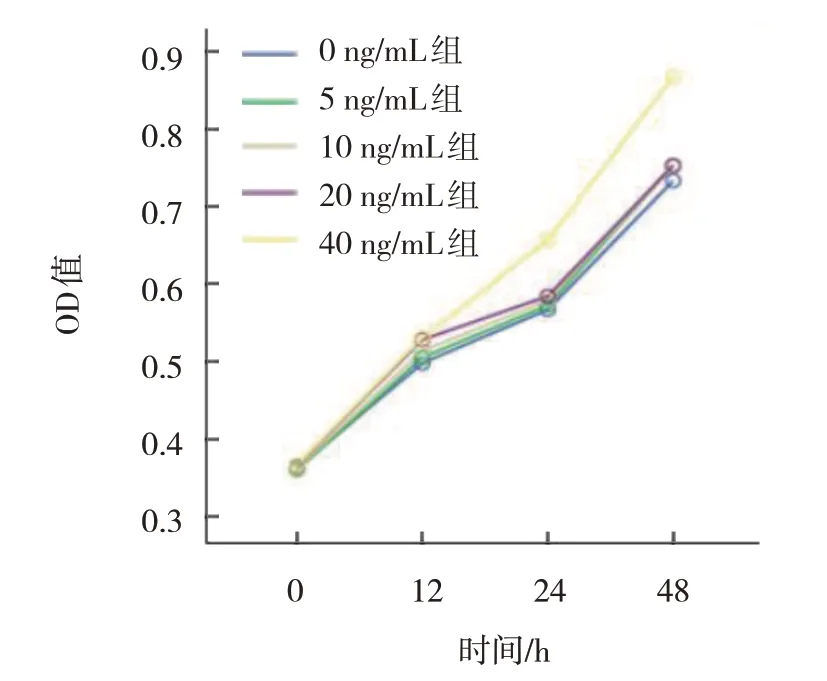
图2 不同KGF浓度组HaCaT细胞0 h、12 h、24 h和48 h的细胞生长曲线
表1 不同KGF浓度组HaCaT细胞0 h、12 h、24 h、48 h的OD值比较 (±s)

表1 不同KGF浓度组HaCaT细胞0 h、12 h、24 h、48 h的OD值比较 (±s)
组别0 ng/mL KGF组5 ng/mL KGF组10 ng/mL KGF组20 ng/mL KGF组40 ng/mL KGF组0 h 0.363±0.011 0.361±0.009 0.362±0.009 0.366±0.011 0.367±0.005 12 h 0.498±0.016 0.505±0.014 0.514±0.012 0.529±0.007 0.530±0.03 24 h 0.567±0.008 0.573±0.012 0.579±0.007 0.584±0.011 0.657±0.018 48 h 0.733±0.011 0.753±0.009 0.754±0.002 0.753±0.008 0.867±0.019
2.3 白藜芦醇对HaCaT细胞增殖能力的影响
MTT 法检测结果显示,0 μmol/L、0.5 μmol/L、1.0 μmol/L、2.0 μmol/L、4.0 μmol/L 白藜芦醇作用HaCaT 细胞24 h 后的OD 值分别为(0.82±0.007)、(0.72±0.027)、(0.64±0.002)、(0.61±0.006)及(0.52±0.010),各组比较,差异有统计学意义(F=1 009.343,P=0.000),白藜芦醇浓度升高OD 值降低;进一步两两比较,各组间差异均有统计学意义(P<0.05)。0 μmol/L、0.5 μmol/L、1.0 μmol/L、2.0 μmol/L、4.0 μmol/L 白藜芦醇作用HaCaT 细胞24 h 后的细胞存活率分别为(100±0.000)%、(87±0.015)%、(79±0.006)%、(74±0.011)%、(63±0.016)%,见图3。白藜芦醇的IC50 为5.3 μmol/L,故下一步实验的白藜芦醇低浓度为2.5 μmol/L、中浓度为5.0 μmol/L、高浓度为7.5 μmol/L。
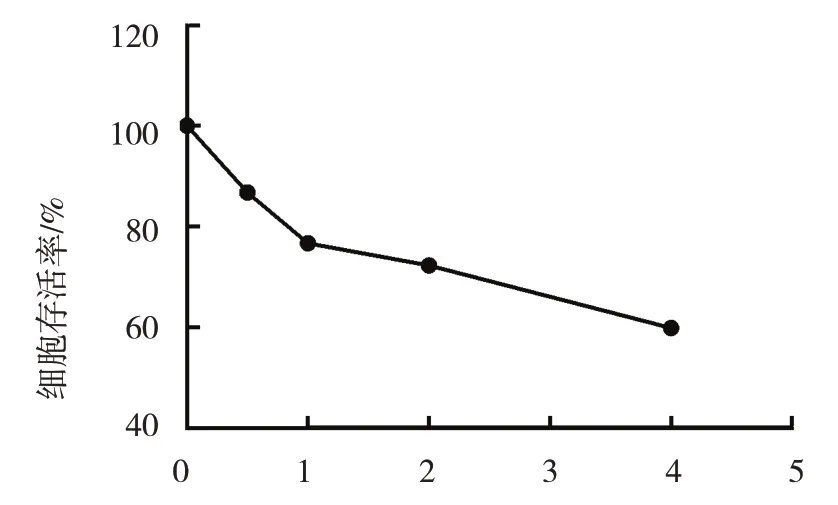
图3 不同浓度白藜芦醇作用HaCaT细胞24 h后的细胞存活率
2.4 白藜芦醇对银屑病模型细胞增殖能力的影响
空白对照组、阴性对照组、2.5 μmol/L 白藜芦醇组、5.0 μmol/L 白藜芦醇组、7.5 μmol/L 白藜芦醇组、阳性对照组银屑病模型细胞24 h、48 h、72 h 的OD值比较,采用重复测量设计的方差分析,结果:①不同时间点的OD 值有差异(F=690.102,P=0.000);②各组的OD 值有差异(F=58.750,P=0.000);③各
2.5 白藜芦醇对银屑病模型细胞凋亡的影响
空白对照组、阴性对照组、2.5 μmol/L 白藜芦醇组、5.0 μmol/L 白藜芦醇组、7.5 μmol/L 白藜芦醇组、阳性对照组银屑病模型细胞的凋亡率分别为(4.16±1.47)% 、(5.12±1.53)% 、(10.58±1.34)% 、组OD 值的变化趋势有差异(F=8.474,P=0.000);进一步两两比较,5.0 μmol/L 白藜芦醇组、7.5 μmol/L 白藜芦醇组和阳性对照组48 h 和72 h 的OD值低于阴性对照组(P<0.05)。见表2和图4。(20.17±1.99)%、(29.43±1.10)%、(30.65±1.96)%,各组比较,差异有统计学意义(F=109.200,P=0.000),进一步两两比较,5.0 μmol/L 白藜芦醇组、7.5 μmol/L 白藜芦醇组和阳性对照组细胞凋亡率高于阴性对照组(P<0.05)。见图5。
表2 各组银屑病模型细胞24 h、48 h和72 h的OD值比较 (±s)
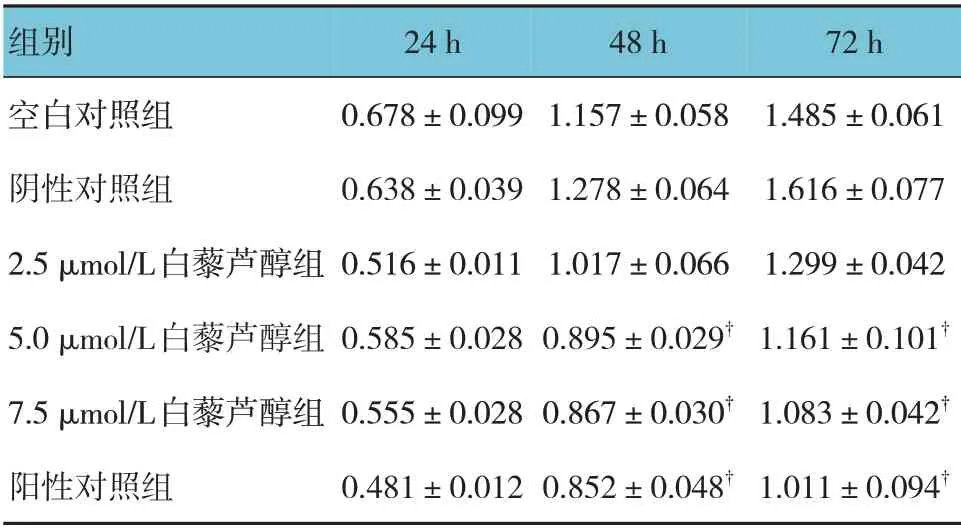
表2 各组银屑病模型细胞24 h、48 h和72 h的OD值比较 (±s)
注:†与阴性对照组比较,P <0.05。
组别空白对照组阴性对照组2.5 μmol/L白藜芦醇组5.0 μmol/L白藜芦醇组7.5 μmol/L白藜芦醇组阳性对照组72 h 1.485±0.061 1.616±0.077 1.299±0.042 1.161±0.101†1.083±0.042†1.011±0.094†24 h 0.678±0.099 0.638±0.039 0.516±0.011 0.585±0.028 0.555±0.028 0.481±0.012 48 h 1.157±0.058 1.278±0.064 1.017±0.066 0.895±0.029†0.867±0.030†0.852±0.048†

图4 各组银屑病模型细胞24 h、48 h和72 h的生长曲线
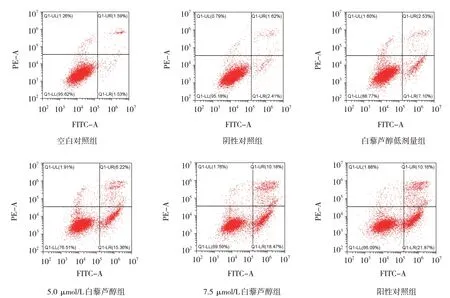
图5 各组银屑病模型细胞凋亡的流式细胞图
2.6 各组银屑病模型细胞p-ERK1/2、p-P38、Caspase-3蛋白相对表达量的比较
空白对照组、阴性对照组、2.5 μmol/L 白藜芦醇组、5.0 μmol/L 白藜芦醇组、7.5 μmol/L 白藜芦醇组、阳性对照组银屑病模型细胞Caspase-3、p-ERK1/2、p-P38 蛋白相对表达量的比较,采用单因素方差分析,差异有统计学意义(P<0.05);进一步两两比较,5.0 μmol/L 白藜芦醇组、7.5 μmol/L 白藜芦醇组、阳性对照组与阴性对照组和空白对照组比较,Caspase-3蛋白相对表达量升高(P<0.05),p-ERK1/2、p-P38 蛋白相对表达量降低(P<0.05)。见图6和表3。
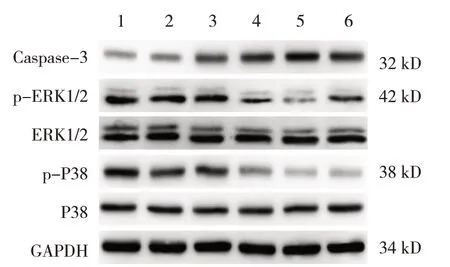
图6 各组银屑病模型细胞Caspase-3、p-ERK1/2、p-P38蛋白表达
表3 各组银屑病模型细胞Caspase-3、p-ERK1/2、p-P38蛋白相对表达量的比较 (±s)
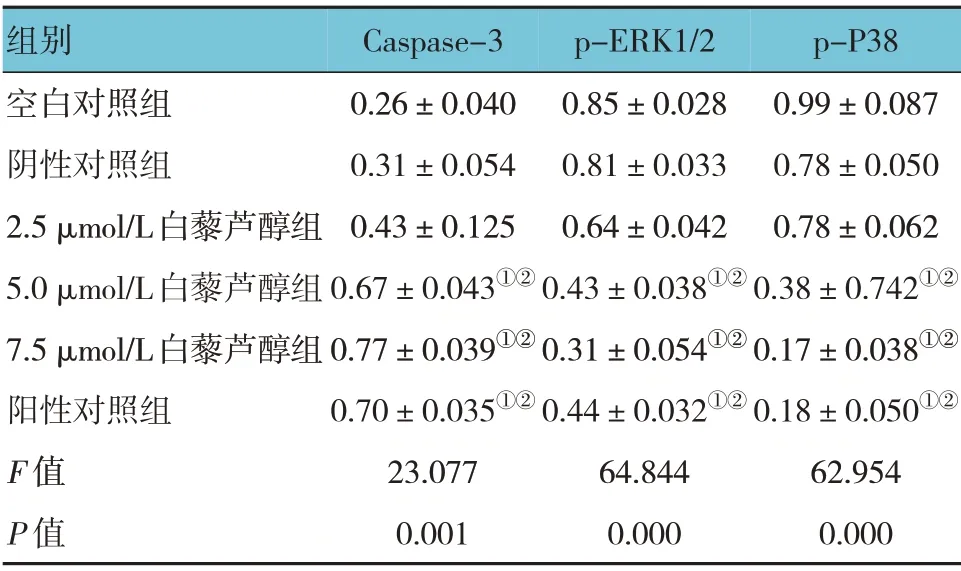
表3 各组银屑病模型细胞Caspase-3、p-ERK1/2、p-P38蛋白相对表达量的比较 (±s)
注:①与阴性对照组比较,P <0.05;②与空白对照组比较,P <0.05。
p-P38 0.99±0.087 0.78±0.050 0.78±0.062 0.38±0.742①②0.17±0.038①②0.18±0.050①②62.954 0.000组别空白对照组阴性对照组2.5 μmol/L白藜芦醇组5.0 μmol/L白藜芦醇组7.5 μmol/L白藜芦醇组阳性对照组F 值P 值Caspase-3 0.26±0.040 0.31±0.054 0.43±0.125 0.67±0.043①②0.77±0.039①②0.70±0.035①②23.077 0.001 p-ERK1/2 0.85±0.028 0.81±0.033 0.64±0.042 0.43±0.038①②0.31±0.054①②0.44±0.032①②64.844 0.000
3 讨论
MAPK 家族有4 个亚家族,包括ERK、c-Jun 氨基末端激酶(JNK)、P38 和ERK5,参与细胞的增殖、分化、基因表达和细胞凋亡过程[18-19]。其中ERK1/2 和P38 在细胞增殖或炎症因子的表达中发挥作用。ERK1/2 的磷酸化会导致细胞周期蛋白D1 的转录激活,周期蛋白依赖性激酶(CDK)抑制剂P27 的降解以及P90 核糖体S6 激酶(P90RSK)的激活,并通过靶向基因表达来促进细胞增殖、存活和转移[20]。P38的激活可降低肿瘤抑制因子microRNA-200b 的表达,促进乳腺癌癌细胞的异常增殖[21]。可见,MAPK信号通路的激活参与了肿瘤细胞的异常增殖。
白藜芦醇能够抑制癌细胞的增殖,并诱导各种类型癌细胞的细胞周期停滞和凋亡[22]。研究表明,白藜芦醇的抗肿瘤活性可通过调控P38/MAPK 或ERK/MAPK 发挥作用。在胰腺癌[23]、结肠癌[24]、肺癌[25]中,白藜芦醇可抑制P38/MAPK 或ERK/MAPK 通路抑制肿瘤细胞。在抗炎方面,有研究[26]发现,白藜芦醇可通过抑制MAPK 信号通路中P38 和ERK 的磷酸化使促炎细胞因子——肿瘤坏死因子-α(TNFα)和白细胞介素-1(IL-1)等的表达降低,从而抑制炎症反应。MAPK 通路是白藜芦醇发挥其生物学活性重要的信号传导通路。
目前,HaCaT 细胞是体外建立银屑病模型最常用的细胞,具有传代特征稳定,增殖和分化与角质形成细胞相似的特征。KGF 是促角质形成细胞增殖的最强因子,目前,国内多位学者[15-17]都采用HaCaT细胞复制银屑病模型,显微镜下细胞数量增多,密度增大,细胞呈圆形、长梭形,细胞增殖明显,此状态模拟银屑病病理生理改变。本研究首先通过不同浓度的KGF 诱导HaCaT 细胞,选择最佳刺激浓度及最佳刺激时间,即浓度为40 ng/mL 的KGF 刺激24 h 后,HaCaT 细胞增殖明显,模拟银屑病角质形成细胞异常增殖情况,复制银屑病细胞模型。
半抑制浓度或半抑制率,即IC50,是某种药物诱导细胞凋亡50%时的浓度。在进行体外实验设定实验药物浓度时,一般先计算出该药物的IC50值,后根据IC50 值确定给药浓度,即IC50 值分布在浓度点的中间。本研究先用不同浓度的白藜芦醇刺激HaCaT 细胞,计算出的IC50 为5.3 μmol/L,并根据该结果设定下一步实验的白藜芦醇浓度,即低浓度为2.5 μmol/L、中浓度为5.0 μmol/L、高浓度为7.5 μmol/L。然后,分别用2.5 μmol/L、5.0 μmol/L、7.5 μmol/L 的白藜芦醇,以及5.0 μmol/L 维A 酸干预银屑病模型细胞。MTT 法及流式细胞术检测细胞增殖及凋亡,结果显示,白藜芦醇可抑制KGF 的促细胞增殖效应,促进银屑病模型细胞凋亡。Western blotting 结果显示,使用白藜芦醇作用于银屑病模型细胞,其Caspase-3 蛋白表达升高,而p-ERK1/2 和p-P38 蛋白表达降低。由此推测,白藜芦醇可能通过抑制ERK/MAPK 通路和/或P38/MAPK 通路发挥作用,抑制银屑病模型细胞的增殖并促进其凋亡。
综上所述,白藜芦醇可抑制银屑病模型细胞的增殖并促进其凋亡,其可能通过抑制ERK/MAPK 通路和/或P38/MAPK 通路发挥作用,具体作用机制还有待更深入的研究。
