糖尿病鼠骨骼肌萎缩相关环状RNA的研究
2022-05-20杨雷王筠邓芳许特苟德明周威胡章立邹湘辉
杨雷,王筠,邓芳,许特,苟德明,周威,胡章立,邹湘辉
1)深圳大学生命与海洋科学学院,广东深圳 518071;2)韩山师范学院生命科学与食品工程学院,广东潮州 521041
糖尿病是全球性高发,以胰岛素分泌与抵抗紊乱为特征并累及机体多系统、多器官的慢性代谢性疾病.患者经过有效的对症治疗,发病过程可以明显减缓.但是,绝大多数患者最终还是会不可逆地进入糖尿病晚期,出现多种严重的并发症,致使机体多系统的功能衰竭,以致死亡[1].其中,肌萎缩是糖尿病患者较严重的并发症之一.目前已知糖尿病是造成全身肌减少和肌萎缩的危险因素,可加速年龄依赖性肌质量和功能的下降[2].由于患者逐渐加重的微循环障碍,导致肌营养不良、肌细胞萎缩、肌疼痛及残障,给家庭和社会带来巨大的精神和经济负担.由于胰岛素是机体细胞生长和蛋白质合成的有效刺激剂[3],当糖尿病患者胰岛素分泌不足时,机体合成代谢的作用显著降低,直接或间接造成患者的肌肉质量下降[4].对糖尿病患者人群队列的调查结果显示,高血糖与骨骼肌萎缩的发病机制密切相关[5].有证据表明,泛素蛋白酶系统和自噬溶酶体系统是控制肌肉蛋白质功能的两个最重要的细胞蛋白水解系统,它们在调节整体肌肉稳态方面发挥着关键作用[6].糖尿病导致骨骼肌萎缩的分子调控机制可能与这两种系统稳态失衡有关,但其具体作用途径仍需深入探究.
近年来,环状核糖核酸(circular ribonucleic acid,circRNA)在许多人类疾病(如肿瘤[7]、神经疾病[8]、免疫疾病[9]和心血管疾病[10]等)的病变过程中所发挥的重要作用已逐渐被揭示,并得到越来越多的关注.作为非编码RNA 家族的新成员,科学家们发现circRNA 在机体内广泛存在,具有与内源性RNA 竞争和组织特异性等特征,参与很多疾病发生发展的调控作用,且稳定性高.文献[11]报道,circRNA 可作为多种重大疾病的精准诊疗的靶点,而且它们可以预警一些疾病的预后.然而,迄今未见circRNA 参与糖尿病所致骨骼肌萎缩发病机制的报道.本研究拟利用1型糖尿病小鼠模型腓肠肌和生物信息学分析软件,寻找糖尿病肌萎缩病变过程中的新生物标志物——circRNA,并预测与它们相对应的小RNA(mirco RNA,miRNA)及下游靶基因之间的潜在反应轴,以揭示circRNA 在糖尿病肌萎缩过程的可能分子调控机制,为临床诊疗及预后干预提供新视野和新方案.
1 材料与方法
1.1 链脲佐菌素诱导糖尿病小鼠模型的构建
首先,选用大剂量链脲佐菌素(streptozotocin,STZ)杀伤胰岛β 细胞,构建1 型糖尿病小鼠模型.该研究获得实验动物伦理委员会的批准.实验采用7~10 周龄雄性昆明鼠,随机分为正常对照组和STZ 处理组(10 只/组),小鼠自由饮水和摄食.用浓度为0.1 mol/L 的柠檬酸盐缓冲液配制质量浓度为10 mg/mL 的 STZ(美国Sigm-Aldrich)溶液,并过滤除菌.禁食12 h后,称量每只小鼠体质量,然后按体质量计算STZ 剂量,进行腹腔注射.第1 天对处理组每只小鼠按照100 mg/kg 进行腹腔注射STZ,对照组小鼠注射等体积的柠檬酸盐缓冲液.注射第3天后,在固定时间对小鼠进行尾端采血,用血糖仪和试纸(德国Roche)监测血糖水平,当实验鼠血糖水平≥16.7 mmol/L,即认定建模成功.如第1次血糖未超过阈值的,可再次按照50 mg/kg腹腔注射STZ,3天后再次检测2次注射鼠的血糖水平. 本实验中经2 次注射的小鼠,血糖均可超过阈值.然后,每周记录1次小鼠血糖和体质量. 在第38天,计量小鼠24 h的摄食量和饮水量.
1.2 旷场实验
本研究使用旷场实验检测小鼠的运动强度,检测体系(购自上海欣软信息科技有限公司)是由旷场箱和数据自动采集处理系统两部分组成.旷场反应箱高为30 cm,底面为72 cm×72 cm,底面均分为64 个方格,内部16 个方格定义为中心区域,外围48个方格定义为外围区域.将小鼠放置在旷场中心点为起始位点,同时启动软件,开始识别跟踪小鼠的运动轨迹,记录并计算每只小鼠5 min 内的所有区域活动路径总距离和不同区域运动距离.
1.3 转棒疲劳实验
为检测小鼠骨骼肌的抓力和运动能力,使用YLS-4C 转棒疲劳仪,迫使小鼠在旋转棒上不停运动,当小鼠肌肉进入疲劳状态,小鼠会从转棒上掉下而终止测试.测试时,转棒仪转速为40 r/min,记录小鼠在转棒上的停留时间.
1.4 腓肠肌组织标本处理及苏木精-伊红染色法
麻醉小鼠,解剖并获取腓肠肌组织,沿肌纤维垂直方向切成0.5 cm×0.5 cm×1.0 cm 的组织块,浸入质量浓度为0.04 g/mL 多聚甲醛溶液固定6 h,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗,酒精系列梯度脱水,石蜡包埋.再将组织块切成4 μm 厚度的组织切片,置载玻片上60 ℃烘烤1 h.然后,将组织切片脱蜡、水化和PBS 清洗,苏木精核染20 min,水洗,伊红胞浆染色1 min,水洗.最后用酒精系列梯度脱水,用二甲苯进行透明处理,中性树脂封片. 显微镜下拍照记录,并使用Image J软件对图像中肌纤维横截面积进行计量.
1.5 提取组织总RNA及测序
从建模成功的糖尿病组和对照组各取3只鼠的腓肠肌组织,利用Trizol 试剂(美国Invitrogen)提取组织总RNA.使用NanoDrop 2000(美国Thermo)测定每个RNA 样品的浓度和纯度,再用琼脂糖凝胶电泳检测RNA 样品质量,置于冰箱-80 ℃低温保存.
取 5 μg RNA 样本经 Ribo-Zero™ Magnetic 试剂盒(美国Epicentre)去除样品核糖体RNA,再加入RNase R去除线性RNA分子.
利用NEB Next Ultra Directional RNA Library Prep Kit for Illumina 试剂盒(美国NEB)构建大分子RNA 文库,并通过Illumina Hiseq 4000 平台对样本进行测序.
1.6 测序数据处理和circRNAs鉴定
将测序平台测序得的原始图像数据文件,经过碱基识别分析,转换为序列文件.过滤掉测序接头序列以及低质量序列,得到高质量的干净数据.用Burrows-Wheeler Aligner(BWA)-MEM[12]方法将获得的数据与参考基因组和靶基因的进行比较,然后通过 Find_circ[13]和 CIRI2[14]筛选、鉴定候选 circRNA.Find_circ 软件可以利用高通量测序数据预测circRNA,CIRI2软件能够有效控制由错误匹配或者基因组中重复序列所导致的假阳性.
1.7 筛选差异表达circRNA
使用Spliced reads per billion mapping(SRPBM)软件[15]进行归一化处理,对候选circRNA 进行表达量的定量,以及运用DESeq R软件包对两组数据进行差异分析.获得差异表达倍数(fold change,FC),以|lb FC | >1,且P<0.05 为阈值,筛选与糖尿病肌萎缩相关且表达差异显著的候选circRNA.
1.8 基因本体功能和京都基因和基因组百科全书通路富集分析
利用基因本体(gene ontology,GO)提供基因的分子功能、生物学过程和细胞成分方面的功能注释和分类(http://www.geneontology.org),并利用京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)展示分子反应轴和信号通路的数据库(http://www.genome.jp/kegg/).本研究利用在线软件DAVID(https://david.ncifcrf.gov/)对差异表达circRNA 的亲本基因进行功能注释和富集分析.在GO 分析中,对包括生物过程、细胞成分和分子功能的每一部分按照富集基因个数排名,将排名前10的条目制成柱形图.在KEGG富集分析中,根据每个通路富集到的基因个数进行排名,并将排名前20的条目制成散点图.
1.9 构建circRNA-miRNA-mRNA调控网络
首先利用TargetScan(http://www.targetscan.org)软件预测能够与靶基因结合的miRNA;再用star-Base v3.0(http://starbase.sysu.edu.cn)预测miRNA能够结合的 circRNA,并通过 circBase 软件(http://www.circbase.org)统一circRNA的名称,对筛选出来的候选circRNA 进行匹配和整理,构建circRNA-miRNA-mRNA 的靶向反应轴;最后采用Cytoscape 3.8.0软件绘制分子调控互作网络图.
1.10 统计学处理
采用SPSS Statistic 22.0统计软件进行统计学分析,用GraphPad Prism 7 将统计结果绘制成图,实验重复次数n≥3.使用学生t检验(Student'st-test)来检验两组之间的差异,P<0.05为阈值,以判断两组数据是否具有统计学的显著性差异.
2 结果与分析
2.1 糖尿病小鼠模型的建立
STZ 处理组小鼠经STZ 注射后,在第3 天绝大多数鼠的血糖超过阈值,明显升高.个别血糖未升高小鼠,经STZ 再次注射后,在1 周内血糖水平均超过 16.7 mmol/L 的阈值,见图 1(a).STZ 处理组小鼠的高血糖水平一直保持至实验结束,而对照组小鼠血糖一直低于阈值,即处于正常水平.另外,当注射后第7天,可发现处理组小鼠的体质量明显轻于对照组,见图1(b).注射后第38 天,与对照组小鼠相比,可发现处理组小鼠的摄食量和饮水量都明显增多,见图1(c)和(d).从以上结果可知,处理组小鼠均出现了典型的糖尿病症状,由此判定STZ诱导小鼠糖尿病模型构建成功.

图1 STZ注射后小鼠的病理生理学变化Fig.1 Pathophysiological changes of mice after STZ injection
2.2 糖尿病小鼠骨骼肌功能检测
将STZ处理组和对照组小鼠分别进行旷场运动实验,分析两组小鼠在特定时间固定面积的运动场中的运动能力.结果显示,正常组小鼠5 min 内运动总距离为(73.492 ± 6.011)m,STZ 处理组小鼠为(47.063±6.117)m,见图2(a);正常组小鼠在中心区域的运动距离为(2.744±0.456)m,STZ 处理组小鼠为(0.775 ± 0.378)m,见图2(b);正常组小鼠在外围区域的运动距离为(18.505±0.811)m,STZ 处理组小鼠为(11.772±1.681)m,见图2(c).以上结果表明,与正常对照组相比,STZ 处理组小鼠在旷场的不同区域运动距离和运动总距离均明显减少,说明糖尿病小鼠的骨骼肌耐力较差.分别将STZ 处理组和对照组小鼠进行转棒疲劳实验,进一步分析两组小鼠在转棒上的停留时间.结果显示,与正常对照组(260±27)s 相比,STZ 处理组小鼠在转棒上停留时间(61 ± 16)s 明显缩短,见图2(d),说明糖尿病小鼠的骨骼肌更易疲劳.
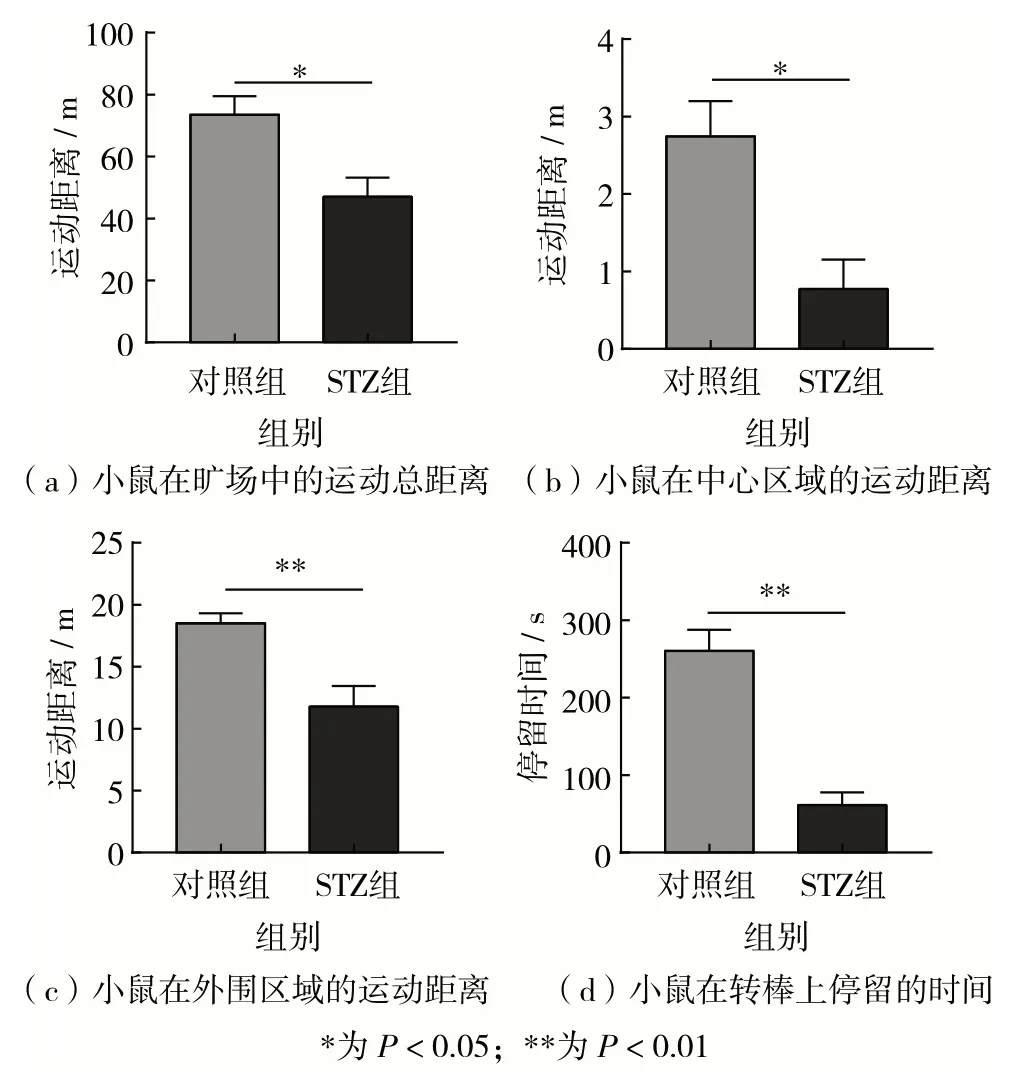
图2 糖尿病小鼠模型的旷场实验和转棒疲劳实验Fig.2 Open field test and rotating rod fatigue test in diabetes mice model
2.3 糖尿病小鼠骨骼肌的组织学分析
通过对STZ处理组和对照组小鼠腓肠肌的石蜡切片样本进行苏木精-伊红(hematoxylin-eosin,H&E)染色和比对,以分析两组小鼠骨骼肌的组织形态学变化.结果显示,STZ处理组小鼠的肌纤维横截面积明显变小(图3).

图3 STZ处理后对小鼠骨骼肌纤维横截面积的影响Fig.3 Effects on skeletal muscle cross-sectional areas of muscle fibers in STZ-treated mice
2.4 circRNAs类型的鉴定
利用circRNA 的剪接位点序列与全基因组的相对位置进行匹配,将可识别的circRNA 分为经典、可变外显子型、内含子型、跨外显子型、反义型和基因间型6种,见图4(a).根据该分类原则,统计circRNA各个类型的比例,结果见图4(b).

图4 RNA测序筛选出的circRNA类型和比例Fig.4 Types and proportions of circRNA by RNA-seq
2.5 circRNA的差异表达分析
在STZ 处理组和对照组两组样本中共检测出2 159个circRNA.采用SRPBM方法对circRNA的表达量进行定量与比对,以| lb FC |> 1 且P< 0.05 为阈值,筛选差异表达显著的circRNA,将差异表达的circRNA数据制成火山图见图5.由图5发现,差异表达显著的共有1 403 个.其中,上调显著的有690 个,下调显著的有713 个.上调排名前10 和下调排名前10的差异表达circRNA见表1.

表1 上调前10和下调前10的差异表达circRNA(P < 0.001)Table 1 Top 10 up-regulated and top 10 down-regulated circRNAs(P <0.001)

图5 STZ组和对照组小鼠骨骼肌circRNA差异表达火山图Fig.5 Volcano plots for differentially expressed circRNAs in skeletal muscle between STZ and control groups
2.6 与糖尿病病变相关的GO 细胞功能与KEGG信号通路的富集分析
对与糖尿病病变相关、有着显著差异表达的候选circRNA 的亲本基因进行GO 细胞功能和KEGG信号通路的富集分析(图6).GO的生物过程主要富集于脱氧核糖核酸(deoxyribonucleic acid,DNA)模板转录调控、运输和蛋白质磷酸化等,细胞成分主要富集于细胞质、细胞核和细胞膜等,以及分子功能主要富集于蛋白质结合、转移酶活性和水解酶活性等.而KEGG 主要富集于70 条信号通路.其中,MAPK[16]、FoxO[17]和泛素蛋白质水解作用[6]的信号通路已被报道与骨骼肌萎缩相关.
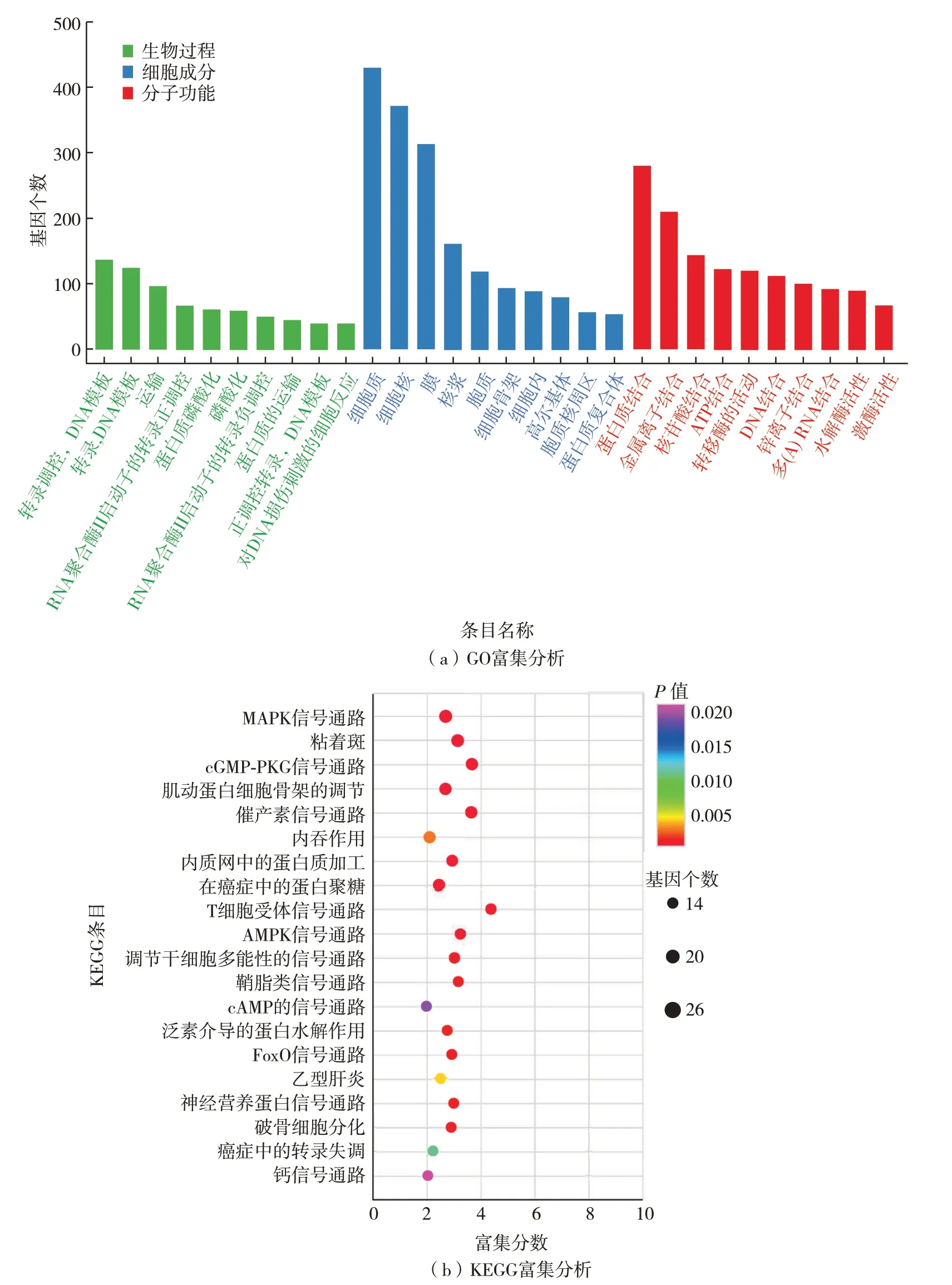
图6 候选circRNA亲本基因的GO和KEGG富集分析Fig.6 GO and KEGG enrichment analyses of parental genes of candidate circRNAs
2.7 circRNA-miRNA-mRNA调控互作网络的预测
文献[18]发现,肌肉环指蛋白1(muscle RING-finger protein 1,MuRF1)在骨骼肌和心肌萎缩中起重要作用,可作为骨骼肌肉萎缩多个模型的标记物.为进一步筛选与糖尿病骨骼肌萎缩相关的circRNA 以及缩小筛选范围,以MuRF1 为最终靶标,反向预测circRNA-miRNA-mRNA 反应轴中的miRNA 和circRNA. 通过生物学软件预测,发现10个miRNA与MuRF1 mRNA存在靶向关系,如mmumiR-29a-3p、mmu-miR-23b-3p、mmu-miR-23a-3p和mmu-miR-101b-3p 等,并通过这 10 个 miRNA 预测结合的circRNA.
与之前筛选出的表达上调的circRNA 进行匹配,再选择它们之间的交集,进行调控网络的构建(图7).由图7可见,在该调控网络中共有30个关键circRNA,包括mmu_circ_0001377、mmu_circ_0000375、mmu_circ_0001380、mmu_circ_0001313 和mmu_circ_0001410等.
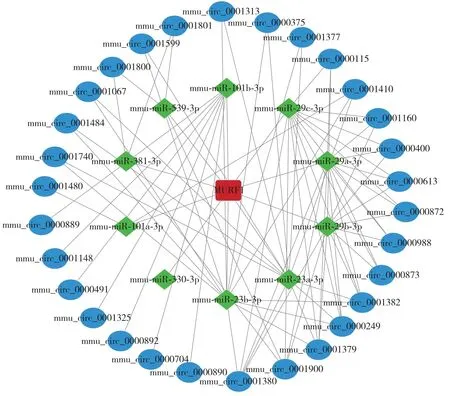
图7 circRNA-miRNA-mRNA互作网络Fig.7 The interaction network of circRNA-miRNA-mRNA
将这30 个circRNA 亲本基因进行KEGG 富集,发现只有2 个基因能够富集到KEGG 通路上,mmu_circ_0000491 和 mmu_circ_0001410 的 亲本基因,它们所在的通路为有机含硒化合物代谢通路和碳水化合物消化吸收通路,提示它们可能与糖尿病肌萎缩的营养代谢障碍相关.
3 讨 论
骨骼肌萎缩是糖尿病患者中晚期较严重的并发症[18],由于长期的糖代谢紊乱造成微血管病变,骨骼肌能量代谢受损和肌再生功能障碍,最终导致肌无力和运动受限等.在STZ诱导的糖尿病大鼠腓肠肌中肌生成转录因子和肌生成素的表达降低[19],糖尿病小鼠在引起退行性肌纤维损伤后,肌再生能力也受到损伤[20],STZ诱导的糖尿病骨骼肌中总肌卫星细胞含量和激活的肌卫星细胞占比明显下降[29].这些研究表明,糖尿病会导致肌卫星细胞数量减少和肌再生能力降低.在本研究中,通过构建STZ诱导1型糖尿病小鼠模型,发现糖尿病小鼠的骨骼肌质量和功能均有所降低.通过组织形态学分析,糖尿病小鼠骨骼肌发生萎缩,这与文献[19-21]报道的实验结果一致.
有研究表明,在肌肉发育和生长过程中,一些circRNA 起着关键作用,如CircZNF609能够促进人类肌细胞增殖[22],牛成肌细胞中CircFGFR4与miR-107 结合,通过靶向调控Wnt3a(Wnt family member 3A)促进肌细胞分化[23].除此之外,CircRNA 在肌肉的病理过程中也起着重要作用,如杜兴型肌营养不良(duchenne muscular dystrophy,DMD)和横纹肌瘤.产生于DMD基因外显子的circRNA可导致功能性肌营养不良蛋白质的变短,从而将DMD 表型拯救成无症状或轻度表型[24].在胚胎亚型横纹肌瘤衍生细胞系中,circZNF609 表达减少会导致Akt 蛋白质磷酸化水平的大幅下降,进而调控细胞增殖的相关途径[25].在本研究中,通过高通量测序筛选在STZ诱导糖尿病小鼠骨骼肌中差异表达的circRNA,可以发现更多与骨骼肌功能相关的非编码RNA,并利用生物信息学技术,分析circRNA 参与调控的细胞功能和信号通路,为后续的深入研究提供了实验数据和方向.
在很多病理生理条件下会导致骨骼肌萎缩的发生,如糖尿病、癌症、肾衰竭和败血症等重大疾病病变过程.目前研究证实,肌萎缩主要与泛素蛋白酶系统和自噬蛋白水解系统有关[26].蛋白水解系统的激活是由一系列在骨骼肌萎缩中筛选出来的靶基因参与了转录调节,这些基因被认为可以调节肌细胞成分的损失,因此被称为萎缩相关基因[27-28].E3泛素化连接酶在蛋白酶系统能够催化蛋白质的降解,其中只有少数E3 酶既具有肌细胞特异性又在肌纤维受损时表达上调.MuRF1 是一种环型E3 连接酶,最初由CENTNER 等[29-31]在试图研究肌原纤维蛋白与肌凝素的激酶域相互作用的过程中发现,在动物模型中呈上调表达.它被认为是参与骨骼肌萎缩的创始基因之一,可作为骨骼肌肉萎缩多个模型的标记物.因此本研究以MuRF1 为靶点,构建了circRNA-miRNA-mRNA 调控网络,推测出一批与糖尿病骨骼肌萎缩病变相关的circRNA,为进一步研究circRNA 在糖尿病骨骼肌萎缩的分子调控机制打开了新研究思路,并对该疾病的诊疗新方案提供了更多的可能性.
结 语
通过STZ诱导糖尿病小鼠模型,利用高通量测序和生物信息分析,筛选和发现了一批与骨骼肌萎缩病变相关的circRNA,并预测了circRNA-miRNA-mRNA 调控互作网络,对糖尿病并发症-肌萎缩的分子调控机制进行了初步探究.但是,这些新型生物标志物在该病变过程中的具体作用机制尚待进一步验证.
