高温胁迫诱导水稻白叶枯病菌在病叶中进入存活但不可培养状态的研究
2022-05-20张含王冰倩杜逸晨宋康丽李佳杨聂婧源宋从凤
张含,王冰倩,杜逸晨,宋康丽,李佳杨,聂婧源,宋从凤
(南京农业大学植物保护学院/农作物生物灾害综合治理教育部重点实验室,江苏 南京 210095)
在自然环境中,当植物病原细菌受到一定的压力胁迫时,其代谢发生改变,从而影响其在培养条件下的活力状态。VBNC(viable but non-culturable),即存活但不可培养状态,是微生物应对不良环境条件进化出的一种生存策略[1-2]。细菌进入VBNC状态后,细胞不再分裂,但仍然具有代谢活性。具有生物危害性的细菌在进入VBNC状态后,由于不能通过常规的分离培养方法检出,对于公共卫生或者农业生产会存在一定的潜在风险。VBNC状态最先于1982年在霍乱弧菌(Vibriocholera)以及大肠杆菌(Escherichiacoli)中首次发现[3],目前已经有80多种细菌被报道可以进入VBNC状态[1,4-5],但研究对象大多集中在与食品、环境以及医学领域相关的微生物上。植物病原细菌中已经报道可以进入VBNC状态的有Xanthomonascampestrispv.campestris、Agrobacteriumtumefaciens、Burkholderiacepacia、Pseudomonassyringaepv.syringae、Erwiniaamylovora、X.axonopodispv.citri、X.campestrispv.vesicatoria和Ralstoniasolanacearum[6-14]。诱导细菌进入VBNC状态的因子有化学和环境因素,包括温度、pH值、渗透压、盐度、营养等[15-16]。对于植物病原细菌VBNC现象的发现以及诱导因子的探究将有助于全面了解其生态学和生物学特点,对于病害的防治有重要的指导作用。
水稻白叶枯病是水稻上一种重要的细菌性病害,全生育期都可以发生,主要危害维管束,可引起叶枯型、急性型、凋萎型、黄叶型以及中脉型等不同类型的症状。病害一旦发生,水稻产量轻则下降10%~30%,严重时可达50% 以上,甚至颗粒无收[17]。水稻白叶枯病是由稻黄单胞菌稻致病变种Xanthomonasoryzaepv.oryzae(Xoo)引起。对于Xoo是否进入VBNC状态目前尚未见有报道。在20世纪70年代对水稻白叶枯病的病害循环进行了大量的实践研究,逐步探明了病害的初侵染来源为病稻草和稻桩、带菌稻种、再生稻、杂草及其他寄主植物[18]。但研究发现,白叶枯病植物中病菌存活的时间长短与采集时和以后保存的温度关系较大。7月份采集的标本经过一个炎热的夏季,4个月后极少能成功分离出病原菌,9—10月随着气温的降低,在各地采集的标本分离成功率都很高(参考1975年未出版的全国水稻白叶枯病防治研究资料选编)。病样中病原菌不能分离是由于病原菌死亡,还是由于病原菌进入了不能培养但仍然活着的状态尚未见有报道。另外,由于Xoo的生长相对于常见植物腐生菌的生长较慢,传统的病原菌分离培养方法只能用于测定采集后妥善保存的病叶,暴露在外界杂菌多,且已腐烂的样品不容易分离成功。本研究通过对采集自田间,保存在室温和低温下的样品进行病原菌分离,确定了样品保存的合适条件以及可能保存的时间,并利用细胞染色的方法研究了人工接种叶片中Xoo的存活状态,研究结果对于全面了解白叶枯病菌的侵染循环并制定有效防治白叶枯病的方法提供了理论依据。
1 材料与方法
1.1 供试材料
本研究所用的田间样品的采集、保存信息见表1。
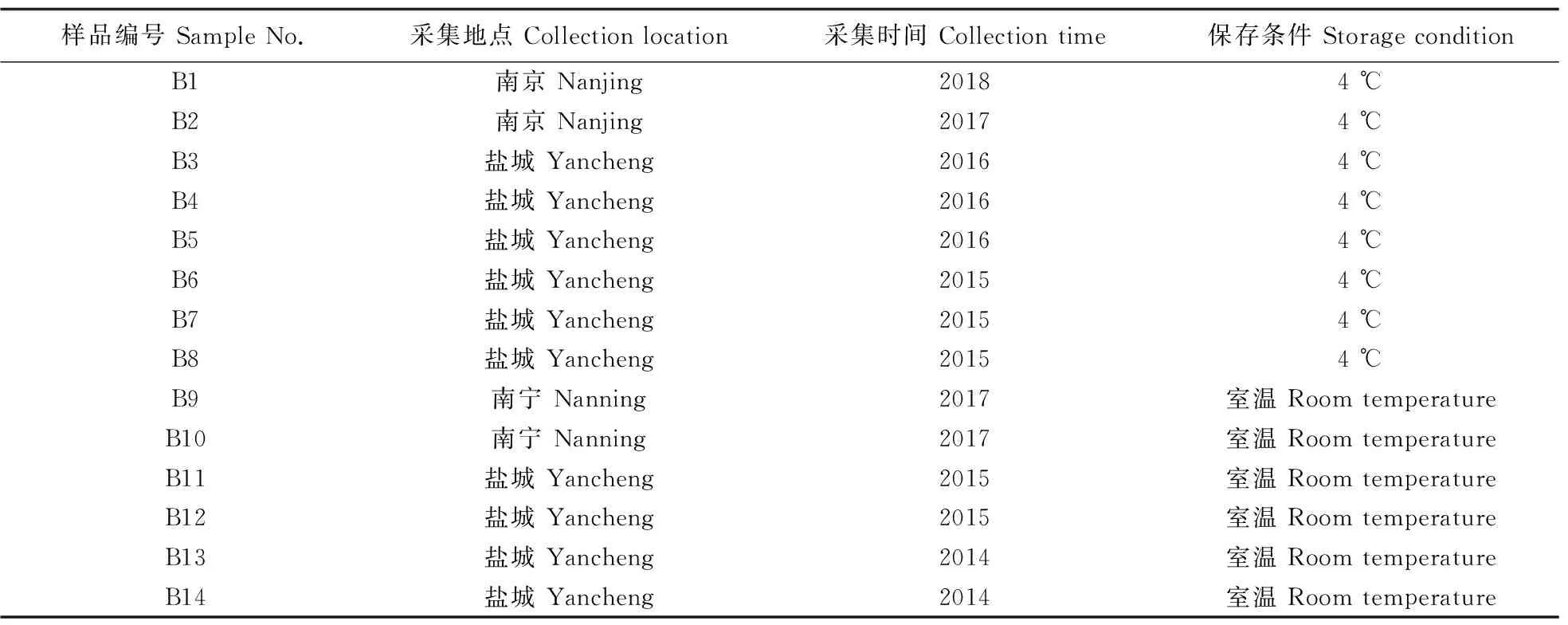
表1 用于分离的水稻白叶枯病叶样品信息Table 1 Information of bacterial leaf blight samples of rice
菌株:PXO99A为菲律宾菌株6号小种的代表菌株,经氮胞苷处理过。人工接种的水稻白叶枯病叶:在苗龄为1个月的杂交水稻‘深两优871’上接种PXO99A,24 d 后采集发病叶片备用。
染料:MycoLightTMGreen JJ98 and JJ99(AAT Bioquest®,Canada),碘化丙啶(PI)(AAT Bioquest®,Canada)。抗生素利福平(Rifampicin,Rif)的工作浓度为 50 μg·mL-1。
1.2 病叶组织中病原菌的分离和菌量计测
田间病叶组织中病原物的分离:在载玻片上滴加1滴灭菌水,选取具有典型病害症状的水稻叶片,在病斑靠近基部剪取长宽约为1~2 mm 的组织块放入灭菌水中,盖上盖玻片,在显微镜下观察切口处是否有溢菌出现。选取出现溢菌的原初叶片,用75%乙醇棉片对剪口附近组织进行表面消毒,在剪口处向叶片基部组织方向剪取5~10 mm 长的组织块插入装有50 μL灭菌水的EP管中,静置5~10 min。然后取5 μL 浸出液,在NA平板上划线涂布开,然后转动平板,从第一次划线部分向约45度方向划线,使第一次划线区域的菌稀释开,重复上述操作3~4次,直到将平板划满。我们将这个方法称为划线稀释法(图1-A)。将平板置于28 ℃ 培养箱中培养。在传统的末端划线分离法[19](图1-B)上用接种环划线涂布开,转动平板,在第一次划线的末端部分向外划线,然后再转动平板在上一次的末端部分划线,重复3~4次。病原菌分离试验重复3次以上。
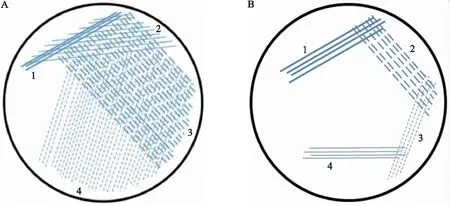
图1 划线稀释分离法(A)和末端划线分离法(B)示意图Fig.1 Schematic diagram of streaking dilution separation method(A)and end streaking separation method(B)图中数字表示划线的次序。The numbers in the figure indicate the order of streaking.
人工接种白叶枯病叶中菌量计测:取发病症状典型的病叶若干片,将病斑部分剪成0.5 cm小段,充分混合后平均分成3份,分别置于4、28和37 ℃ 恒温保存。每隔30 d取6个叶片段,用75% 乙醇擦拭叶片表面消毒,切取微小组织块在显微镜下观察,确保每张叶片都有喷菌现象。将6片叶段加入200 μL 0.9% 生理盐水中,使其喷菌1 h 后,按10倍梯度稀释,吸取5 μL 原液以及各稀释倍数菌液点于NA+Rif平板上,28 ℃培养,统计菌落数以计算菌含量值。每个样品设3次重复。试验重复2次。
1.3 菌落PCR验证和喷菌液的荧光定量PCR
1.3.1 菌落PCR用牙签挑取少许单菌落菌苔放入盛有100 μL无菌水的PCR管中,利用PCR仪加热变性5 min 释放菌体中的基因组DNA到水中,然后10 000 r·min-1离心1 min,取1 μL 上清液作为PCR的模板。Xoo特异性引物为Xoo4009F/R:CCTTCATTTCCGTCGTCATC/ATGCATGAAGAACCACCACA[20],PCR反应程序为94 ℃ 3 min;94 ℃ 30 s,64 ℃ 30 s,72 ℃ 90 s,34个循环;72 ℃ 7 min。
1.3.2 喷菌液的荧光定量PCR取没有分离到白叶枯病原菌的叶片段10个,加入1 mL灭菌水,喷菌3 h后将喷菌液在PCR仪上加热变性5 min,释放菌体中的基因组DNA到水中,再在10 000 r·min-1离心1 min,取1 μL 上清液作PCR的模板。分别用细菌通用性引物16SF/R:TGGTAGTCCACGCCCTAAACG/CTGGAAAGTTCCGTGGATGTC以及Xoo的特异性引物Xoo4009F/R进行荧光定量PCR,每组设置4个重复,通过CT值的比较来初步检测喷菌液中Xoo的含量在整体细菌中的比例。荧光定量PCR采用ChamQ SYBR qPCR Master Mix 试剂盒(Vazyme),ABI PRISM 7500 quantitative PCR system(Applied Biosystems,USA)。反应程序为:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环。计算每个反应的CT值。试验重复2次。
1.4 喷菌液中活、死细胞染色及细胞数目统计
将MycoLightTMGreen JJ98 and JJ99和碘化丙啶(PI)2种染料先用0.9% 生理盐水稀释,再与喷菌液混合使其终浓度分别为20和5 μmol·L-1,混匀后避光常温放置15~30 min,在倒置荧光显微镜下观察细胞染色情况。MycoLightTMGreen JJ98 and JJ99染色后死细胞和活细胞均染色并发出绿色荧光,PI染色后只有死细胞染色发出红色荧光。选择盖玻片上的左上、右上、中央、左下及右下5个视野,分别统计发出绿色荧光的总细胞数以及发出红色荧光的死细胞数,再根据整合后的图片,统计仅发出绿色荧光的活细胞数。试验重复2次。
1.5 统计与分析
统计分析采用单因素随机区组分析。
2 结果与分析
2.1 不同保存条件下水稻白叶枯病叶中病原菌的分离
在2019年,14个样品在分离前都先取具有典型症状的叶片的病健交界处检查喷菌现象,结果发现 14个样品都有明显的喷菌现象,不同样品间喷菌现象没有明显差异。从8个保存于4 ℃ 的样品中都分离到典型黄单胞的菌落,而从6个保存在室温的样品中都没有分离到病原菌,并且这些样品在平板上也很少有其他微生物生长。8个低温保存的样品中,B1和B4的分离物中杂菌较多(图2-A),其他样品的分离物相对较单一,为白叶枯病菌(图2-B)。在分离时,杂菌的生长速度相对较快,在培养后1~2 d就有生长,而白叶枯病菌的生长速度则相对较慢,一般在培养后的3~4 d或者更久时间才有菌落出现。当样品内杂菌多时,培养前2 d生长出来的杂菌生长较快,很快覆盖了平板较早划线的部分,有些杂菌菌落多糖较多,会成流淌样。对于这样的样品,应当采用划线稀释分离的方法,水稻白叶枯病菌虽然生长较慢,但从图1-A可见,在后几次的划线区域,生长较慢的白叶枯病菌的菌落在生长较快的杂菌菌落之间出现。对于该样本,采用传统的末端划线的方法则很难获得白叶枯病菌菌落(图2-C)。由此可以看出平板划线稀释法相对于传统的末端划线法在分离含腐生或内生菌多的样品时具有显著的优点。
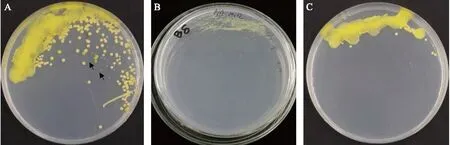
图2 田间水稻白叶枯病样品的划线分离Fig.2 Xanthomonas oryzae pv. oryzae(Xoo) isolation of the field rice bacterial leaf blight samples by streaking seperation methods A. B4样本的划线稀释分离 B4 sample by streaking dilution separation;B. B8样本的划线稀释分离 B8 sample by streaking dilution separation;C. B4样本的末端划线分离 B4 sample by end streaking separation.图中箭头表示生长较慢的水稻白叶枯病菌菌落。The arrows in the figure show the slower growing Xoo colonies.
用Xoo特异性引物Xoo4009F/R对已经分离到的菌进行PCR检测,结果如图3所示。无论是以分离菌株的单菌落为模板(图3的16~23),还是以喷菌液(图3的2~15)为模板,都获得了1条大小为300 bp 左右的白叶枯病菌特异性条带。表明田间采集的水稻白叶枯病样保存在4 ℃下4年仍可以分离到病原菌。而保存在非恒定的室温条件下2年内就不能分离到病原菌。
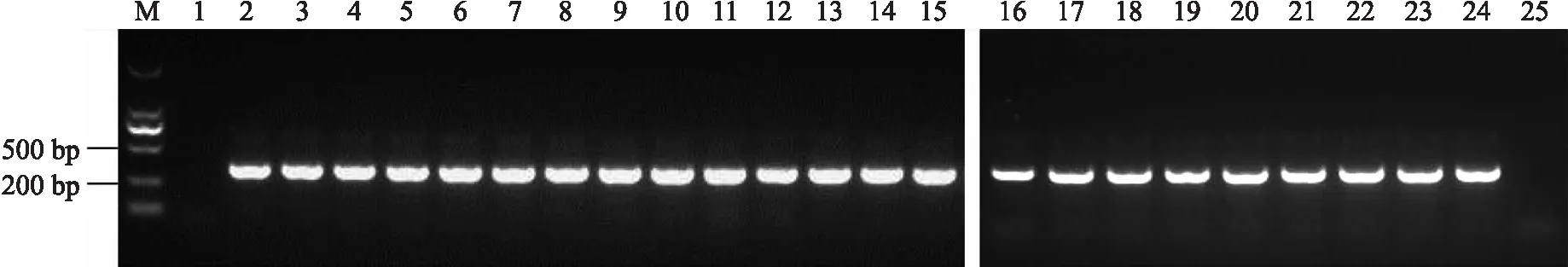
图3 喷菌液和分离菌株的PCR验证Fig.3 PCR verification of bacterial exudation liquid and isolated strains M. DL2000分子量标准;1.菜豆叶斑病样品喷菌液(对照);2~15. 样品B1—B14的喷菌液;16~23. 样品B1—B8分离获得的单菌落;24. PXO99A基因组DNA的阳性对照;25. 无菌水的阴性对照。M. DL2000 molecular standard;1. Bacterial exudation of bean bacterial leaf spot sample as a control;2-15. Bacterial exudation of sample B1-B14 respectively;16-23. Single colony isolated from sample B1-B8 respectively;24. PXO99A genomic DNA as positive control;25.Sterile water as negative control.
2.2 不同温度保存条件下人工接种水稻病叶中的细菌可培养菌量测定
在水稻上人工接种利福平标记的Xoo获得发病水稻叶片,然后放置在不同温度下保存,在不同时间取样分离病叶中的病原菌。从图4可见:保存0、30和60 d 后,在4 ℃保存的叶片的菌量分别为1.41×106、2.59×105和2.03×104CFU·mL-1,在28 ℃保存的叶片的菌量分别为7.1×105、1.85×106和1.83×104CFU·mL-1,可见保存60 d的叶片中可培养菌量在和28 ℃下都有小幅度的下降。但在37 ℃ 保存0和30 d叶片的菌量分别为1.79×107和5.2×102CFU·mL-1,可培养菌量在30 d时下降了近5个数量级,保存60 d的样品中则不能分离到可培养的细菌。但此时将3个温度下不同保存时间的9个处理组样品分别进行喷菌现象检测,都观察到明显的喷菌现象,处理间喷菌的速度和菌量未见有明显的差异。
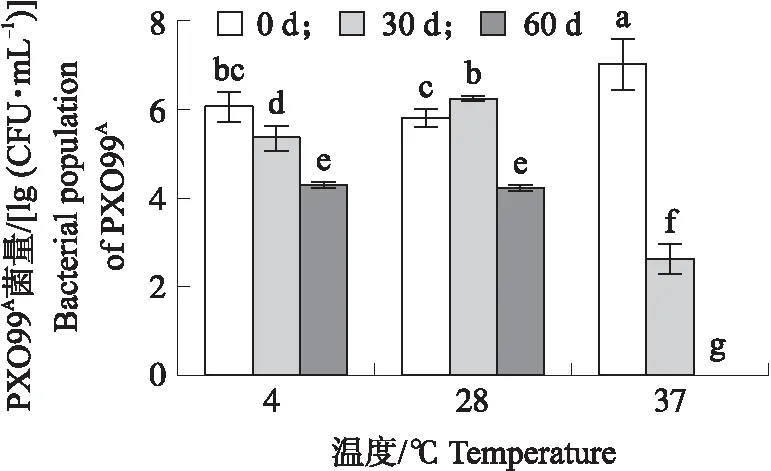
图4 不同温度保存的水稻白叶枯病样中PXO99A 在培养基上的计量Fig.4 The population of culturable PXO99A in samples of rice bacterial leaf blight stored at different temperatures
2.3 平板不能分离病菌的喷菌液中细胞染色
选用染料MycoLightTMGreen JJ98 and JJ99和碘化丙啶对在4、28和37 ℃保存60 d的样品的喷菌液以及PXO99A的培养液(作为对照)进行染色,在显微镜下观察细胞的荧光表达情况。结果如图5所示,新鲜培养的PXO99A活力较好,死细胞相对较少,所以碘化丙啶染色后有极少量的散发红色荧光的死细胞,而经MycoLightTMGreen JJ98 and JJ99染色后发出绿色荧光,2种荧光整合后看到视野中大部分是呈现绿色荧光的活细胞。说明利用MycoLightTMGreen JJ98 and JJ99和碘化丙啶可以检测细胞的死活状态。3个温度处理组均有细胞发出红色荧光,说明存在不同程度的细胞死亡现象,将绿色荧光和红色荧光通道整合之后,均可以在3个处理组中发现有单独发出绿色荧光的活细胞,在37 ℃ 处理中也发现有绿色荧光细胞。

图5 不同处理下PXO99A的细胞染色情况Fig.5 The bacteria cell staining of PXO99A in different treatments
统计每个处理5个视野下活、死细胞占细胞总数的比例,发现在4 ℃ 保存的叶片喷菌中活细胞占52.51%,死细胞占47.49%;在28 ℃ 保存活细胞占32.17%,死细胞占67.83%;37 ℃ 保存的叶片喷菌液中活细胞占24.02%,死细胞占75.98%(图6)。由以上数据可以看出,随着病样保存温度的升高,活细胞比例逐渐减少。在37 ℃ 保存60 d病叶的喷菌液中没有分离到能培养的病原菌,但细胞染色显示,约有近1/4的活细胞存在,这说明这些细胞可能进入了VBNC的状态。
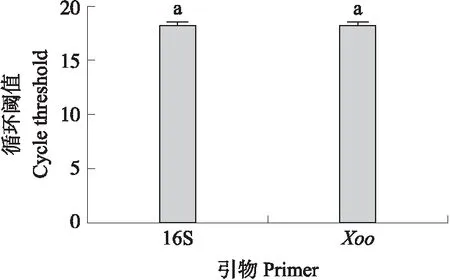
图7 37 ℃保存样品喷菌液中总细菌(16S)和 水稻白叶枯病菌(Xoo)的定量Fig.7 Relative quantification of total bacteria(16S)and Xoo in bacterial exudations of 37 ℃ preserved bacterial leaf blight samples
为了进一步确定这些经过染色后显示为活细胞的细菌是Xoo,还是植物中的腐生或内生菌,通过荧光定量PCR对37 ℃保存60 d的样品中总细菌量和Xoo量分别进行了定量分析。16S引物是细菌的通用引物,可以用来确定喷菌液中的细菌总量,Xoo特异性的引物Xoo4009F/R被用来检测Xoo的总量。通过比较定量PCR的CT值可以了解反应液中总细菌和Xoo菌的相对量。从图7可见:用加热裂解后的喷菌液作为模板进行定量PCR分析,16S引物和Xoo4009F/R引物扩增后的CT值没有显著差异。这说明在喷菌液中的细菌基本都是Xoo,而腐生或内生的细菌极少。由此可见37 ℃保存60 d的样品中24.02%的活细胞应该是进入了VBNC状态的Xoo。
3 讨论与结论
水稻白叶枯病是水稻上的维管束病害,病原菌Xoo在稻种、病稻草、稻桩或者杂草上越冬作为初侵染来源。研究环境条件对Xoo存活率和生活力的影响对于全面了解该病害的发生特点,制定有效的防病策略具有重要的意义。在本研究中,我们对田间采集的保存在不同条件下的水稻白叶枯病样品中的Xoo利用不同方法进行了分离研究,结果显示只要是发病的样品,在室温或4 ℃下保存1~5年都可以观察到喷菌现象。喷菌现象只能是细菌侵染过的表征,不能说明其中菌体的活力状况。从病叶中分离Xoo时,只有保存在4 ℃的样品可以分离到Xoo,而且保存了4年的样品仍然可以分离到Xoo,不同保存年代的样品中分离到的Xoo之间的活力差异不显著,一般平板生长3~4 d可见有菌落出现。保存在室温(2~5年)的样品中却未能分离到Xoo,平板放置7~10 d未见有菌落出现。这个结果说明高温对于病叶中Xoo的存活或活力是有影响的,这与过去报道的经过夏季高温后采集的样品分离Xoo较难是一致的(未出版资料选,1975)。从病植物上分离病原菌时,通常有组织块分离法、稀释分离法和划线分离法[21-23],但在分离田间样品时有的样品状态较差,尤其是水稻生长后期,病叶枯死厉害,腐生菌较多,如果用常规组织块诱导菌脓,则大量的腐生菌菌脓会很快覆盖组织块,诱导菌脓相当于让腐生菌得到了更多的富集,使得生长慢的病原菌的量占比更少,因此不利于分离病原菌。如果用磨碎病组织进行稀释涂板分离,则需要对磨样做一系列的稀释,每个稀释度都要进行涂板,这需要较多的平板。特别是在批量分离样品时,费时费工成本高。本研究中介绍的划线稀释法通过直接收集喷菌液,腐生菌没有经过富集,采用划线的方法进行依次稀释,在前面菌浓度高区域的腐生菌优势生长,经过几次划线稀释后腐生菌和病原菌一起被稀释,在腐生菌菌落之间给生长慢的病原菌提供足够的生长空间,这样在一块平板上就可以获得病原菌的单菌落。
对经过37 ℃高温处理的水稻病叶的喷菌现象检测显示有大量的菌体存在,但却很难分离到Xoo,此时的Xoo是死亡了,还是处于不可培养状态(VBNC)尚不得而知。有文献记载在自然条件下Xoo存在生长停滞现象[18],但未见试验证据报道。细菌的VBNC现象是在1982年被发现的,目前,能进入VBNC状态的黄单胞菌只有地毯草黄单胞菌(X.axonopodis)[11]以及野油菜黄单胞菌(X.campestris)[6,13]被报道。本研究利用平板分离法及活、死细菌检测试剂盒[24]证实了PXO99A在37 ℃ 时不能分离的Xoo部分进入了VBNC状态。有文献记载,带菌的稻种在干燥贮存条件下,病菌可存活8~10个月,在贮存期病菌会逐渐死亡,到播种时种子带菌率很低,但由于播种量大,仍有足够的传病来源[25]。对于该记载,我们认为由于先前没有对VBNC的认知,确定病菌存活或种子带菌率一般是根据在培养基上分离Xoo的结果,不能分离到Xoo只能说明没有可培养的病菌,但却不能够发现存活但不可培养的Xoo的存在。
根据本文对Xoo能够进入VBNC状态的研究结果,我们可以对自然条件下水稻白叶枯病病害循环进行下面的假设:在夏季高温胁迫下,存在于稻种中或病残体中的Xoo可部分进入VBNC状态有助于其越冬,在水稻生长季开始的时候这些进入VBNC的Xoo随种子萌发,或水稻生长受到特定的刺激而复苏,Xoo活化增殖后从特定途径侵入水稻引起病害。至于对进入VBNC的Xoo在什么条件下受哪些因子的影响而复苏仍需做进一步的研究。
