同源四倍体不结球白菜‘五月慢’新材料的创制及其特性
2022-05-20张咪宋莹王夏刘金平张昌伟李英侯喜林柳李旺刘同坤
张咪,宋莹,王夏,刘金平,张昌伟,李英,侯喜林,柳李旺,刘同坤*
(1.南京农业大学作物遗传与种质创新国家重点实验室/农业农村部华东地区园艺作物生物学与种质创制重点实验室/ 园艺学院,江苏 南京 210095;2.南京市蔬菜花卉科学研究所,江苏 南京 211155)
不结球白菜(Brassicacampestrisssp.chinensisMakino),为十字花科芸薹属芸薹种的一个亚种,原产于我国,后被东南亚、美国、日本以及一些欧洲国家广泛引种,逐步发展成为世界性蔬菜。因其生长周期较短、生长适应范围广、营养品质高,一直深受大众的喜爱。不结球白菜在我国蔬菜周年供应中占据着重要的比重[1]。
多倍体育种是指经过人工处理使植物细胞的染色体组数加倍来获得多倍体材料,常用的人工诱导染色体加倍的方法有物理诱导法、化学诱导法和生物诱导法,物理诱导法虽简便但诱导率低、对人体有一定危害,因此未在生产中广泛应用[2]。利用化学试剂诱导是目前最普遍也是最有效的方法,秋水仙素因其处理方式简便多样,且对染色体结构无破坏作用、诱变率高而被广泛应用[3]。秋水仙素已成功诱导出大蒜[4]、苹果[5]、马铃薯[6]、月季[7]等植物的多倍体植株。
多倍体育种的优势在于由于染色体组数的增加,引起基因剂量的增加以及核质互作的影响,使植物体内生理生化反应活性增加,光合特性也得到提高,次生代谢产物积累。多倍体植株与二倍体植株相比具有较高的生活力,能够提高产量和品质,提高对生物和非生物胁迫的耐受性,植株多倍化还可以解决远缘杂交不亲和等问题,多倍体的增产效益远大于常规育种,是进行种质创新的重要手段[8]。目前市场上的不结球白菜多为二倍体品种,种植过程中病害严重影响其产量和品质,提高不结球白菜的产量、品质及抗病性一直是种质创新的目标。研究发现不结球白菜经秋水仙素诱导加倍后,表现出营养价值高、农艺性状好且晚抽薹的特性[9]。潘静雯等[10]利用秋水仙素成功诱导出营养品质更高的不结球白菜‘苏州青’四倍体,为选育四倍体不结球白菜提供理论基础和种质资源。不结球白菜‘四月白’的同源四倍体植株抗寒能力强,光合产物高,更能适应低温环境[11]。在不结球白菜夏季抗热性试验中,‘烤青’和‘夏帝’四倍体植株表现出丰产性,与二倍体相比四倍体的可溶性糖、维生素C和干物质含量极显著增高[12]。
不结球白菜‘五月慢’是我国上海的一个地方品种,株型直立,耐寒、耐抽薹性强,但品质和抗病性较差。目前市场上常见的‘五月慢’多为二倍体品种,为获得高产、优质、抗病的不结球白菜‘五月慢’新种质,本试验采用秋水仙素诱导‘五月慢’二倍体植株获得同源四倍体植株,旨在为不结球白菜‘五月慢’优质、抗病育种提供新材料。
1 材料与方法
1.1 试验材料
供试材料为不结球白菜品种‘五月慢’(2n=2x=20)二倍体的多代自交系,由南京农业大学园艺学院白菜系统生物学实验室提供。试验于2019年9月—2021年5月在江苏句容农博园试验基地和南京市蔬菜花卉科学研究所进行。
1.2 不结球白菜同源四倍体诱导方法
采用赵建华等[13]的方法。在二倍体‘五月慢’幼苗生长至2片子叶完全展开时,采用浓度为2 g·L-1的秋水仙素溶液点滴幼株的生长点,每株每次用量20 μL,处理350株。于每日09:00和17:00各处理 1次,共处理5次;对照组(CK)用蒸馏水处理,对照组70株。
1.3 多倍体鉴定方法
1.3.1 形态学鉴定采用彭绿春等[14]的方法对植株形态进行初步鉴定,以同生长期二倍体‘五月慢’植株作为对照,观察诱变植株的株高、开展度、叶形、叶色以及花器官等形态学性状的变化,若有明显差异,则鉴定为多倍体疑似植株。
1.3.2 解剖学鉴定解剖学鉴定以气孔大小和密度、花粉的大小和形态为依据。采用杨柳等[15]的方法,选取二倍体和四倍体疑似株同时期完全展开叶片,避开叶脉部分撕取叶片下表皮,置于光学显微镜下观察气孔的大小和密度是否有差异。取同花期花粉状况良好的二倍体和四倍体疑似株花粉,置于光学显微镜下观察比较花粉粒的大小和形态是否有差异。若气孔明显变大、花粉粒形状不规则,则可鉴定为四倍体疑似植株。
1.3.3 细胞学鉴定采用常贝贝等[16]的方法,将收取的疑似同源四倍体植株的种子进行催芽,待根长至1~1.5 cm时切取根部冰水预处理,卡诺固定后用盐酸解离,用改良卡宝品红染液染色制片,正置荧光显微镜下观察拍照。
1.3.4 流式细胞仪分析采用董馨忆等[17]的方法,用流式细胞仪分析鉴定疑似株的DNA含量,以二倍体植株DNA含量作为对照,每组设置3次重复。
1.4 二、四倍体不结球白菜‘五月慢’农艺性状比较和营养品质测定
1.4.1 农艺性状比较将鉴定的四倍体‘五月慢’M0代蕾期单株套袋自交授粉,并单株收种。将M1代种子于2020年9月29日播种于南京市蔬菜花卉科学研究所,于2020年12月15日测定农艺性状指标。分别在二、四倍体小区内随机选取10株‘五月慢’,统计株高,植株开展度,叶长、宽,叶片最宽处十叶厚,叶柄长、宽、厚,叶片数等农艺性状,并计算增加率,增加率=(4x-2x)/2x×100%。
1.4.2 营养品质测定随机各选取3株生长时期及长势相同的二、四倍体‘五月慢’植株,取靠近生长点第7片真叶,弃掉叶柄和主叶脉取叶片部分测定可溶性糖、可溶性蛋白、叶绿素、有机酸、硝态氮以及纤维素含量等营养指标。可溶性糖含量测定采用蒽酮比色法,使用迈博生物植物可溶性糖含量测试盒(MB-C-B602);可溶性蛋白含量测定采用考马斯亮蓝G-250染色法[18];叶绿素含量测定采用乙醇提取比色法[19];有机酸含量测定采用NaOH滴定法[20];硝态氮含量测定采用硝基水杨酸比色法[21];纤维素含量测定使用科铭生物纤维素含量测试盒(CLL-2-Y)测定。
1.5 二倍体、四倍体‘五月慢’的光合特性分析
采用李君霞等[22]的方法于晴天 09:00—11:00采用便携式光合测定系统(Li-6400XT,USA)进行测定,设定CO2浓度为 400 μmol·mol-1,测定其在0、20、50、100、150、250、500、750、1 000、1 200、1 500和 2 000 μmol·m-2·s-1光照强度时叶片的单位面积净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci),每个处理随机选取3株,每株测定性状和大小相似的叶片,作为3次重复。根据回归方程分别求出光饱和点(LSP)、光补偿点(LCP)、最大净光合速率(Pmax)、表观量子效率(AQY)、暗呼吸速率(Rday)等光合指标。
1.6 二倍体、四倍体‘五月慢’的抗病测定
1.6.1 灰霉菌小孢子悬浮液的制备及侵染采用张越亭等[23]的方法将灰霉菌菌种接种在V8固体培养基(360 g·L-1V8 果汁,20 g·L-1琼脂,2 g·L-1CaCO3)上继代培养,20~25 ℃恒温避光培养7~14 d。待培养皿内长满孢子后,用组培刀将菌丝刮下置于重悬液(10 g·L-1蛋白胨,40 g·L-1麦芽糖)中,剧烈振荡以释放孢子,再用纱布过滤后,采用血球计数板调节孢子浓度至 1×107mL-1。以二倍体‘五月慢’为对照组,四倍体‘五月慢’为试验组,选取同生长时期靠近植株生长点的第6片真叶,将离体叶片置于含有湿润滤纸的培养皿中,将孢子悬浮液点滴在叶片上避开叶片边缘和叶脉,每滴10 μL,在12 h/12 h光暗交替、光照强度为400 μmol·m-2·s-1、25 ℃恒温的培养箱中培养3 d,每个处理取3棵植株作为3个重复,观察叶片发病情况。于接种3 d后,取对照组和试验组叶片病斑周围1 cm内的组织,-80 ℃保存。提取总RNA,纯化后合成cDNA进行实时荧光定量PCR反应,测定灰霉菌的表达量。
1.6.2 总RNA的提取、纯化和cDNA的合成取0.1 g样品于液氮中用磨样机研磨,使用北京天根生化科技有限公司提供的植物总RNA提取试剂盒提取RNA。按照PrimeScriptTMRT reagent Kit反转录试剂盒(TaKaRa)进行反转录。
1.6.3 实时荧光定量PCR反应体系和反应程序使用翊圣公司Hieff qPCR SYBR Green Master mix(High Rox Plus)试剂盒进行荧光定量PCR反应,20 μL反应体系:10 μL Hieff qPCR SYBR Green Master Mix,1 μL cDNA模板,正、反向引物各0.5 μL,8 μL无菌超纯水。反应程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,40个循环。每组设置3次试验重复。试验数据利用2-ΔΔCT法进行分析[24],检测灰霉菌Bcactin基因在不结球白菜中的表达水平,以不结球白菜基因actin作为内参基因。
1.7 数据分析
利用 Excel 2020软件对所得数据进行整理,采用SPSS Statistics 25软件对试验数据进行分析,采用独立样本t检验方法分析数据差异显著性。
2 结果与分析
2.1 二、四倍体‘五月慢’形态学与解剖学鉴定
由图1可见:与二倍体不结球白菜‘五月慢’相比,同源四倍体植株株型变小(图1-A);叶片变短、变宽,叶片长宽比变小(图1-B);花器官变化明显,花瓣、花萼、柱头、雄蕊均有明显的变大趋势(图1-C、D);种子直径明显变大(图1-E),种荚变粗(图1-F);同源四倍体气孔变大且密度变小(图1-G、H);二倍体花粉粒呈规则的椭圆形,同源四倍体的花粉粒呈现多种不规则形状(图1-I、J)。

图1 二、四倍体不结球白菜‘五月慢’形态与解剖学差异对比Fig.1 Comparison of morphological and anatomical differences between diploid and tetraploid plants of non-heading Chinese cabbage ‘Wuyueman’A.植株Plant;B.叶片Leaf;C、D.花器官Floral organ;E.种子Seed;F.荚果Silique;G、H.气孔Stomata;I、J.花粉Pollen.2x:二倍体Diploid;4x:四倍体Tetraploid.
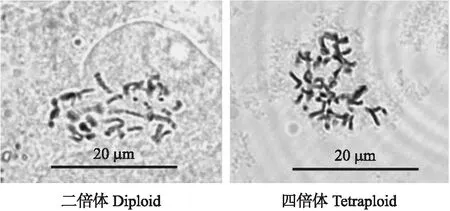
图2 二、四倍体不结球白菜‘五月慢’细胞学鉴定结果Fig.2 The cytological identification of diploid and tetraploid plants of non-heading Chinese cabbage ‘Wuyueman’
2.2 二、四倍体‘五月慢’细胞学鉴定
将经过形态学鉴定出的四倍体疑似株在蕾期套袋单株自交收种,选取部分收到的种子催芽切取根尖制片,在显微镜下观察染色体数。由图2可见:同源四倍体根尖染色体数为2n=4x=40,对照组的二倍体种子根尖染色体数为2n=2x=20。表明不结球白菜‘五月慢’同源四倍体植株诱变成功,并获得同源四倍体植株种子。
2.3 二、四倍体‘五月慢’流式细胞仪鉴定分析
为了进一步验证同源四倍体植株,利用流式细胞仪测定二、四倍体植株的DNA含量。由图3可见:靠近纵坐标的第1个峰值为DNA发生复制前G1期的DNA相对含量,第2个峰值为DNA发生复制后G2期的相对含量。二倍体‘五月慢’在G1期DNA相对含量约为50,四倍体‘五月慢’在G1期DNA相对含量约为100。分析表明,四倍体的DNA荧光强度约为二倍体的2倍,进一步确定了该植株为四倍体植株。用此方法对诱变群体进行鉴定,共获得四倍体植株29株,总变异率为8.29%。
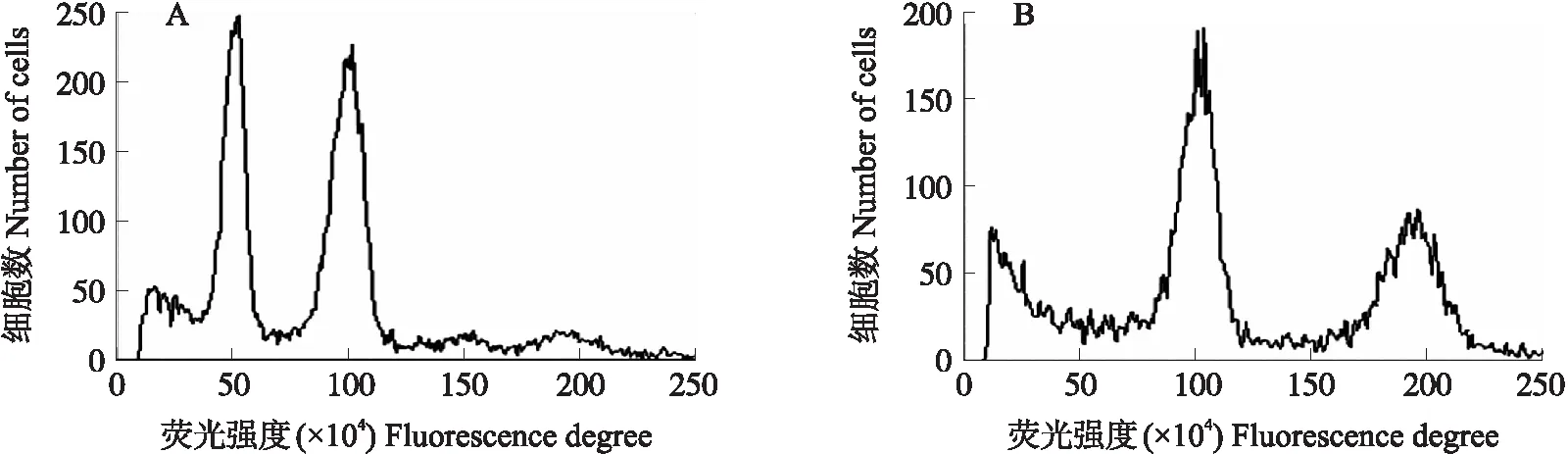
图3 二倍体(A)和四倍体(B)不结球白菜流式细胞仪鉴定结果Fig.3 Identification results of diploid(A)and tetraploid(B)in non-heading Chinese cabbage by flow cytometry
2.4 二、四倍体‘五月慢’农艺性状比较
将鉴定获得的二、四倍体‘五月慢’主要农艺性状进行比较分析。与二倍体植株相比,四倍体的叶片数、十叶厚分别增加了2.90%、1.96%,无显著差异;叶宽、叶柄厚分别增加了19.78%、75.96%,差异显著;株高、开展度、叶长、叶柄长和叶柄宽分别显著降低了12.83%、27.53%、24.35%、15.9%、19.58%(表1)。

表1 二、四倍体植株主要农艺学性状比较Table 1 Comparison of main agronomic traits of diploid and tetraploid plants
2.5 二、四倍体‘五月慢’植株营养品质的比较
由表2可见:四倍体的叶绿素、硝态氮含量分别比二倍体显著降低了20.83%和48.75%;可溶性糖和纤维素含量分别比二倍体显著提高了2.78%和40.95%。可溶性蛋白和有机酸含量相比于二倍体分别提高9.92%和13.15%,但无显著性差异(表2)。
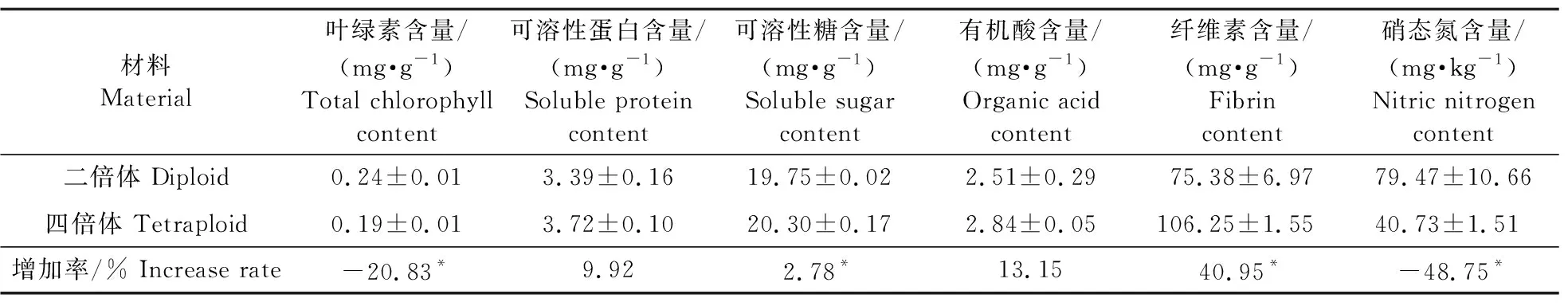
表2 二、四倍体不结球白菜‘五月慢’营养品质比较Table 2 Comparison of nutritional substance content between diploid and tetraploid plants of non-heading Chinese cabbage ‘Wuyueman’
2.6 二、四倍体‘五月慢’光合特性分析
由图4可见:随着光照强度增加,二、四倍体的净光合速率(Pn)显著提高,四倍体的增长趋势大于二倍体,当光照强度低于1 200 μmol·m-2·s-1时,二、四倍体的Pn都持续增加,当光照强度达到1 200 μmol·m-2·s-1时,Pn不再随着光照强度的增加而增加,基本达到饱和;当光照强度在500~1 500 μmol·m-2·s-1时,四倍体的Pn大于二倍体,光合作用效率更高。气孔导度(Gs)随着光照强度的增加而增强,相同光强下四倍体气孔导度大于二倍体。胞间CO2浓度(Ci)随着光照强度的增加而降低,当光照强度为250~1 500 μmol·m-2·s-1时,四倍体Ci低于二倍体,其余光照强度下二、四倍体Ci几乎一致。由表3可见:叶片的蒸腾速率(Tr)随着光照强度的增加持续增加,在相同光照强度下,四倍体的Tr高于二倍体。四倍体的光饱和点(LSP)、光补偿点(LCP)、暗呼吸速率(Rday)与二倍体比较分别增加了13.47%、24.02%、12.12%,差异显著;Pmax增加了2.61%,无显著性差异;表观量子效率(AQY)降低了9.26%,差异显著。
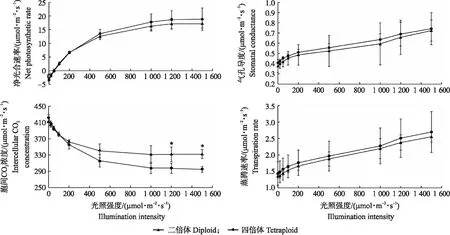
图4 二、四倍体植株光合特性比较分析Fig.4 Comparison of the photosynthetic characteristics of diploid and tetraploid plants
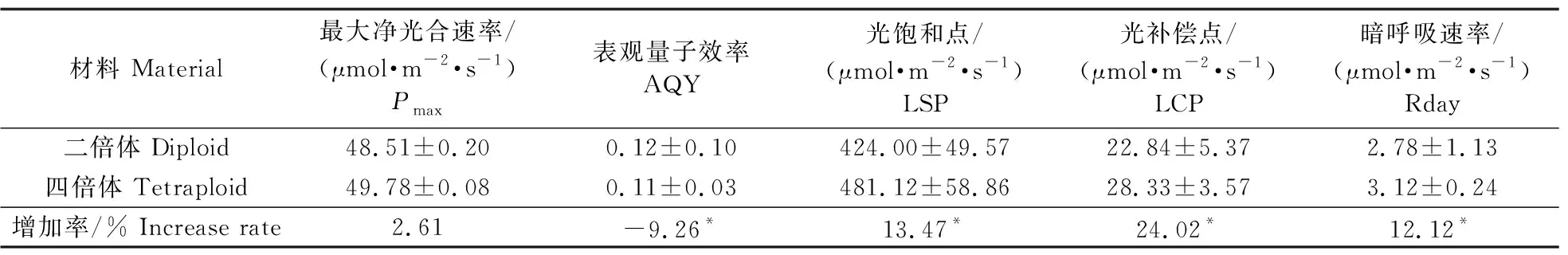
表3 二、四倍体植株的光响应曲线参数的比较Table 3 Comparison of the parameters of light response curves of diploid and tetraploid plants
2.7 二、四倍体‘五月慢’抗病性分析
采用灰霉菌侵染二、四倍体‘五月慢’植株叶片,并采用实时定量PCR检测灰霉菌在二、四倍体‘五月慢’中的表达。由图5可见:二者均能被灰霉菌侵染,但与二倍体相比,同源四倍体叶片灰霉菌菌斑较小(图5-A),定量分析后发现四倍体叶片灰霉菌含量相比二倍体降低90.10%(图5-B),且差异显著,表明诱导后的四倍体的抗病性更强。

图5 灰霉菌侵染二、四倍体不结球白菜‘五月慢’分析Fig.5 Analysis of Botrytis cinerea infection in diploid and tetraploid plants of non-heading Chinese cabbage ‘Wuyueman’A. 灰霉菌侵染表型(红色圆圈内为灰霉菌菌斑);B. 灰霉菌定量分析结果。A. Botrytis cinerea infection phenotype(The red circle is B.cinerea):B. Quantitative analysis results of B.cinerea.
3 讨论
解谜[25]研究表明,用浓度为2 g·L-1的秋水仙素溶液处理山葡萄诱变效果最好,成活率为16.7%,变异率达10.0%。本试验中,不结球白菜用浓度为2 g·L-1的秋水仙素溶液处理后,成活率为78.29%,变异率为8.29%。高优洋[26]研究发现,多倍体西瓜与二倍体相比叶片肥厚、茎节变短。在本研究中,四倍体‘五月慢’与二倍体的农艺性状相比,叶宽、十叶厚、叶柄厚、花器官、种子和种荚方面都有增长趋势,但在株高和开展度上有所降低,株型更加紧凑,这与邵帅旭等[27]对四倍体‘紫菜薹’的研究结果一致,说明多倍体植株器官的巨大性并不一定引起整体植株的增大。营养品质方面,四倍体可溶性糖、可溶性蛋白、有机酸、纤维素含量相比于二倍体分别提高了2.78%、9.92%、13.15%、40.95%,可能由于四倍体部分农艺性状的提升能够合成更多有机物,营养品质得到提高[28];叶绿素、硝态氮含量分别比二倍体降低了20.83%、48.75%,与张虹等[29]关于多倍体枸杞的研究结果一致,可能是染色体拷贝数的增加导致细胞结构功能异常、生命代谢活动受到了阻碍。
光合特性可以作为植物适应性和抗性强弱的指标,植物的表观量子效率(AQY)、光补偿点(LCP)、光饱和点(LSP)和暗呼吸速率(Rday)是衡量植物光合特性的重要参数。张源珊[30]测量了二倍体、四倍体彩叶芋的光响应曲线,发现四倍体的净光合速率、蒸腾速率、气孔导度等光合特性均高于二倍体。本研究中,四倍体‘五月慢’的LSP、LCP、Rday均高于二倍体植株,说明相同光照条件下四倍体捕获光能的效率更高,合成更多的光合产物,制造更多有机物质,与Cao等[31]关于多倍体百合的研究结果一致;四倍体植株的蒸腾速率、气孔导度比二倍体高,气孔导度整体增长趋势与蒸腾速率保持一致,说明气孔导度是影响蒸腾速率的最主要原因之一。多倍体化引起的细胞和光化学变化提高了不结球白菜的光吸收能力和光转化能力,染色体组数的加倍使基因剂量的增加导致生理生化活性增强,也进一步提高了其光合性能,制造更多的有机物,能够提高产量和品质,因此不结球白菜‘五月慢’的同源四倍体植株光合特性优于二倍体。
植物染色体加倍后,抗逆、抗病性会得到增强,岳敏等[32]测定半枝莲植株体内抗逆性生理指标发现,多倍体植株表现出更强的抗逆性。张蜀宁等[33]研究低温胁迫对不同倍性不结球白菜生长及生理生化特征的影响,发现四倍体植株抗寒性更强。本试验研究发现,四倍体‘五月慢’表现出更强的抗病性,更能够抵抗灰霉菌的侵染,从而也提高了不结球白菜产量和品质。可能是由于染色体加倍导致抗逆防御系统相关基因表达量增加,使多倍体植物在生长和抗逆方面表现出一定优势。
本试验通过秋水仙素诱导出的不结球白菜同源四倍体在营养品质、光合特性、抗病能力等方面都表现出了优异性,为不结球白菜的种质创新提供了依据。由于经秋水仙素诱导加倍后的植株染色体数发生变化,不能进行正常的染色体配对,所以四倍体‘五月慢’的育性有所下降,需要后期通过多代驯化或其他生物技术加以改善,从而早日投入生产实践中。
