非生物胁迫下茶树小G蛋白基因CsRAC5的功能分析
2022-05-20徐晓寒叶小丽邢安琪武子辰孙怡朱江媛王艮梅王玉花
徐晓寒,叶小丽,邢安琪,武子辰,孙怡,朱江媛,王艮梅,王玉花*
(1.南京农业大学园艺学院,江苏 南京210095;2.南京林业大学南方现代林业协同创新中心,江苏 南京 210037)
茶树(Camelliasinensis)对其生长环境的变化非常敏感,例如极端温度、盐度和干旱等[1-2]。在各种逆境(非生物胁迫)下,茶树的生长发育以及茶叶产量、品质受到了严重影响。已有研究表明,干旱胁迫可以通过影响含硫化合物的代谢来影响光合作用,也可以通过影响茶树多酚的生物合成来影响香气物质[3]。因此,研究茶树抵抗非生物胁迫的内在分子机制能够为育种和栽培提供理论指导。
小G蛋白(small GTPase)是一种家族成员众多的能够参与调控细胞各种生命活动的信号转导蛋白,普遍存在于真核细胞中,可分为Ras超家族(包括5个亚家族)和异源三聚G蛋白[4-5]。RAC,又称ROP,属于Ras超家族中的Rho亚家族,是植物基因组中唯一编码的植物特异性RAC小G蛋白[5]。研究表明,RAC在植物中发挥着重要作用,包括细胞骨架的组织动力学、囊泡运输、激素信号传导[6-7]。此外,近年来的许多研究也表明,RAC还可以调节细胞形态发生、根毛发育中的极性生长、花粉管生长、激素反应、对致病菌和非生物胁迫的抵抗以及参与光合作用介导的气孔关闭[8-11]。同时,RAC/ROP也是植物防御和抗逆性的“分子开关”。林群婷等[12]发现水稻OsRAC5基因能够在干旱、高温、盐、脱落酸(ABA)等非生物胁迫下被诱导表达。转基因OsRac1水稻[13]和转基因Rac13棉花[10]通过调节活性氧(ROS)的产生来响应植物的防御反应。在高盐环境中,转NtRop1基因拟南芥能够通过抑制根生长和提高电导率表现出比野生型更好的耐盐性[14]。此外,AtRbohD和AtRbohF能够通过影响Ca2+信号转导和植物生长素的响应,正向调控脱落酸抑制初生根的生长[15]。
在前期研究中,已从茶树中鉴定并克隆了CsRAC5完整的开放阅读框碱基序列,并进行了生物信息学、组织特异性表达和低温响应表达分析等,发现CsRAC5参与茶树低温响应[16]。本研究以茶树品种‘龙井长叶’为材料,采用实时荧光定量PCR(RT-qPCR)法研究了3种非生物胁迫(高盐、干旱和脱落酸)下茶树中CsRAC5的表达,并探讨CsRAC5与非生物胁迫的对应关系。此外,通过农杆菌介导浸染法获得CsRAC5转基因拟南芥,并通过对盐胁迫、干旱处理和ABA处理下转基因拟南芥的萌发率、根长和生理生化等指标的测定,验证CsRAC5在非生物胁迫下的功能,将为进一步研究茶树RAC/ROP蛋白的生物学功能提供理论依据。
1 材料与方法
1.1 试验材料
通过对前期低温胁迫下‘龙井长叶’花粉管转录组数据库进行BLAST比对获得AtRAC5高度同源基因[16]。本试验继续选用茶树品种‘龙井长叶’为研究对象。将水培茶苗放入RXZ型人工智能气候箱(宁波江南仪器厂),光照/黑暗时间为12 h/12 h,光照度为30 000 lx,昼/夜温度25 ℃/20 ℃,相对湿度75%~80%。培养4周后选择长势一致的茶苗分别进行盐胁迫(200 mmol·L-1NaCl)、激素处理(25 μmol·L-1ABA)和干旱处理(20% PEG6000)。每个处理设置3个生物学重复,每个重复设置3株茶苗。分别于处理0、2、12、24 h后取茶苗顶端至下第3~4片成熟叶,经液氮速冻后,保存于-80 ℃冰箱备用。
本研究中所使用的野生型拟南芥为Columbia-0型,大肠杆菌菌株为DH5α,农杆菌菌株GV3101-pSoup购于愚公生物公司。
1.2 试验方法
1.2.1 RNA提取以及cDNA合成参照EASYspin Plus 多糖多酚/复杂植物RNA快速提取试剂盒(北京艾德莱生物科技有限公司)说明书提取茶树叶片的总RNA,4 ℃冷却后保存于-80 ℃。以茶树叶片总RNA为模板按照TransScript®All-in-one First-Strand cDNA Synthesis SuperMix for RT-qPCR(北京全式金生物技术有限公司)说明书合成cDNA。
1.2.2CsRAC5表达载体的构建及转基因拟南芥的获得在泛素启动子的控制下,将测序正确的无终止密码子的CsRAC5完整ORF区克隆产物连接至植物表达载体,得到重组载体pGreenII-Hyg-UBQ10-Rac5-eGFP[16],克隆CsRAC5完整ORF区的引物参考前期研究方法[17]。将重组载体转入农杆菌后通过农杆菌介导浸染法获得转基因拟南芥T0代。经过25 μg·mL-1潮霉素抗性筛选,直到获得纯合的T3转基因拟南芥种子。
1.2.3 定量PCR分析使用Primer Premier 5设计CsRAC5荧光定量特异性引物CsRAC5-RT-F/R以及CsRAC5全长引物CsRAC5-ORF-F/R。采用2-ΔΔCT法计算CsRAC5的相对表达量,每种胁迫单独计算并以胁迫0 h叶片中的表达量为对照。以β-actin基因作为茶树叶片的内参基因,荧光定量及内参基因引物序列参考前期研究[18]。荧光定量PCR反应体系为:SYBR GreenⅠ10 μL,正、反引物各0.4 μL,模板DNA 1 μL,补充ddH2O至20 μL。荧光定量PCR反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,65 ℃ 10 s,共40个循环。通过PCR使用CsRAC5全长引物对T3代转基因拟南芥进行鉴定。
1.2.4 拟南芥的萌发率、成活率、表型及根长测定拟南芥野生型(WT)和经验证过的转基因拟南芥株系(OE6和OE7)分别播种于1/2MS固体培养基上,经4 ℃春化3 d后分别进行盐胁迫(50、100 mmol·L-1NaCl)、干旱处理(6% PEG6000)和外源ABA处理(0.25、0.50 μmol·L-1ABA)处理,对照组(Control)不做任何处理。所有处理均在光照培养箱中进行,光照/黑暗时间为8 h/16 h,昼/夜温度为25 ℃/22 ℃,湿度为(75±5)%,每个处理3次生物学重复。萌发率和成活率统计:每个处理播种100粒拟南芥种子,连续 7 d 每天记录种子萌发情况(当胚根完全穿透种皮,认为种子已萌发),并于播种后7 d拍照记录表型,播种后14 d观察成活率。根长的测定:每个处理播种10粒拟南芥种子,于播种后7 d使用植物活体成像系统(PIXIS 1024B,Princeton Instruments,美国)对拟南芥幼苗进行扫描成像并使用Image J软件测量,计算其主根长度。
1.2.5 拟南芥生理指标的测定将在1/2MS固体培养基上生长2周的WT、OE6和OE7移栽至含有营养土(珍珠岩∶土壤∶蛭石质量比为1∶2∶1)的花盆中,在光照培养箱里培养4周后,挑取长势一致的野生型拟南芥和转基因拟南芥进行100 mmol·L-1NaCl根灌处理,以根灌蒸馏水作为对照,处理组及对照组均设置 6个花盆作为生物学重复,每个花盆保留2株拟南芥。处理2 d后取样,测定丙二醛、可溶性糖和叶绿素含量。根据AOGENE试剂盒说明书测定拟南芥叶片丙二醛含量,采用蒽酮-硫酸法测定总可溶性糖含量[19],采用丙酮提取法测定叶绿素含量[20]。
1.3 数据处理
采用Excel 2016软件处理试验数据。采用IBM SPSS Statistics 19、Canoco 5以及SigmaPlot 12.5进行数据的统计分析以及图形绘制,采用Tukey HSD方法进行显著性差异比较。
2 结果与分析
2.1 非生物胁迫下茶树叶片中CsRAC5的表达量分析
由图1可见:在盐胁迫、干旱处理和ABA处理下茶树叶片中CsRAC5的相对表达量均显著下降(P<0.05)。茶树叶片CsRAC5的相对表达量在盐胁迫和干旱处理2 h后即显著下降,而ABA处理则在处理 12 h 后才显著下降。
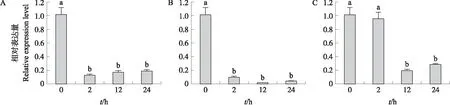
图1 茶树叶片中CsRAC5在非生物胁迫下的表达分析Fig.1 Expression analysis of CsRAC5 under abiotic stresses in Camellia sinensis leavesA. 盐胁迫(200 mmol·L-1 NaCl);B. 干旱处理(20% PEG6000);C. ABA处理(25 μmol·L-1 ABA)。A. Salt stress(200 mmol·L-1 NaCl);B. Drought treatment(20% PEG6000);C. ABA treatment(25 μmol·L-1 ABA).不同小写字母表示显著差异(P<0.05)。下同。Different lowercase letters represent significant differences(P<0.05). The same as follows.
2.2 CsRAC5转基因拟南芥鉴定
对在含潮霉素的1/2MS培养基上全部成活的转基因拟南芥株系提取RNA并合成cDNA,经RT-PCR扩增后电泳结果(图2)显示,成功获得3株转基因CsRAC5的拟南芥株系:OE2、OE6、OE7,且在野生型拟南芥(WT)中并未检测出CsRAC5的片段。挑选CsRAC5条带较亮的拟南芥株系OE6和OE7,用于后续的非生物胁迫响应试验。

图2 CsRAC5转基因拟南芥株系鉴定Fig.2 Identification of CsRAC5 transgenic Arabidopsis thaliana linesWT:野生型 Wild-type;OE2、OE6、OE7:转基因株系 Transgenic lines.
2.3 CsRAC5转基因拟南芥对非生物胁迫的响应
2.3.1 非生物胁迫下转基因拟南芥的萌发率如图3所示:在对照条件下,2个CsRAC5转基因拟南芥株系的萌发率与野生型没有明显差别。随着培养基中NaCl浓度的增加,OE6、OE7的萌发率与WT之间的差距越来越大,转基因株系在100 mmol·L-1NaCl处理下的7 d萌发率仅维持在80%左右,而WT则依旧能够维持在95%以上。在ABA处理下,3个拟南芥株系种子的7 d萌发率均随ABA浓度的升高而降低,且ABA对OE6、OE7的萌发抑制明显高于WT。CsRAC5转基因拟南芥种子对干旱胁迫的响应主要表现为播种后前3 d的萌发延迟,而在播种后4 d开始,OE6、OE7的萌发率与WT持平。
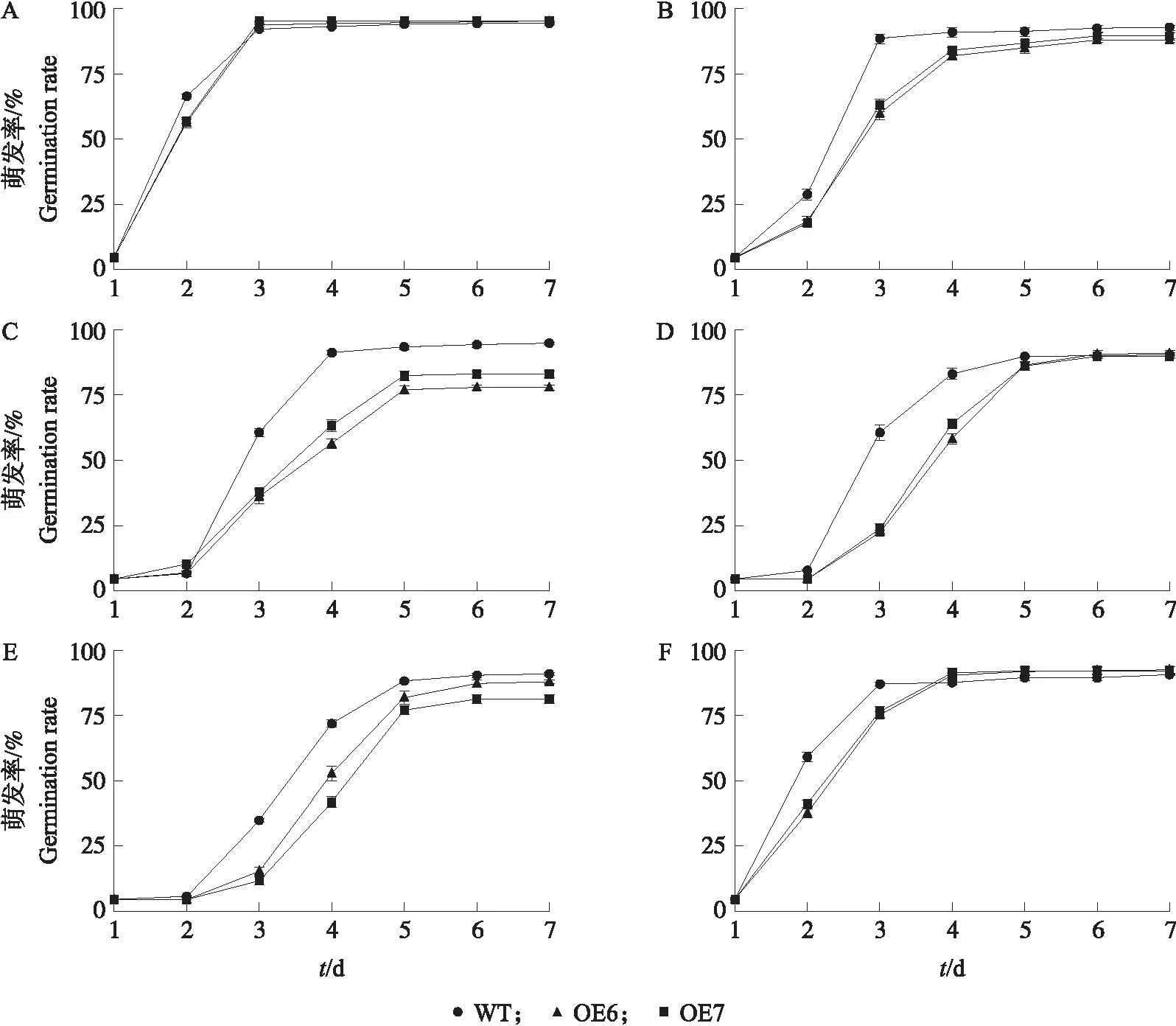
图3 非生物胁迫下野生型与转基因拟南芥的萌发率Fig.3 Germination rate of wild-type and transgenic A. thaliana under abiotic stresses A—F分别为对照、50 mmol·L-1 NaCl、100 mmol·L-1 NaCl、0.25 μmol·L-1 ABA、0.50 μmol·L-1 ABA和6% PEG6000处理。A-F are control,50 mmol·L-1 NaCl,100 mmol·L-1 NaCl,0.25 μmol·L-1 ABA,0.50 μmol·L-1 ABA and 6% PEG6000 treatment,respectively.
2.3.2 非生物胁迫下转基因拟南芥的表型由图4可见:在所有处理下,3个拟南芥株系均可顺利长出绿色子叶。在对照和盐胁迫下,OE6、OE7与WT之间并无明显表型差异。在ABA处理下,转基因株系OE6和OE7出现了较为明显的子叶变白现象;在干旱处理下,3个拟南芥株系均出现子叶卷曲并变紫的现象,且转基因株系的子叶卷曲程度略重于WT,但子叶变紫程度略轻于WT。

图4 非生物胁迫下野生型与转基因拟南芥的表型Fig.4 Phenotype of wild-type and transgenic A. thaliana under abiotic stresses
2.3.3 非生物胁迫下转基因拟南芥的成活率由图5可见:在干旱处理下,OE6、OE7的成活率与WT并无显著差异,且均保持在95%以上。盐胁迫和ABA处理显著抑制了拟南芥的成活率,且呈明显的剂量效应。此外,虽然100 mmol·L-1NaCl处理比0.50 μmol·L-1ABA处理的转基因株系萌发率低,但成活率却更高。

图5 非生物胁迫下野生型与转基因拟南芥的成活率Fig.5 Survival rates of wild-type and transgenic A. thaliana under abiotic stresses 不同小写字母表示同一处理不同拟南芥株系间显著差异(P<0.05),不同大写字母表示同一拟南芥株系在不同处理间显著差异(P<0.05)。下同。Different lowercase letters represent significant differences among different A. thaliana lines in the same treatment(P<0.05),and different uppercase letters represent significant differences among different treatments of the same A. thaliana line(P<0.05). The same as follow.
2.3.4 非生物胁迫下转基因拟南芥的根长由图6可见:所有非生物胁迫处理均导致拟南芥根系缩短,且在盐胁迫和ABA处理下显示明显的剂量依赖性。盐胁迫以及低浓度ABA处理导致转基因拟南芥根长显著低于WT,而0.50 μmol·L-1ABA和6% PEG6000处理下OE6、OE7根长与WT差异不显著。

图6 非生物胁迫下的野生型与转基因拟南芥的根长Fig.6 Root length of wild-type and transgenic A. thaliana under abiotic stresses
2.3.5 非生物胁迫下转基因拟南芥的丙二醛、可溶性糖及叶绿素含量由图7可见:在对照条件下,2个转基因株系OE6和OE7的丙二醛、可溶性糖以及叶绿素含量与对照组无显著差异。100 mmol·L-1NaCl处理2 d后,3个拟南芥株系MDA含量均比对照组显著增加,其中WT增加了48.73%,OE6和OE7分别增加了97.49%和101.72%,且转基因拟南芥在盐处理下的MDA含量也显著高于野生型,表明盐胁迫更容易损伤转基因拟南芥细胞膜脂。100 mmol·L-1NaCl处理下,转基因拟南芥可溶性糖含量显著降低,OE6和OE7分别降低了29.35%和38.36%。表明CsRAC5转基因拟南芥在盐胁迫下可能无法维持正常的可溶性糖水平以供给植物足够的能量来维持正常的生长发育。与可溶性糖含量类似,100 mmol·L-1NaCl处理下,转基因拟南芥叶绿素含量显著降低,表明转基因拟南芥在盐环境下无法维持正常的光合性能来应对盐处理对植株的氧化胁迫。

图7 100 mmol·L-1 NaCl处理下野生型与转基因拟南芥的丙二醛(A)、可溶性糖(B)和叶绿素(C)含量Fig.7 Contents of MDA(A),soluble sugar(B)and chlorophyll(C)of wild-type and transgenic A. thaliana treated with 100 mmol·L-1 NaCl
3 讨论与结论
CsRAC5是茶树中的1个ROP/RAC基因,其功能尚未被研究。在前期工作中,我们克隆了CsRAC5基因的基因组序列,进行了生物信息学分析,检测了其在茶树不同组织部位中的表达水平[16]。为了进一步研究CsRAC5的生理功能,我们检测了茶树叶片中CsRAC5在高盐、干旱和外源ABA处理下的表达模式,发现3种处理在24 h内均诱导了CsRAC5的表达下调。类似的表达模式在香蕉MaROP-3a和MaROP-5h也已被报道[21],但在其他物种中,如拟南芥[22]、烟草[14]和水稻[23],高盐、干旱和ABA诱导ROP/RAC表达上调。植物对非生物胁迫的防御反应中所产生的ROS可能来自多个方面,包括NADPH氧化酶、草酸氧化酶和过氧化物酶等[24]。不同物种中的ROP/RAC蛋白可能会作用于不同的酶,进而导致这些ROP/RAC基因在胁迫下的不同表达模式。此外,尽管茶树CsRAC5属于高度保守的ROP/RAC基因,但它与其他多数物种中的ROP/RAC基因的系统发育关系较远,这也暗示了CsRAC5可能作用于不同的酶,具体的作用机制还需要进一步的研究。ABA参与各种环境胁迫过程[25],并且已有报道表明拟南芥AtROP6参与了ABA的负调控[26]。在本研究中,外源ABA抑制了CsRAC5基因的表达,且转基因拟南芥植株也表现出对ABA更高的敏感性。这可能与CsRAC5基因编码蛋白C-末端的CAAL基序有关[16]。
胁迫条件下的种子萌发以及后续的营养生长状况可以在一定程度上表征植株对胁迫环境的响应。在本研究中,转基因拟南芥比野生型植株对盐和ABA更加敏感,这可以从盐和ABA处理下转基因拟南芥更低的种子萌发率、成活率以及更短的根长中看出。这种敏感性可能是由于转基因植物产生了较高水平的H2O2,H2O2是参与包括ABA信号通路在内的许多细胞过程的重要信号并使细胞膜脂过氧化[14]。本研究中,转基因植株MDA含量增加,这也表明转基因拟南芥在盐处理下产生了更多的H2O2从而遭受了更加严重的氧化损伤,进而导致转基因拟南芥对盐胁迫的敏感性。这可能是由于高盐环境降低了CsRAC5的表达量,从而部分调控了转基因植株的盐敏感性。盐胁迫对植物造成的危害还表现为渗透胁迫。可溶性糖是植物细胞在盐胁迫条件下所必需的渗透调节剂[27-28]。魏炀郴等[29]研究发现爬山虎中可溶性糖含量随盐浓度的升高表现出“低促高抑”的现象,这表明在一定的盐浓度范围内植物能够通过合成可溶性糖进行渗透调节,而过高的盐浓度则超过了可溶性糖的渗透调节范围,并且高盐胁迫也可能会破坏植物中可溶性糖的合成途径。在本研究中,转基因株系OE6和OE7在盐胁迫下可溶性糖含量显著低于野生型植株。这也进一步验证了盐胁迫严重影响了转基因拟南芥可溶性糖合成途径来降低其对盐胁迫的耐受性。叶绿素含量能通过调节光合作用维持抗氧化能力[30]。本研究发现转基因植株在盐胁迫下叶绿素含量均较野生型低,表明盐胁迫还能通过降低转基因拟南芥光合色素含量来降低其抗盐性。
干旱能够严重制约植物种子的萌发、生长,甚至使植物永久萎蔫而死亡[31]。本研究发现在模拟轻度干旱处理下转基因拟南芥与野生型株系仅在播种后的3 d内的萌发率有明显差异,这可能与干旱胁迫下茶树叶片中CsRAC5表达水平的下调有关系,表明转基因拟南芥在干旱处理初期的抗旱能力低于野生型。因此,转基因拟南芥在遭受干旱胁迫一段时间后能够激活其他的抗旱途径。
综上所述,CsRAC5转基因拟南芥比野生型拟南芥对盐胁迫和ABA处理更加敏感,无论是萌发率、成活率、根长均表现为野生型拟南芥较转基因拟南芥更高,而转基因拟南芥仅在干旱处理初期较野生型拟南芥更敏感,因此仍需进一步研究CsRAC5在植物中的抗旱性,如不同发育阶段的转基因拟南芥对干旱处理的响应。
